蜂毒的主要肽成分—蜂毒肽在癌症治疗中的应用
张红艳,刘 锐,王小巍,王东凯
蜂毒的主要肽成分—蜂毒肽在癌症治疗中的应用
张红艳,刘 锐,王小巍,王东凯*
(1. 沈阳药科大学 药学院,辽宁 沈阳 110016)
蜂毒肽是一种具有螺旋结构的两亲性多肽,具有抗炎、抗病毒、抗菌和降血压等作用。近年来,发现蜂毒肽应用于癌症治疗具有独特优势,作者对蜂毒肽的抗癌机制及其在药学领域中的应用进行总结。以国内外40篇文献为依据,综述了蜂毒肽的结构、抗肿瘤应用的机制及为了规避蜂毒肽溶血性问题、非特异性作用以及易被代谢降解等缺点的手段等。与蜂毒肽已被证明在多种癌症的临床前研究中有效,并可通过抗体结合、基因转染、纳米技术或与化疗药物协同给药等手段,增加蜂毒肽靶向性与特异性,解决其在肿瘤治疗中的问题。
药剂学;癌症治疗;综述;蜂毒肽;抗癌机制;靶向给药;多肽化合物
癌症是全世界人类发病率和死亡率较高的疾病之一。在癌症中,基因调控蛋白在细胞内的激活、表达和定位的改变影响了信号通路的传导。化疗、放疗、免疫疗法和基因治疗被认为是治疗癌症的主要选择,但这些疗法会有正常细胞杀伤性和多药耐药性。因此,从自然资源中寻找新的治疗药物已成为一种重要的替代方法[1]。动物毒液是由成百上千种蛋白质、肽和小分子的生物活性物质组成的复杂混合物。近年来被视为包含许多有希望用于广泛医疗应用的候选药物[2]。蜂毒肽是从蜂毒中提取出来的主要成分,分子量小、两亲性和空间结构独特等特点有利于它进入脂质双分子层中,破坏膜的通透性,这些特征为医疗应用及新药开发提供了新的思路。本文作者通过对蜂毒的主要成分、蜂毒肽的空间结构和抗癌机制以及增加蜂毒肽靶向性与特异性的多种修饰手段进行综述,旨在了解蜂毒肽的药理作用及抗癌能力,以便更有利于蜂毒肽在癌症治疗中的应用。
1 蜂毒的组成及疗效
蜂毒是从蜜蜂中提取的复杂混合物,其包含多种肽成分:肽类如蜂毒肽(melittin,MEL)、蜂毒明肽(apamin)、阿托拉品(adolapin)和肥大细胞脱粒肽(MCD)等;酶如磷酸酯酶2(PLA2)、透明质酸酶、酸性磷酸酯酶和--葡糖苷酶和溶血磷脂酶等;生物活性胺如组胺、多巴胺和去甲肾上腺素和非肽成分[3]。蜂毒主要成分及疗效如表1所示[4]。
2 蜂毒肽的结构与构象
蜂毒肽是由26个氨基酸残基组成的碱性多肽(分子式为C131H229N39O31)[5],约占蜂毒干质量的50%[6],是蜂毒的主要抗肿瘤活性物质,其化学结构式见图1。
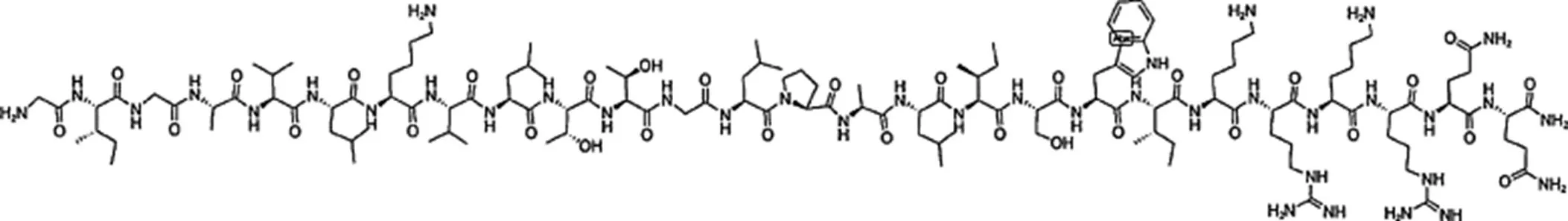
Fig. 1 Chemical structure of melittin
其氨基酸序列为Gly-Ile-Gly-Ala-Val-Leu-Lys-Val-Leu-Thr-Thr-Gly-Leu-Pro-Ala-Leu-Ile-Ser- Trp-Ile-Lys-Arg-Lys-Arg-Gln-Gln。由于链中氨基酸的特定排列,蜂毒肽是两亲性分子,其中非极性、疏水性和中性氨基酸位于N-末端(1~20个氨基酸),而亲水性和碱性氨基酸位于C-末端(21~26个氨基酸)[7]。
虽然蜂毒肽含有大量的疏水性氨基酸,但是它极易溶于水。Tissera等[8]通过研究蜂毒肽与阳离子多肽(Arg-7和Lys-5)和蜂毒肽与膜的相互作用机制发现,在水相、低浓度或作用时间较短时正电位增加,蜂毒肽会以无规则卷曲的单体形式存在;随着蜂毒肽浓度的增加(或作用时间增加),会转变成螺旋状的四聚体,更多的肽分子到达脂质体的表面。蜂毒肽的聚集效应有利于肽分子进入脂质双分子层中。蜂毒肽与带负电的膜表面结合,然后通过孔隙形成干扰磷脂双层的完整性,伴随着分子的渗漏以及渗透性的增强,最终导致细胞裂解。蜂毒肽被认为是癌症化学疗法中最有吸引力的候选者,因为其膜电位更高并且不太可能产生膜抗性,因此对肿瘤细胞膜可造成更多损害[9]。
低剂量的蜂毒肽会产生抗炎作用[10]及许多药理作用,而肿瘤治疗中多采用高剂量,考虑到高剂量的蜂毒肽可能会引起瘙痒、发炎和局部疼痛,所以利用纳米载体技术等对其进行修饰以提高蜂毒肽的使用安全性[11],纳米载体的结构特征均可在蜂毒肽对癌细胞的细胞毒性作用以及抗炎作用中发挥重要作用[12]。
3 蜂毒肽的抗肿瘤机制
3.1 直接杀伤肿瘤细胞—打孔作用
蜂毒肽对于膜结构具有较好的亲和力,会对膜双分子层产生裂解破坏作用,最终造成细胞裂解死亡。目前解释蜂毒肽的打孔作用有以下模型:地毯模型、去污剂模型、脂质双环状模型或桶状模型[8]。蜂毒肽影响细胞膜稳定性主要是通过在细胞上直接形成孔隙溶解细胞和激活肿瘤细胞上的磷脂酶从而使细胞死亡,同时蜂毒肽还可以根据膜浓度的比例抑制或激活磷脂酶的活性[13]。靳弟等[14]通过MTT法检测蜂毒肽对H22细胞的增殖抑制情况,发现蜂毒肽在体外对H22细胞有明显的抑制作用且效果随剂量的增大而增强。Mufson等[15]指出蜂毒肽与细胞膜作用,导致磷脂酰基断裂,增加了磷脂水解酶对磷脂的分解,从而磷脂中释放的花生四烯酸增加。这表明蜂毒肽可能进入磷脂双分子层并具有表面活性。
3.2 诱导细胞凋亡
细胞凋亡是指机体为了维持内环境的稳定和更好的适应生存环境,由基因控制的细胞自主性、有序性的死亡,它涉及一系列基因的激活、表达以及调控等作用,具有生理性和选择性。蜂毒肽被认为是磷脂酶A2(PLA2)激活剂和Ca2+内流诱导剂,它诱导细胞凋亡的主要途径是通过抑制RAS、NF-κB信号以及钙调蛋白发挥作用。蜂毒肽可特异性选择高表达RAS基因的培养细胞,通过消除表达癌基因蛋白的细胞而发挥逆转作用。蜂毒肽逆转RAS逆转细胞的基础是由于它促进钙离子内流而高度活化RAS转化细胞的磷脂酶A2(PLA2)的活性[16];NF-κB信号通路的激活,需要不同激酶。蜂毒肽可以靶向磷酸化IKK复合体的激酶群,抑制IKK的活性,阻止IκB的降解以及NF-κB在核内的翻译过程,使得此信号通路被彻底切断,诱导细胞发生凋亡[17]。舒英等[18]利用蜂毒肽对肾小管细胞凋亡与急性肾损伤AKI的关系进行探究,通过对小鼠尾静脉注射蜂毒肽,检测TNF-水平及肾小管上皮细胞凋亡情况,发现在蜂毒肽致肾小管上皮细胞凋亡中,TNF-信号通路被激活,NF-κB信号通路受抑制,TNF-/NF-κB信号通路共同参与蜂毒肽的致凋亡作用。Tu等[19]发现蜂毒会诱导人黑色素瘤A2058细胞凋亡,而不能诱导正常皮肤成纤维细胞Detroit 551凋亡。在无钙条件下孵育细胞有效地减少了蜂毒诱导细胞的凋亡。并用蜂毒的主要成分-蜂毒肽处理A2058细胞导致钙水平和细胞杀伤效应相似的升高,发现蜂毒肽是蜂毒引起细胞凋亡的决定性因素。
此外,蜂毒肽还通过作用于细胞内多个信号通路,诱导肿瘤细胞凋亡。Moon等[20]报道蜂毒肽可通过下调Akt信号通路诱导白血病U937细胞凋亡,并发现MEL诱导的细胞凋亡伴随着Bcl-2的下调和caspase-3的激活,以及凋亡蛋白抑制剂(IAP)家族蛋白的下调。这表明蜂毒肽诱导人白血病U937细胞凋亡的关键调节因子包括被通过Akt信号通路控制的Bcl-2和caspase-3。Wang等[21]研究了蜂毒肽在胰腺导管腺癌(PDAC)中的疗效及其机制,发现其是通过促进细胞凋亡和细胞周期停滞来抑制肿瘤生长的,且蜂毒肽会显著调节胆固醇生物合成途径,如胆固醇途径基因clusterin(clu)被高度下调。
3.3 调节细胞周期
细胞周期是细胞生长分裂的过程,由一系列信号通路调节,细胞通过这些通路生长、复制DNA并分裂。其中还包含错误纠正机制,然而在癌症中这种纠正机制失效,导致细胞不受控制的增殖,最终导致肿瘤的生长和发展。一些研究已经表明,蜂毒肽可以通过调节肿瘤的细胞周期,起到抑制肿瘤生长的作用。Wu等[22]发现在不影响细胞凋亡的情况下,蜂毒肽抑制了肝癌SMMC-7721细胞的增殖,延缓了G0/G1细胞周期的进程。DNA甲基化在多种癌症的肿瘤抑制基因方面起着至关重要的作用。而DNA甲基化的关键机制成分是甲基-CpG-结合蛋白(MBDs),其中MECP2是最常见的MBD蛋白[23],研究还表明在SMMC-7721细胞中,蜂毒肽通过SHH途径下调MECP2,从而抑制细胞生长。黄舒然等[24]检测细胞周期发现,蜂毒肽作用24 h后S期细胞比例上升,而 G0/G1期比例明显下降,表明蜂毒肽对人胃癌细胞株 BGC-823 的增殖具有抑制作用,且能够引起该细胞的凋亡及改变其细胞周期。
3.4 抑制肿瘤转移以及瘤内血管生成
肿瘤转移分为恶性肿瘤细胞从原发部位,经淋巴道、血管或体腔等途径到达其他部位继续生长的这一过程。无法成功控制肿瘤的转移与侵袭是治疗癌症的最大障碍,转移需要破坏细胞外基质(ECM),并由多种信号分子调节,如MMPS和局灶性黏附激酶(FAK)等[25]。研究表明,在表皮生长因子(EGF)诱导下,MMP-9和FAK与表皮生长因子受体(EGFR)有关,并促进肿瘤细胞的运动和侵袭[26]。Jeong等[27]证实了蜂毒肽对EGF诱导的乳腺癌细胞侵袭有抑制作用,特别是蜂毒肽通过阻断NF-κB和PI3K/Akt/mTOR通路抑制EGF诱导的MMP-9的表达,并提出蜂毒肽对乳腺癌细胞的迁移抑制作用可能与抑制mTOR通路有关。
肿瘤的生长和转移离不开肿瘤血管,它是癌细胞的营养通道和转移途径。血管内皮祖细胞(EPCs)具有向肿瘤组织募集性和促血管生成的作用,血管内皮生长因子(VEGF)通过作用于EPCs表面的两种受体VEGFR1和VEGFR2诱导EPCs的增殖。秦刚等[28]发现蜂毒素能明显抑制大鼠骨髓来源的内皮祖细胞的增殖、黏附、迁移和血管形成的能力,其作用机制可能与蜂毒肽抑制内皮祖细胞的磷酸化信号通路,从而下调VEGFR2蛋白表达,并且随着蜂毒素的作用浓度增大,其对内皮祖细胞增殖的抑制力越强。
4 蜂毒肽在抗肿瘤中的应用
蜂毒肽应用于肿瘤治疗具有独特优势,能够在细胞膜上打孔造成细胞裂解死亡,不易产生肿瘤的耐药性。然而,蜂毒肽自身存在的溶血性问题、非特异性作用以及易被代谢降解等缺点,严重阻碍了其在抗肿瘤方面的临床应用。如何在活体内安全有效地运输蜂毒肽抵达肿瘤组织而不产生毒性和不良反应,仍是极具挑战的难题。
4.1 基因真核转染技术
基因真核转染技术自建立以来就引起了很大关注,此技术可将外源基因导入真核细胞并过表达,对于癌症基因治疗,外源基因被转移到恶性人类细胞中以引起细胞死亡[29]。由于裸露的基因不能穿过细胞膜和其他障碍,应设计一种适当的载体,以有效地转移这些基因,并防止其在血液中降解[30]。邵光灿等[31]通过成功构建融合蜂毒肽(melittin)与人变构白介素-2[M-IL-2(88Arg,125Ala)]基因表达的载体,经过RT-PCR及Western blot检测证实重组基因M-IL-2(88Arg,125Ala)可在宫颈癌细胞HeLa和神经胶质瘤细胞U87中表达,经过CCK-8实验及细胞流式仪分析融合蛋白在细胞内的表达对以上两种肿瘤细胞的增殖具有一定的抑制作用。Tarokh Z等[32]对含有胺基的支化聚乙烯亚胺进行改性,通过-琥珀酰亚胺基-3-(2-吡啶二硫基)丙酸(SPDP)交联剂,将氯毒素(CTX)作为PEI的靶头,改善了该聚合物较高的细胞毒性。并将蜂毒肽导入PC3细胞系中,发现靶向纳米粒转染效率明显高于非靶向纳米粒,同时能显著降低PC3细胞的存活率,并对NIH3T3细胞无毒性作用。因此,携带蜂毒素基因的CTX靶向纳米粒可作为前列腺及其他MMP-2阳性癌细胞的基因传递系统。李绍祥等[33]通过在甲胎蛋白转录调控元件(-fetoprotein,AFP)的调控下,将蜂毒肽基因重组到穿梭质粒中,将目的基因重组成腺病毒骨架质粒。将重组腺病毒质粒用PacⅠ酶切线性化后,脂质体介导转染293细胞进行腺病毒的包装。用携带蜂毒肽基因的病毒感染肝癌细胞,成功构建了含有蜂毒素基因的重组腺病毒载体并且发现其抑制肝癌细胞CD54的表达,降低了肿瘤细胞的恶性程度。综上,将蜂毒肽基因和目的基因重组并整合到合适的载体中,可实现癌症的有效治疗。
4.2 靶向纳米给药系统
传统化疗药物在杀伤肿瘤的同时也会对机体正常细胞产生毒性及不良反应。由纳米载体运载化疗药物构成的纳米药物则能够形成特异性杀伤作用,在肿瘤治疗上显示出极大潜力。黄川等[34]发明了一种新型的含蜂毒肽的功能性杂化多肽-melittin,通过将蜂毒肽隐藏在单层磷脂分子层内,有效地解决了其在体内运输中存在的溶血性和非特异性作用的问题,实现了活体内蜂毒肽的安全有效递送,提高了蜂毒肽在体内的循环半衰期,为在活体内使用蜂毒肽治疗肿瘤提供了有效的工具。Soman等[35]将蜂毒肽结合到全氟碳纳米颗粒的外脂质单分子层中合成了一种纳米级的溶细胞肽载体。并已经证明,这种纳米载体在没有任何明显毒性和不良反应的情况下会显著减少肿瘤的生长。此外,此分子靶向的纳米载体通过半融合机制选择性地将蜂毒素运送到多个肿瘤靶点,包括血管内皮细胞和肿瘤细胞。这一创新的分子设计,通过抑制纳米载体中有效的细胞溶细胞肽的广谱裂解潜力,结合被动或主动分子靶向的灵活性,可用于多阶段治疗癌症的广谱溶细胞性肽的化疗。Chuan Huang等[36]设计了一种杂交肽-蜂毒肽(-melittin),强大的螺旋结构使-蜂毒肽能够与磷脂相互作用并自组装成脂质纳米颗粒且包封率大于80%,具有很强的控制纳米颗粒结构的能力(~20 nm)。并通过有效屏蔽蜂毒肽在磷脂单层内的正电荷,从而产生了中性纳米粒子,降低了细胞毒性,拓宽了安全剂量范围。经证实-蜂毒肽-NPs可阻断黑色素瘤细胞的生长,抑制率达82.8%,且治疗中未发现有不良反应,这使其在实体瘤治疗中具有潜在的临床应用价值。尽管蜂毒肽对广谱肿瘤细胞具有细胞毒性,但它对正常细胞也具有毒性,如果没有适当的递送载体,其治疗潜力无法实现。而纳米给药递送系统可以克服这一缺点,在降低蜂毒肽毒性的同时,还可以提高蜂毒肽靶向杀死肿瘤的能力。
4.3 联合给药
釆用蜂毒肽与化疗药物协同配合的方法,也将会突破单一靶标在肿瘤治疗上的限制,为肿瘤的多靶点治疗带来了新的机遇。崔啸晨等[37]通过研究蜂毒肽单独应用及与吉西他滨联用对人胰腺癌细胞的作用,通过cck-8检测法检测不同组别胰腺癌细胞Panc-1的生长增殖情况发现,蜂毒肽和吉西他滨单药即可使胰腺癌Panc-1细胞的生长受到抑制,并表现出一定的浓度依赖性,联合用药要比两药单独应用抑制作用更强,差异具有显著性(<0.05)。其机制与减少pSTAT3的生成,激活内、外源性凋亡途径促进Caspase-3、Caspase-8、Caspase-9蛋白表达有关。方栋等[38]制备了具有协同抗肿瘤作用的茶多酚-蜂毒肽纳米复合物(EMN),并考察其抗肿瘤活性。通过拜耳反应合成了多聚表没食子儿茶素没食子酸酯(polyEGCG),MTT 实验结果表明,polyEGCG和Mel 联合使用的协同系数(CI)小于1.0,具有协同抗肿瘤效果。
4.4 抗体靶向结合
利用2个或2个以上的特异性抑癌分子同时与特异性抗体的靶向结合是一种肿瘤治疗领域的尝试,利用蜂毒肽的抗肿瘤作用,拟将其与肿瘤特异性单链抗体融合表达,在探索其抑瘤作用的基础上,提高其特异性。费丹等[39]将蜂毒肽与抗表皮生长因子受体单链抗体(EGFRscFv)融合表达并进行融合序列优化,用于骨肉瘤治疗研究,证明antiEGFR/MEL可与骨肉瘤细胞 OS732 特异性结合,并抑制骨肉瘤细胞 OS732 的生长,且其抑制作用呈现明显的时间效应和剂量效应趋势。杨光勇等[40]制备了重组抗白细胞介素4受体(IL-4R)单链抗体(singlechainvariable fragment,scFv)与蜂毒肽(melittin,MLT)的融合蛋白。scFv-MLT基因序列大小约1 000 bp,IL-4R单链抗体与蜂毒肽重组蛋白的分子质量在48~63 u内,与预期分子质量52 u相符,scFv-MLT融合蛋白具有较高的特异性。这为进一步研究抗IL-4R单链抗体与蜂毒肽的融合蛋白的靶向生物治疗奠定了基础。
5 结语
蜂毒的主要肽成分蜂毒肽对多种癌症均有抗肿瘤作用,可通过多种信号传导起作用如RAS、NF-κB信号、钙调蛋白和PLA2等,主要可通过直接杀死肿瘤细胞、诱导细胞凋亡、调节细胞周期和抑制肿瘤转移以及瘤内血管生成等多种机制抑制肿瘤生长,最终导致肿瘤细胞凋亡或坏死,并降低肿瘤的多药耐药性。虽然蜂毒肽为肿瘤治疗提供了很多新的解决方案,但由于其自身溶血性问题、非特异性作用以及易被代谢降解等缺点导致其在临床应用方面还有很大不足。一些新兴的医学手段如可通过抗体结合、基因转染、纳米技术及与化疗药物协同给药等,均增加了蜂毒肽靶向性与特异性,可长效持久的将蜂毒肽靶向运输至病变部位。总之,蜂毒肽在抗肿瘤方面具有很广阔应用前景,但如何更安全高效的将蜂毒肽应用于肿瘤治疗仍是一个需要解决的问题。
[1] AMEER K, CHIROM A, ALBERTO B P, et al. Venom as therapeutic weapon to combat dreadful diseases of 21st century: A systematic review on cancer, TB, and HIV/AIDS[J]. Microbial Pathogenesis, 2018, 125: 96-107.
[2] PRASHENTH J R, HASABALLAH N, VETTER I. Pharmacological screening technologies for venom peptide discovery[J]. Neuropharmacology, 2017, 127: 4-19.
[3] SON D J, LEE J W, LEE Y H, et al. Therapeutic application of anti-arthritis, pain-releasing, and anti-cancer effects of bee venom and its constituent compounds[J]. Pharmacology Therapeutics, 2007, 115(2): 246-270.
[4] ZHANG S, LIU Y, YE Y, et al. Bee venom therapy: Potential mechanisms and therapeutic applications[J]. Toxicon, 2018, 148: 64-73.
[5] GAJSKI G, GARAJ-VRHOVAC V. Melittin: a lytic peptide with anticancer properties[J]. Environmental Toxicology and Pharmacology, 2013, 36(2): 697-705.
[6] HABERMANN E. Bee and wasp venoms[J]. Science, 1972, 177 (4046): 314-322.
[7] BERNHEIMER A W, RUDY B. Interactions between membranes and cytolytic peptides[J]. Biochimica et Biophysica Acta (BBA)-Reviews on Biomembranes, 1986, 864(1): 123-141.
[8] TISSERA M J E, DISALVO E A, MARTINI M F, et al. Filling gaps in the knowledge of melittin on lipid membranes[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2019, 561: 136-146.
[9] RADY I, SIDDIQUI I A, RADY M, et al. Melittin, a major peptide component of bee venom, and its conjugates in cancer therapy[J]. Cancer Letters, 2017: S0304383517303324.
[10] RAGHURAMAN H, CHATTOPADHYAY A. Melittin: a membrane-active peptide with diverse functions[J]. Bioscience Reports, 2007, 27(4/5): 189-223.
[11] GIHYUN L, HYUNSU B. Anti-Inflammatory applications of melittin, a major component of bee venom: detailed mechanism of action and adverse effects[J]. Molecules, 2016, 21(5): 616-626.
[12] SON D J, LEE J W, LEE Y H, et al. Therapeutic application of anti-arthritis, pain-releasing, and anti-cancer effects of bee venom and its constituent compounds[J]. Pharmacology and Therapeutics, 2007, 115(2): 246-270.
[13] 李迎涛, 姜宝华, 闫路娜, 等. 蜂毒肽抗肿瘤机制及临床应用进展[J]. 教育教学论坛, 2014(29): 140-142.
[14] 靳弟, 李俊, 吴宝明, 等. 蜂毒素的体内外抗肿瘤研究[J]. 安徽医科大学学报, 2009, 44(5): 590-593.
[15] MUFSON R A, LASKIN J D, FISHER P B, et al. Melittin shares certain cellular effects with phorbol ester tumor promoters[J]. Nature, 1979, 280(5717): 72-74.
[16] SHARMA S V. Melittin-induced hyperactivation of phospholipase A2 activity and calcium influx in ras-transformed cells[J]. Oncogene, 1993, 8(4): 939-947.
[17] 陈琪, 刘欣, 姜小凡, 等. 蜂毒肽药理作用的研究进展[J]. 吉林医药学院学报, 2018, 39(1): 65-68.
[18] 舒英. TNF-α/NF-κB信号通路在蜂毒肽致肾小管上皮细胞凋亡中的作用机制探讨[A]//中国中西医结合学会肾脏疾病专业委员会. 中国中西医结合学会肾脏疾病专业委员会2018年学术年会论文摘要汇编[C]. 重庆,出版者不详, 2018: 790.
[19] TU W C, WU C C, HSIEH H L, et al. Honeybee venom induces calcium-dependent but caspase-independent apoptotic cell death in human melanoma A2058 cells[J]. Toxicon, 2008, 52(2): 318-329.
[20] MOON D O, PARK S Y, CHOI Y H, et al. Melittin induces Bcl-2 and caspase-3-dependent apoptosis through downregulation of Akt phosphorylation in human leukemic U937 cells[J]. Toxicon, 2008, 51(1): 112-120.
[21] WANG X, XIE J, LU X, et al. Melittin inhibits tumor growth and decreases resistance to gemcitabine by downregulating cholesterol pathway gene CLU in pancreatic ductal adenocarcinoma[J]. Cancer Letters, 2017, 399: 1-9.
[22] WU X, ZHAO B, CHENG Y, et al. Melittin induces PTCH1 expression by down-regulating MeCP2 in human hepatocellular carcinoma SMMC-7721 cells[J]. Toxicology & Applied Pharmacology, 2015, 288(1): 74-83.
[23] AUSJO J, PAZ A M, ESTELLER M. MeCP2: the long trip from a chromatin protein to neurological disorders[J]. Trends in Molecular Medicine, 2014, 20(9): 487-498.
[24] 黄舒然, 王瑞平, 邹玺, 等. 蜂毒素对人胃癌细胞株BGC-823凋亡及其细胞周期的影响[J]. 西部中医药, 2012, 25(10): 15-17.
[25] MITRA S K, HANSON D A, SCHLAEPFER D D. Focal adhesion kinase: in command and control of cell motility[J]. Nat Rev Mol Cell Biol, 2005, 6(1): 56-68.
[26] HAUCK C R, SIEG D J, HSIA D A, et al. Inhibition of focal adhesion kinase expression or activity disrupts epidermal growth factor-stimulated signaling promoting the migration of invasive human carcinoma cells[J]. Cancer Research, 2001, 61(19): 7079-7090.
[27] JEONG Y J, CHOI Y, SHIN J M, et al. Melittin suppresses EGF-induced cell motility and invasion by inhibiting PI3K/Akt/mTOR signaling pathway in breast cancer cells[J]. Food and Chemical Toxicology, 2014, 68: 218-225.
[28] 秦刚, 李海东, 徐苏洋, 等. 蜂毒素对内皮祖细胞微血管形成能力及血管内皮生长因子受体2磷酸化作用的影响[J]. 肿瘤防治研究, 2014, 41(4): 289-293.
[29] HARRINGTON K J, SPITZWEG C, BATEMAN A R, et al. Gene therapy for prostate cancer: current status and future prospects[J]. The Journal of Urology, 2001, 166(4): 1220-1233.
[30] LI L, WEI Y, GONG C. Polymeric nanocarriers for non-viral gene delivery[J]. Journal of Biomedical Nanotechnology, 2015, 11(5): 739.
[31] 邵光灿. 蜂毒肽与基因变构IL-2融合蛋白在肿瘤细胞中的表达及生物学活性研究[D]. 青岛: 青岛大学, 2015: 2-3.
[32] TAROKH Z, NADERI-MANESH H, NAZARI M. Towards prostate cancer gene therapy: Development of a chlorotoxin-targeted nanovector for toxic (melittin) gene delivery[J]. European Journal of Pharmaceutical Sciences, 2017, 99: 209-218.
[33] 李绍祥, 凌昌全, 刘新垣. 携蜂毒素基因腺病毒感染对HepG2细胞CD54表达的影响[J]. 第一军医大学学报, 2003, 23(4): 300-305.
[34] 黄川. 可系统性给药的蜂毒肽脂质纳米颗粒及其抗黑色素瘤作用研究[D]. 武汉: 华中科技大学, 2015: 4-6.
[35] SOMAN N R, BALDWIN S L, HU G, et al. Molecularly targeted nanocarriers deliver the cytolytic peptide melittin specifically to tumor cells in mice, reducing tumor growth[J]. Journal of Clinical Investigation, 2009, 119(9): 2830-2842.
[36] HUANG C, JIN H, QIAN Y, et al. Hybrid melittin cytolytic peptide-driven ultrasmall lipid nanoparticles block melanoma growth,[J]. ACS Nano, 2013, 7(7): 5791-5800.
[37] 崔啸晨. 蜂毒肽联合吉西他滨对人胰腺癌细胞Panc-1作用的研究[D]. 太原: 山西医科大学, 2016: 5-6.
[38] 方栋, 张蕾, 孙娟, 等. “药辅合一”茶多酚-蜂毒肽纳米复合物的制备及抗肿瘤研究[J]. 中草药, 2017, 48(16): 3300-3307.
[39] 费丹. 特异性抗体介导的蜂毒肽对骨肉瘤的抑制作用[D]. 吉林: 吉林大学, 2014: 6-7.
[40] 杨光勇, 刘茜明, 刘莉莉, 等. 抗IL-4R单链抗体与蜂毒肽融合蛋白的构建、表达与纯化[J]. 华中科技大学学报: 医学版, 2018, 47(2): 193-197.
The main peptide component of bee venom‒the application of melittin in cancer therapy
ZHANG Hongyan, LIU Rui, WANG Xiaowei, WANG Dongkai*
(,,110016,)
Melittin is an amphiphilic polypeptide with spiral structure, which has anti-inflammatory, antiviral, antibacterial and hypotensive effects. In recent years, melittin has unique advantages in the treatment of tumors. This review summarizes the anticancer mechanism of melittin and its application in the field of pharmacy.Based on 40 literatures at home and abroad, the structure of melittin, the mechanism of anti-tumor application and the means to avoid the hemolytic problem, non-specific effect and easy metabolic degradation of melittin were reviewed.andMelittin has been proved to be effective in preclinical studies of many kinds of cancer. The targeting and specificity of melittin can be increased by antibody binding, gene transfection, nanotechnology or synergistic administration with chemotherapeutic drugs to solve the problems involved in tumor treatment.
pharmaceutics; cancer treatment; review; melittin; anticancer mechanism; targeted administration; main peptide compound
2019-02-27
张红艳(1997-), 女(汉族), 安徽六安人, 硕士研究生, E-mail dongsh1109@foxmail.com;
王东凯(1962-), 男(汉族), 辽宁沈阳人, 教授, 博士, 博士生导师, 主要从事药物制剂新剂型及缓控释制剂研究, Tel. 024-43520529, E-mail wangdksy@126.com。
R94
A
(2019)05–0216–09
10.14146/j.cnki.cjp.2019.05.008
(本篇责任编辑:赵桂芝)

