白藜芦醇纳米结晶的制备及体外抗氧化性的研究
张春娟,丁彦戈,杨 阳,姜同英
白藜芦醇纳米结晶的制备及体外抗氧化性的研究
张春娟,丁彦戈,杨 阳,姜同英*
(沈阳药科大学 药学院,辽宁 沈阳 110016)
探究白藜芦醇纳米结晶的制备及体外抗氧化性。采用单因素筛选考察影响白藜芦醇纳米结晶的各种处方和工艺,采用冷冻干燥法对其进行固化,采用DPPH法考察白藜芦醇纳米结晶的体外抗氧化性。在单因素筛选中稳定剂和药物的浓度对纳米结晶的粒径影响较大,冷冻干燥后的样品再分散性能良好,在抗氧化性研究中,白藜芦醇纳米结晶在制备过程中保持了有效的抗氧化活性,并且这种活性不受配方组成的干扰。制备的白藜芦醇纳米结晶粒径小,分布均匀,体外抗氧化性好。
药剂学;纳米结晶;反溶剂沉淀法;冷冻干燥法;DPPH法;白藜芦醇;抗氧化活性
白藜芦醇(resveratrol,Res)为非黄酮类多酚化合物,又称为芪三酚,化学名称为 3,5,4'-三羟基二苯乙烯,具有抗肿瘤[1-2]、抗心脑血管疾病[3]、抗氧化[4-5]、抗阿尔兹海默症[6]、抗病毒[7]等生理活性。白藜芦醇难溶于水,口服吸收较差,具有明显的胃肠道首过消除,因而导致其生物利用度较低[8-9]。目前已有很多关于白藜芦醇制剂[10]的研究,如壳聚糖纳米粒[11]、脂质体[12]等,其在改善白藜芦醇口服生物利用度上均取得了一定的进展。纳米结晶制剂是近年来兴起的备受关注的新的药物递送系统,具有制备工艺简单、所用辅料少等优点。纳米结晶的制备方法分为“Top-down”和“Bottom-up”两种类型的方法[13-14],其中反溶剂沉淀法是制备纳米结晶的常用方法,属于“Bottom-up”制备方法中的一种,目前已有很多文献[15-16]采用此方法制备难溶性药物的纳米结晶。反溶剂沉淀法具有工艺简单、易操作等优点[17],因此本文中采用该方法制备白藜芦醇纳米结晶。在本文中设计了一种白藜芦醇纳米结晶的处方及制备方法,通过改进稳定剂的选择,优化处方设计,以期抑制白藜芦醇的肠道Ⅱ相代谢,促进白藜芦醇的溶出和体内吸收,提高药物的生物利用度。
1 仪器与材料
Nicomp 380(美国PSS粒径仪公司),UV-1801紫外-可见分光光度计(北京瑞利分析仪器公司),ZRS-8G智能溶出仪(天津天大天发科技有限公司),UV-759紫外-可见分光光度计(上海君翼仪器设备有限公司),ZHWY-103B恒温培养振荡器(上海智城分析仪器制造有限公司),SU8020扫描电镜(日本日立公司),JEM 1200EX透射电镜(日本电子株式会社)。
白藜芦醇(质量分数为99.7%)、DPPH(上海阿拉丁生化科技股份有限公司),Kolliphor RH 40 (美国 BASF 公司),PVP K30 (天津博迪化工有限公司),无水乙醇(天津富宇精细化工有限公司)。
2 方法与结果
2.1 白藜芦醇纳米结晶的制备
采用反溶剂沉淀法制备白藜芦醇纳米结晶。操作如下:首先,将稳定剂溶解于水中,并置于磁力搅拌器上搅拌,作为水相;然后将白藜芦醇溶于无水乙醇中,作为有机相,之后将有机相在持续搅拌下快速加入水相中,继续搅拌10~15 min,即得白藜芦醇纳米结晶。
2.2 单因素筛选
2.2.1 转速的考察
按“2.1”条方法制备白藜芦醇纳米结晶,固定RH40用量为30 mg, PVPK30用量为20 mg,白藜芦醇为10 mg,温度为15 ℃,乙醇用量为0.5 mL,分别设置转速为400、1 200、2 500 r∙min-1,用粒径仪测定其粒径和PDI,测定结果见图1。由图1可以发现,转速对粒径和PDI的影响较小。
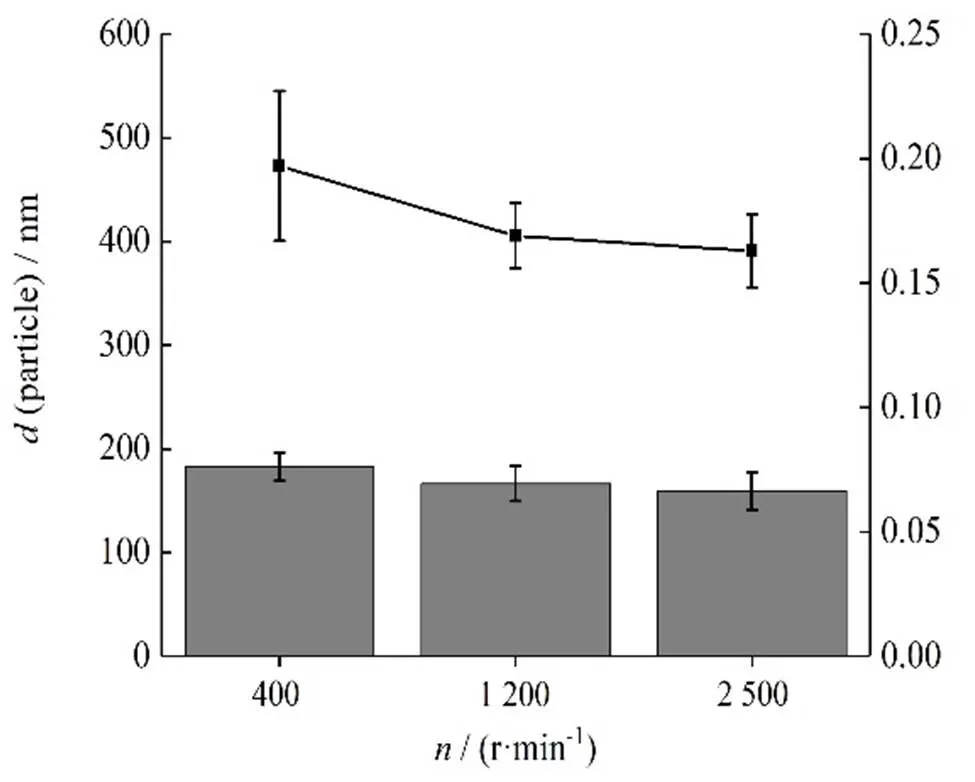
—Particle size; ■—PDI value
2.2.2 析晶温度的考察
将处方中的RH40、PVPK30和白藜芦醇用量分别固定为30、20和10 mg,转速为1 200 r∙min-1,乙醇用量为0.5 mL,按“2.1”条方法操作,分别在温度为4、15、25和40 ℃的条件下制备白藜芦醇纳米结晶,用尼康粒径仪测定其粒径和PDI,测定结果见图2。结果表明,在4 ℃条件下时,得到的纳米结晶粒径和PDI最小。

—Particle size; ■—PDI value
2.2.3 注入速度的考察
将处方中的RH40、PVPK30和白藜芦醇用量分别固定为30、20和10 mg,保持温度为15 ℃,转速为1 200 r∙min-1,乙醇用量为0.5 mL,考察注入速度分别为快速注入和滴加时对结果的影响,按“2.1”条方法制备白藜芦醇纳米结晶,测定其粒径和PDI,筛选出合适的注入方式,结果见表1。测定结果表明,快速注入时得到的纳米结晶粒径较小。

Table 1 Particle sizes and PDI values in different injection speeds
2.2.4 乙醇用量的考察
按“2.1”条方法制备白藜芦醇纳米结晶,固定RH40用量为30 mg, PVPK30用量为20 mg,白藜芦醇为10 mg,转速为1 200 r∙min-1,温度为15 ℃,将乙醇用量分别设置为0.5、2 mL,测定其粒径和PDI,结果见表2。从表2结果可以看出,乙醇的用量对粒径大小影响不显著,考虑到可能的有机溶剂残留问题,选择0.5 mL乙醇作为有机相的体积。

Table 2 Particle sizes and PDI values with different amounts of ethanol
2.2.5 RH40用量的考察
设置RH40用量分别为10、20、30、60和90 mg,称取PVPK30用量20 mg,白藜芦醇10 mg,固定转速为1 200 r∙min-1,温度为15 ℃,乙醇用量为0.5 mL,按“2.1”条方法制备白藜芦醇纳米结晶,测定其粒径和PDI,结果见图3。结果表明,当RH40用量为20~30 mg时,其粒径和PDI均较小。
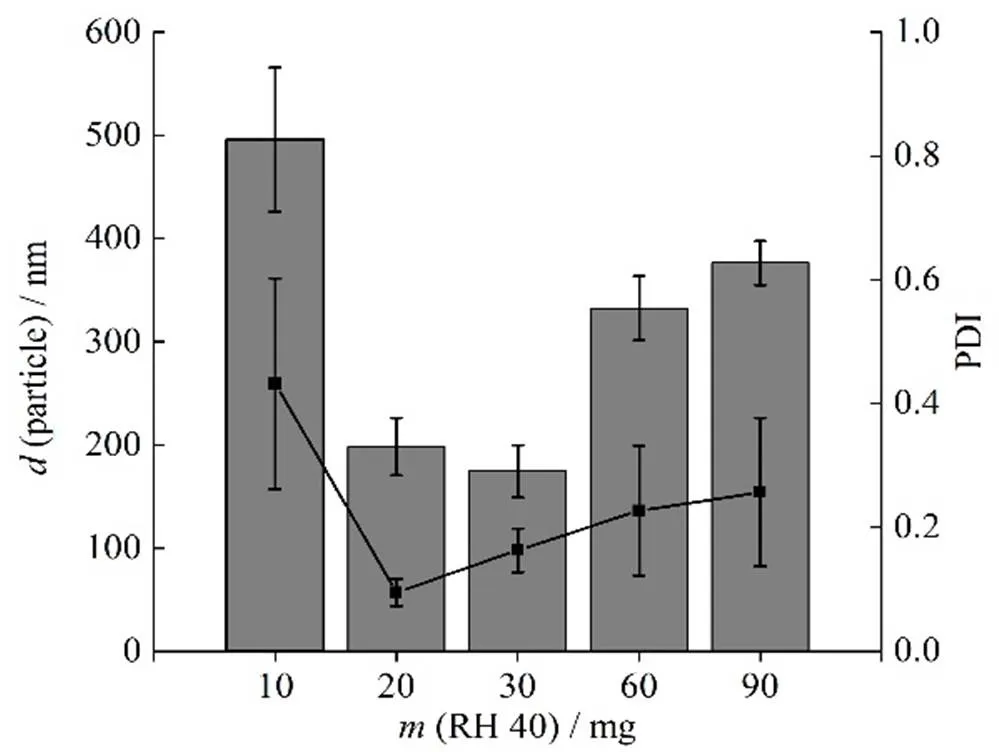
—Particle size; ■—PDI value
2.2.6 PVP K30用量的考察
设置PVPK30用量分别为10、20、30和40 mg,称取 RH40用量30 mg,白藜芦醇10 mg,固定转速为1 200 r∙min-1,温度为15 ℃,乙醇用量为0.5 mL,按“2.1”条方法分别制备白藜芦醇纳米结晶,并测定其粒径和PDI,结果见4。图4表明,当PVPK30用量为20 mg时得到的白藜芦醇纳米结晶样品的粒径和PDI最小,因此确定PVPK30用量为20 mg。
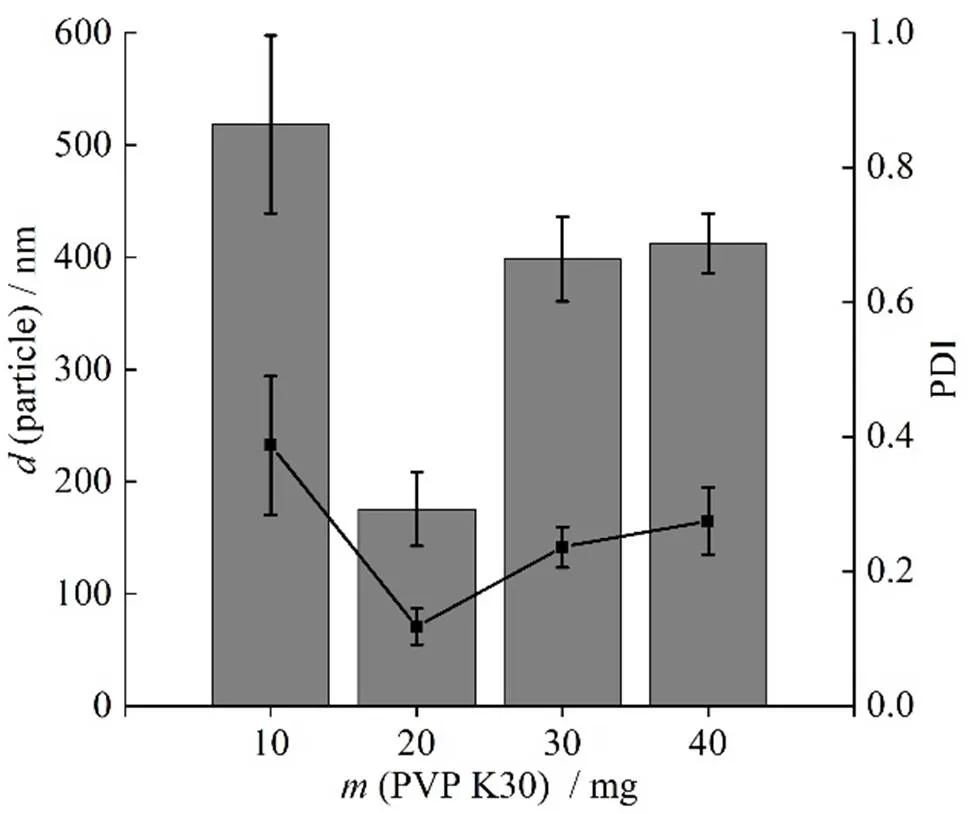
—Particle size; ■—PDI value
2.2.7 白藜芦醇用量的考察
设置白藜芦醇用量分别为5、10、20、30 mg,称取RH40为30 mg,PVPK30为20 mg, 设置转速为1 200 r∙min-1,温度为15 ℃,乙醇用量为0.5 mL,制备白藜芦醇纳米结晶,测定其粒径和PDI,结果见图5。结果表明,当白藜芦醇用量为10 mg时,其纳米结晶制剂的粒径和PDI最小。
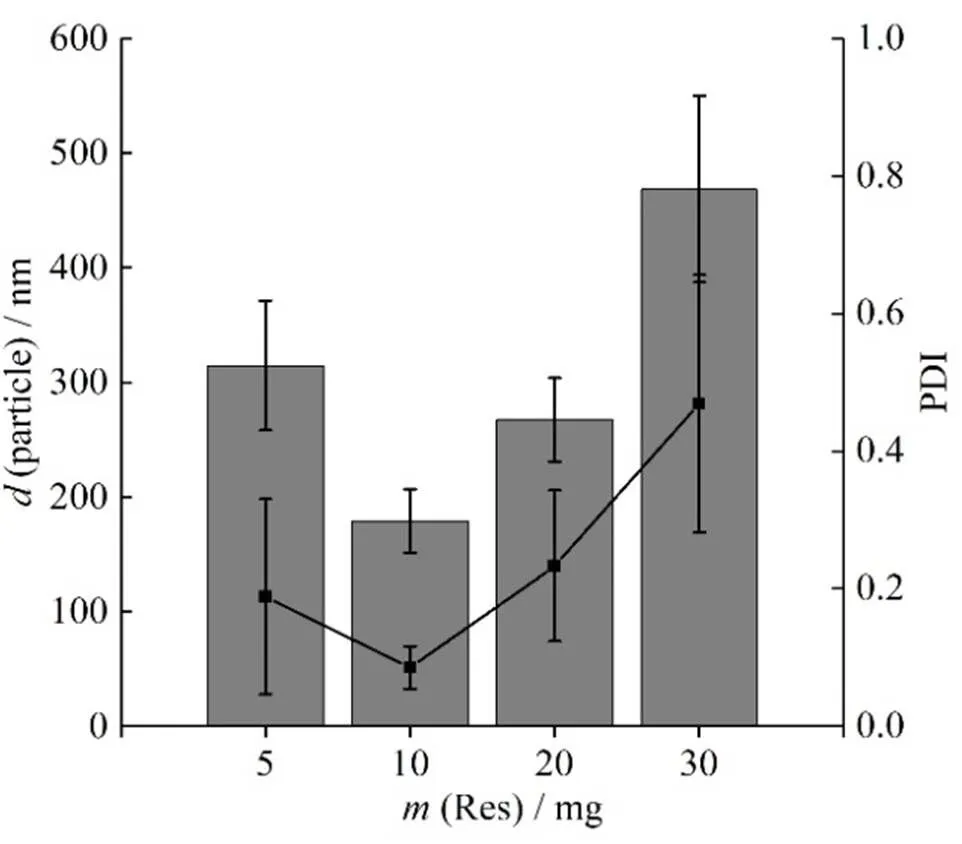
—Particle size; ■—PDI value
综合以上单因素筛选实验结果可以发现,析晶温度、注入速度以及聚氧乙烯氢化蓖麻油 RH40、PVP K30和白藜芦醇的用量对纳米结晶制剂的粒径和大小分布具有较明显的影响,析晶温度越低、注入速度越快得到的粒径越小且均匀,乙醇用量和搅拌速度对粒径的影响较小,而稳定剂和药物的浓度对结果的影响趋势则需要进一步的考察及优化。
2.3 粒径和外观形貌的测定
2.3.1 粒径的测定
根据单因素筛选结果,将处方用量定为:RH40为25 mg,PVPK30为20 mg,白藜芦醇为10 mg。按上述处方用量制备白藜芦醇纳米结晶,用纯化水将其稀释,置于粒径杯中,采用尼康粒径仪测定样品粒径,结果见图6。从图6中可以看出,制备的白藜芦醇纳米结晶制剂,粒径在(166.9 ± 57.75)nm左右,PDI为0.12 ± 2.3×10-3,说明纳米结晶粒子分布较为均匀,且在尼康强度径分布图中可以看出样品中没有大粒子存在。
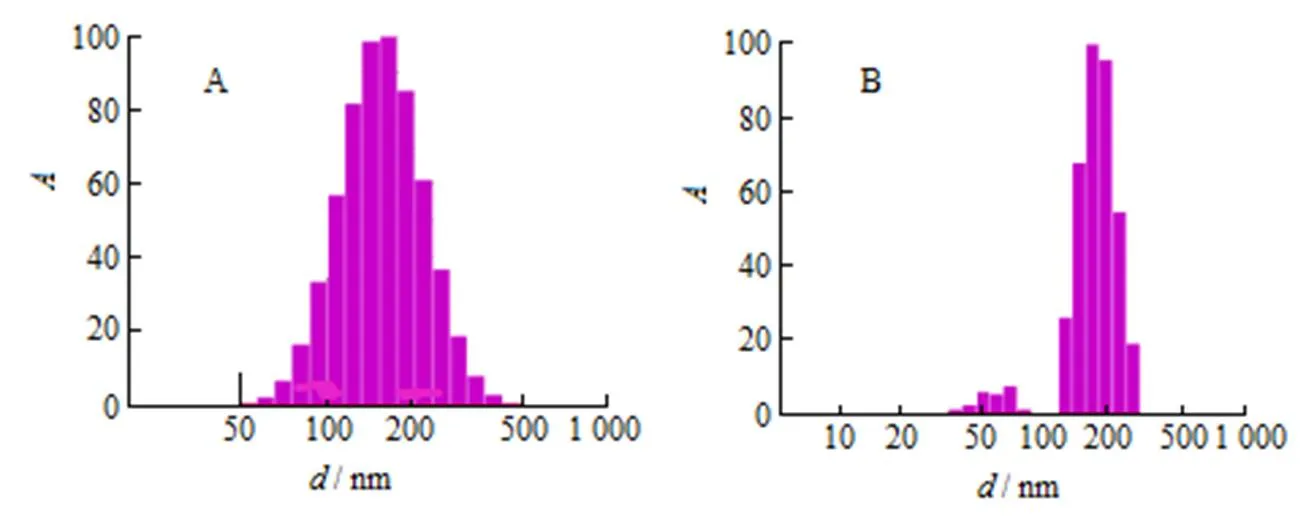
A—Gaussian distribution; B—Nicomp distribution
2.3.2 白藜芦醇纳米结晶外观形貌的观察
将制备好的白藜芦醇纳米结晶滴在表面覆有支持膜的铜网上,使药物粒子在筛网上吸附30 s后将药物溶液用滤纸吸干,空气中干燥过夜。将制备好的样品置于透射电镜下,观察药物粒子的形态及大小。结果见图7。由图7可见,白藜芦醇纳米结晶外观呈类球型,粒径在100 nm左右,与尼康粒度仪测定结果相比,粒径较小,猜测可能是透射电镜观察到的结果是干燥之后的粒径,可能由于粒子皱缩,导致得到的结果相对较小,文献报道中也有类似现象存在[18]。
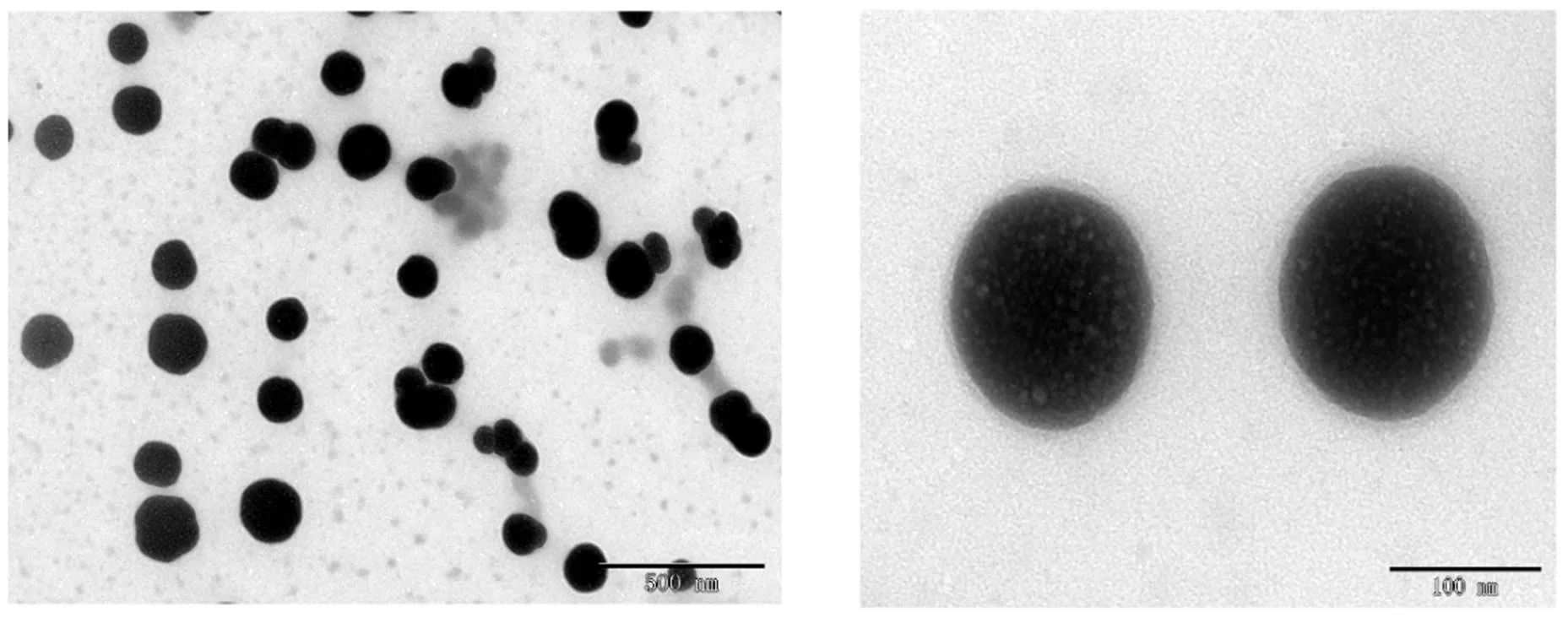
Fig. 7 TEMimages of resveratrol-nanocrystal
2.4 白藜芦醇纳米结晶的固化和再分化
采用冷冻干燥法对白藜芦醇纳米结晶进行固化。取制备好的适量的白藜芦醇纳米结晶,放于西林瓶中,加入冻干保护剂80 g∙L-1的甘露醇-海藻糖 (质量比3∶5),超声使冻干保护剂分散在样品中,后置于冷冻干燥机中,-80 ℃低温冰箱预冻24 h,冻干曲线设置程序为-40 ℃ 2 h,-20 ℃ 15 h,30 ℃ 3 h,共20 h, 即得白藜芦醇纳米结晶冻干粉。
白藜芦醇纳米结晶固化样品的再分散性能:取适量白藜芦醇纳米结晶冻干粉, 加入适量纯化水, 振摇使其复溶,测定其再分散粒径和PDI,结果见图8。
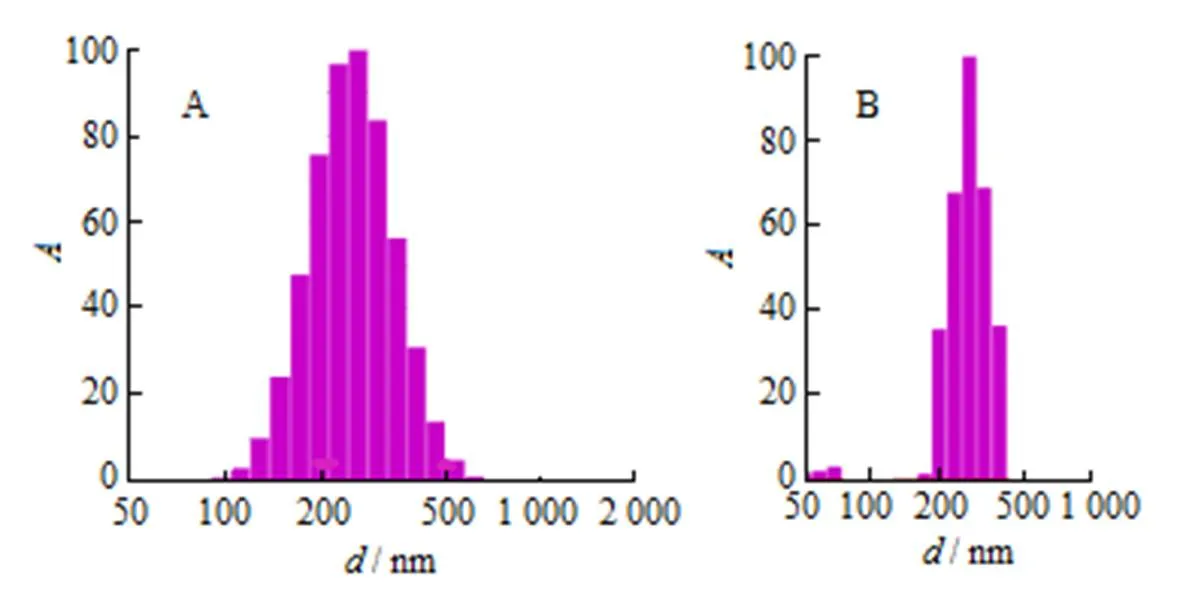
A—Gaussian distribution; B—Nicomp distribution
由图8看出,冷冻干燥后Res-NC冻干粉的平均粒径和PDI相比冻干前有增长,但冻干后粒径整体维持在约260 nm,PDI<0.2,提示白藜芦醇纳米结晶冻干粉的再分散性良好。
白藜芦醇原料药粉末的扫描电镜图和冻干粉加水复溶后样品的透射电镜图见9。图9表明,冻干粉复溶后的粒子外观呈类球形,分布较均匀,说明冻干粉再分散性良好。

Fig. 9 SEM images of resveratrol (Res) and TEM images of resveratrol-nanocrystal (Res-NC) after freeze drying
2.5 白藜芦醇体外溶出的测定
取适量冻干粉样品(相当于白藜芦醇5 mg),照《中华人共和国药典》2015版溶出度测定法,以250 mL水为溶出介质,转速为100 r∙min-1,经5、10、15、30、45、60 min时,取溶液5 mL(同时补加5 mL溶出介质),超微滤膜过滤,取续滤液作为供试溶液,采用紫外分光光度法,在波长306 nm处分别测定吸光度,计算溶出量,结果见图10。
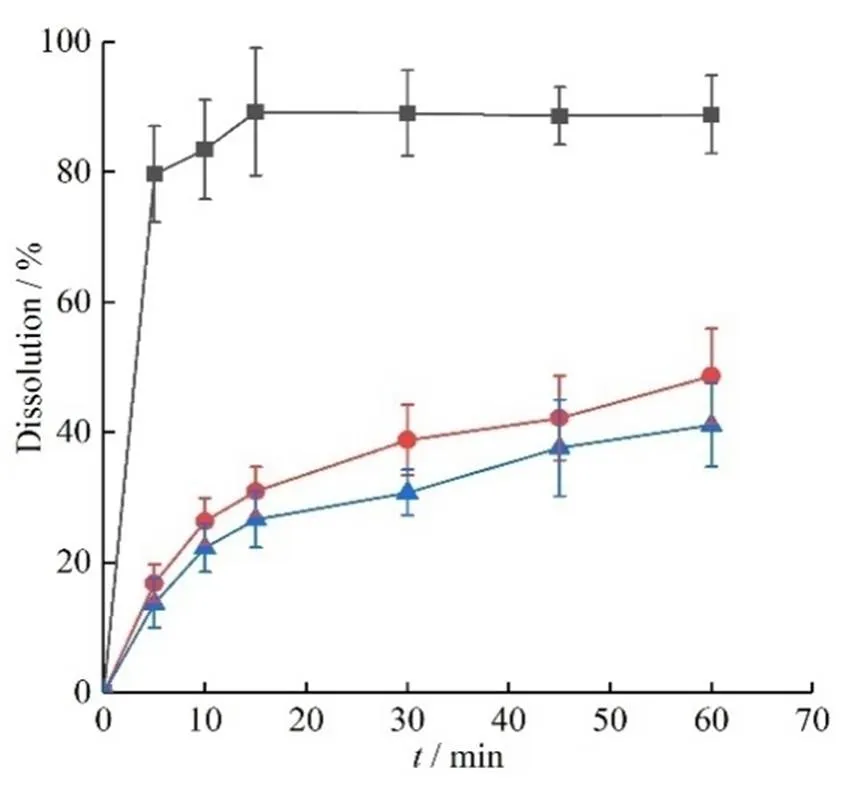
—Res-NC; —PM; —Res
由图10溶出曲线可以看出,在溶出介质中,白藜芦醇纳米结晶从5 min 开始就显示高于白藜芦醇原料药的溶出能力。在前15 min 白藜芦醇原料药和物理混合物的溶出量分别为(26.62 ± 4.31)%和(30.95 ± 3.74)%,而白藜芦醇纳米结晶的溶出量达到了(89.33 ± 9.77)%,高于原料药和物理混合物组,说明制备成为白藜芦醇纳米结晶有利于药物的溶出。
2.6 表观溶解度的测定
其表观溶解度的测定方法如下:分别称取过量的白藜芦醇原料药、纳米结晶冻干品和物理混合物,分别置于水中,涡旋混合,放入37 ℃恒温空气振荡浴中振摇72 h,使白藜芦醇在水中充分溶解达到平衡,取样5 mL,1.8×104r∙min-1离心15 min,其上清液用超微滤膜过滤,测定滤液中白藜芦醇的含量,白藜芦醇在水中表观溶解度如图11所示。
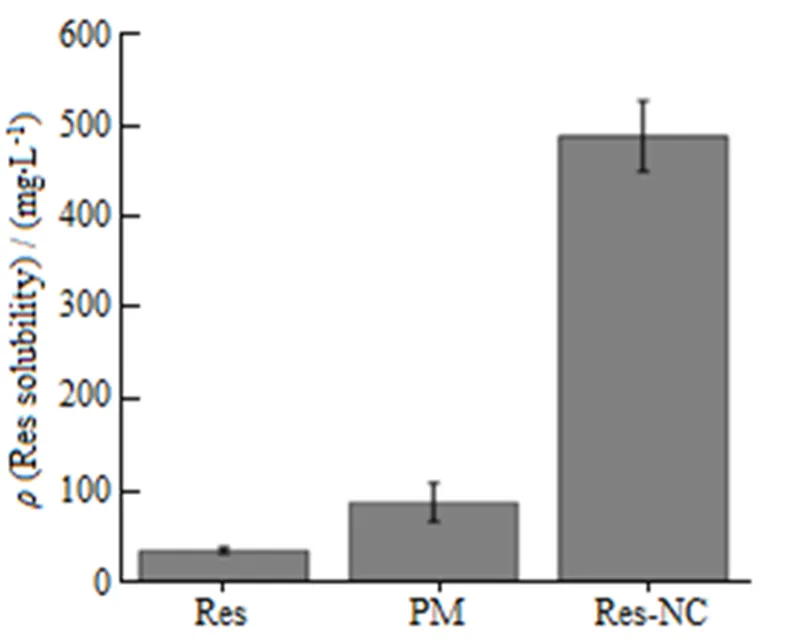
Fig. 11 Apparent solubility of Res, PM and Res-NC (n=3)
图11结果表明,白藜芦醇原料药在水中的表观溶解度为(35.3 ± 3.22)mg∙L-1,物理混合物中白藜芦醇的表观溶解度为(87.96 ± 21.32)mg∙L-1,而制备的Res-Nc样品的表观溶解度为(489.32 ± 38.77)mg∙L-1,相比其原料药提高了13.862倍,说明制成纳米结晶后有利于提高白藜芦醇在水中的表观溶解度。
2.7 DPPH自由基清除实验
白藜芦醇的实际生理活性被认为是其能够发挥其抗氧化作用。因此,必须确认白藜芦醇在纳米结晶给药系统中的配方组分不会干扰其固有性质。
2.7.1 DPPH自由基清除实验测试方法
DPPH测试液的配制:取DPPH 11.43 mg,置于100 mL的量瓶中,加无水乙醇,超声5 min,使其充分溶解,后用无水乙醇定容,溶液呈深紫色,必须充分振摇,使上下各部分颜色保持一致,避光条件保存,现用现配。
样品溶液配制:取适量待测样品,置于10 mL棕色量瓶中,无水乙醇稀释定容,之后用移液管准确移取一定量的母液于量瓶中,继续用无水乙醇定容稀释为不同系列浓度的待测样品,备用。
实验值0的测量:取DPPH无水乙醇溶液3 mL加入到5 mL EP管中,加无水乙醇1 mL,充分混合,于517 nm处测值,此值为0。
值的测量:取DPPH无水乙醇溶液3 mL加入到5 mL EP管中,加待测样品μL, 再加入无水乙醇(1 000-)μL,充分混合,避光室温静置30 min后,于517 nm处测样品的值,加样表见表3。

Table 3 Sampling table
2.7.2 稳定性检测
将配制好的白藜芦醇无水乙醇溶液和Res-NC的无水乙醇溶液,放于室温不避光条件下,分别于1、2、3 d进行上述试验,记录实验结果,观察在放置中其待测样品对DPPH自由基清除能力是否有区别和变化。抗氧化能力计算方法如下:Inhibition = (0-)/0×100%。
2.7.3 实验结果
白藜芦醇无水乙醇溶液和纳米结晶制剂的低、中、高3种质量浓度的样品对DPPH自由基的抑制率结果见图12和表4。
如图12和表4所示,DPPH自由基清除试验的结果表明,随着待测样品中白藜芦醇质量浓度增加,其对DPPH自由基的清除能力增加,这说明DPPH自由基的清除能力与白藜芦醇的质量浓度成正相关,因为更高浓度的白藜芦醇可以提供更多的氢原子与DPPH自由基结合。而相同浓度的白藜芦醇纳米结晶的样品和白藜芦醇的乙醇溶液样品相对比,其对DPPH自由基的清除能力无明显差异,这说明白藜芦醇在样品的制备过程中保持了有效的抗氧化活性,并且这种活性不受组分的干扰。
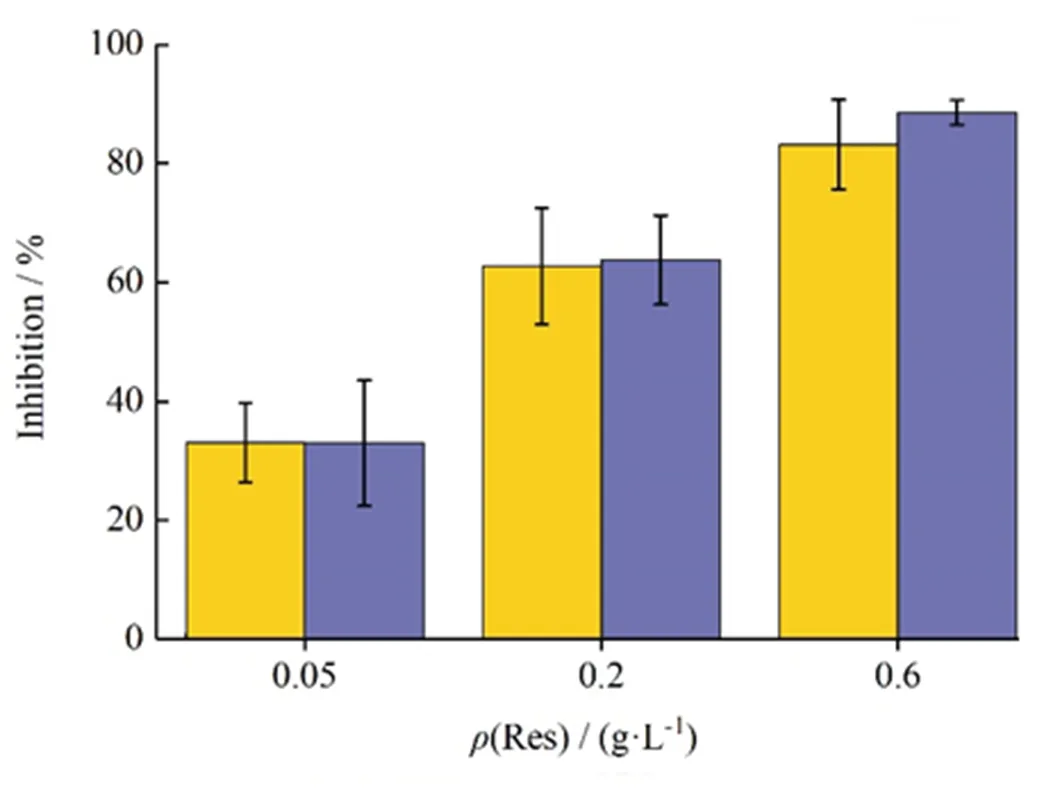
—Res; —Res-NC
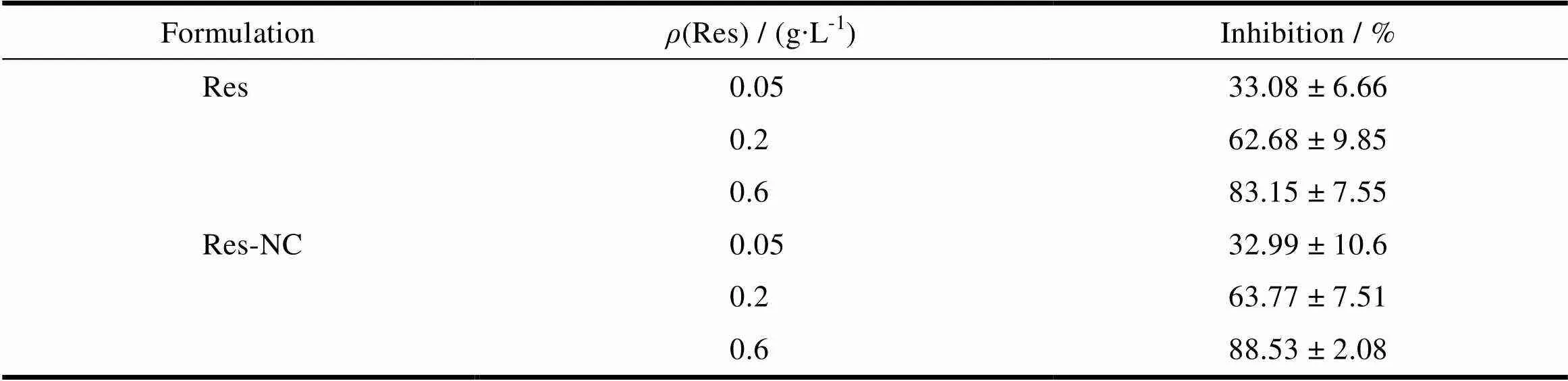
Table 4 The effects of Res, Res-NS on inhibition DPPH free radical
白藜芦醇无水乙醇溶液和纳米结晶制剂分别放置1、2、3 d,在不同时间测得的抑制率的结果见图13。
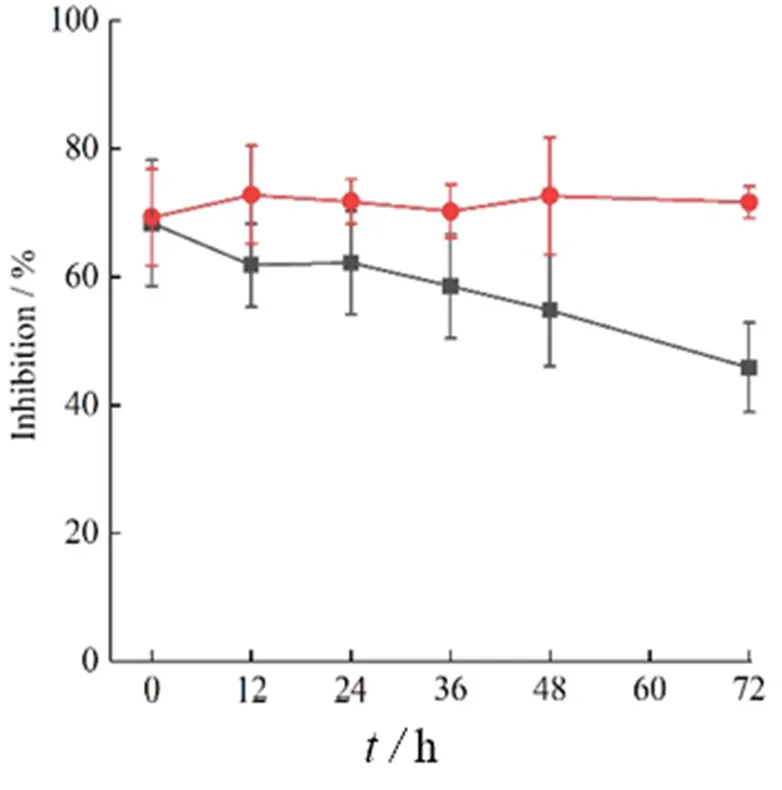
■—Res; —Res-NC
如图13所示,在相同浓度的待测样品放置不同时间后,Res-NC制剂组对DPPH自由基的清除能力仍然存在,与最初比较变化较小,而白藜芦醇溶液组,在放置后,对自由基的清除能力明显减弱。此现象说明制备成为纳米结晶后,在贮存过程中白藜芦醇的化学稳定性得到了提高。
3 讨论
a. 本实验中,所制备的白藜芦醇纳米结晶的粒径分布在100~300 nm内,PDI均小于0.2,采用TEM观察到的白藜芦醇纳米结晶的外观形态为球形或类球形结构,分布较均匀。
b. 冷冻干燥是纳米结晶固化的常用方法。在冷冻干燥中,会出现很多影响导致粒子发生团聚的外力因素,因此选择合适的冻干保护剂就显得尤为重要。冻干保护剂是在冷冻干燥过程中发挥着骨架的支撑作用,使冻干后的产品不塌陷、不皱缩。本文中选择甘露醇和海藻糖联合使用作为冻干保护剂,保证冻干样品的成形性,并阻止粒子团聚,得到的冻干粉样品复溶后的透射电镜图显示,外观形貌为类球形,与冻干前一致,虽粒径增长约100 nm,但是总体维持在260 nm左右,且大小分布均匀,因此选择冷冻干燥作为白藜芦醇纳米结晶的固化方法。
c. 本研究中采用DPPH自由基清除法测定白藜芦醇的抗氧化能力。经常会在文献报道中看到使用DPPH自由基清除试验来检测样品的抗氧化性,其检测可以简单地应用紫外-可见分光光度计进行。在文献[19]中,对槲皮素可生物降解纳米粒的抗氧化活性检测也采用DPPH法。在文献[20]中,采用DPPH法检测白藜芦醇自组装囊泡的抗氧化活性,发现药物在囊泡中不会影响这种生物活性,仍具有抗氧化能力。在本文的DPPH抗氧化性试验结果中,可以发现将白藜芦醇制备为纳米结晶后,其抗氧化能力没有受到影响,同时其白藜芦醇在贮存过程中的化学稳定性也得到了提高。
[1] AZIZ M H, KUMAR R, AHMAD N. Cancer chemoprevention by resveratrol:andstudies and the underlying mechanisms[J]. International Journal of Oncology, 2003, 23(1): 17-28.
[2] JANG M, PEZZUTO J M. Cancer chemopreventive activity of resveratrol[J]. Ann N Y Acad Sci, 1999, 25(2/3): 65-77.
[3] BRADAMANTE S, BARENGHI L, VILLA A. Cardiovascular protective effects of resveratrol[J]. Cardiovascular Drug Reviews, 2004, 22(3): 169-188.
[4] BAUR J A, SINCLAIR D A. Therapeutic potential of resveratrol: theevidence[J]. Nature Reviews Drug Discovery, 2006, 5(6): 493-506.
[5] CAO Z, LI Y. Potent induction of cellular antioxidants and phase 2 enzymes by resveratrol in cardiomyocytes: protection against oxidative and electrophilic injury[J]. European Journal of Pharmacology, 2004, 489(1/2): 39-48.
[6] LI F, GONG Q, DONG H, et al. Resveratrol, a neuroprotective supplement for Alzheimer's disease[J]. Current Pharmaceutical Design, 2012, 18(1): 27-33.
[7] SINGH G, PAI R S. Recent advances of resveratrol in nanostructured based delivery systems and in the management of HIV/AIDS[J]. Journal of Controlled Release, 2014, 194: 178-188.
[8] AMRI A, CHAUMEIL J C, SFAR S, et al. Administration of resveratrol: What formulation solutions to bioavailability limitations[J]. Journal of Controlled Release, 2012, 158(2): 182-193.
[9] WALLE T. Bioavailability of resveratrol[J]. Annals of the New York Academy of Sciences, 2011, 1215(1): 9-15.
[10] 徐娇, 龚涛. 白藜芦醇制剂研究进展[J]. 海峡药学, 2017(1): 18-20.
[11] JEONG H , SAMDANI K J , YOO D H, et al. Resveratrol cross-linked chitosan loaded with phospholipid for controlled release and antioxidant activity[J]. International journal of biological macromolecules, 2016, 93(12): 757-766.
[12] JHAVERI A, DESHPANDE P, PATTNI B, et al. Transferrin-targeted, resveratrol-loaded liposomes for the treatment of glioblastoma[J]. Journal of Controlled Release, 2018, 277(5): 89-101.
[13] MAO S, LI L C, ZHANG X . Nanosuspensions of poorly water soluble drugs prepared by top-down technologies[J]. Current Pharmaceutical Design, 2014, 20(3): 388-407.
[14] GOKE K, LORENZ T, REPANAS A, et al. Novel strategies for the formulation and processing of poorly water-soluble drugs[J]. European Journal of Pharmaceutics and Biopharmaceutics, 2018, 126(5): 40-56.
[15] GE Z Q, DU X Y, HUANG X N, et al. Enhanced oral bioavailability of ursolic acid nanoparticles via antisolvent precipitation with TPGS1000 as a stabilizer[J]. Journal of Drug Delivery Science and Technology, 2015, 29(11): 210-217.
[16] YIXIAN Z, QIUYU F, BOYI N, et al. Comparative studies on amphotericin B nanosuspensions prepared by a high pressure homogenization method and an antisolvent precipitation method[J]. Colloids and Surfaces B: Biointerfaces, 2018, 172(9): 372-379.
[17] DU Juan, LI Xiaoguang, ZHAO Huanxin, et al. Nanosuspensions of poorly water soluble drugs prepared by bottom-up technologies[J]. International Journal of Pharmaceutics, 2015, 495(2): 738-749.
[18] HONG J, LIU Y, XIAO Y, et al. High drug payload curcumin nanosuspensions stabilized by mPEG-DSPE and SPC:andevaluation[J]. Drug Delivery, 2017, 24(1): 109-120.
[19] KUMARI A, YADAV S K , PAKADE Y B, et al. Development of biodegradable nanoparticles for delivery of quercetin[J]. Colloids and Surfaces B: Biointerfaces, 2010, 80(2): 184-192.
[20] CADDEO C, MANCONI M, FADDA A M, et al. Nanocarriers for antioxidant resveratrol: Formulation approach, vesicle self-assembly and stability evaluation[J]. Colloids and Surfaces B: Biointerfaces, 2013, 111(11): 327-332.
The preparation and antioxidantof resveratrol nanocrystal
ZHANG Chunjuan, DING Yange, YANG Yang, JIANG Tongying*
(,,110016,)
To investigate the preparation andantioxidant of resveratrol nanocrystal.Single factor screening was used to investigate the formulas and processes that affected resveratrol nanocrystal. Freeze-drying was used to solidify resveratrol nanocrystal. DPPH method was used to study the antioxidant activity of resveratrol nanocrystal.The concentrations of stabilizers and drugs had a great influence on the particle sizes of nanocrystals; The re-dispersibility of resveratrol nanocrystal after freeze drying was good. In the study of antioxidant activity, resveratrol nanocrystals maintained effective antioxidant activity in the preparation process, and this activity was not interfered by any formula.The obtained Res-NC hasa small particle size and good antioxidant activity.
pharmaceutics; nanocrystal; anti-precipitation; freeze drying; DPPH method; resveratrol; anti-oxidant
2019-04-18
张春娟(1993-), 女(汉族), 河南南阳人, 硕士研究生, E-mail 1073177027@qq.com;
姜同英(1976-), 女(汉族), 辽宁沈阳人, 副教授, 博士, 硕士生导师, 主要从事纳米药物给药系统的研究, Tel. 024-43520535, E-mail 18842659642@163.com。
R94
A
(2019)05–0157–12
10.14146/j.cnki.cjp.2019.05.002
(本篇责任编辑:赵桂芝)

