紫外线辐照花生油贮藏过程中的脂肪酸组成分析
林 丹,陈丽香,蒋杰海,冯志强,*
(1.广东省食品工业公共实验室,广东广州 511442; 2.广东省食品工业研究所有限公司,广东广州 511442;3.广东省食品质量监督检验站,广东广州 511442)
花生油是世界上五大食用油之一,以其独特的风味和较高的营养价值备受广大消费者青睐。脂肪酸是花生油的重要组成部分,花生油由大约80%不饱和脂肪酸和20%饱和脂肪酸混合组成,主要的脂肪酸有棕榈酸、油酸和亚油酸。油酸和亚油酸均可降低人体胆固醇,油酸能够选择性的降低低密度胆固醇,对人体心脑血管健康有利。同时,花生油含有的亚麻酸是构成人体组织细胞的主要成分,在体内能合成、代谢,转化为机体必需的生命活性因子DHA和EPA[1-3]。
花生及制品、食用油等产品属于容易被黄曲霉毒素B1污染,由于黄曲霉毒素对紫外线的敏感性,紫外辐照是去除花生油中黄曲霉毒素有效措施之一,其二次污染小、对降解体系影响小[4-10]。研究表明,紫外照射技术用于去除花生油中黄曲霉毒素不仅有效,而且对花生油品质无影响[10];花生油经紫外辐照处理后,过氧化值显著增加,部分脂肪酸组成有微小差异[11-12];经过紫外线辐照的花生油,其贮藏稳定性降低,货架期明显缩短[12]。目前,大部分研究只集中在对紫外辐照法去除花生油中黄曲霉毒素B1的工艺和品质进行研究[13-16],对辐照后贮藏过程中花生油的脂肪酸组成变化的研究存在空白。
脂肪酸组成与花生油的品质和贮藏性能密切相关[3],针对已有研究的不足,对花生油贮藏过程中脂肪酸组成变化进行分析,探究影响紫外线辐照花生油贮藏性能的因素。本研究以紫外线辐照的花生油为研究对象,对贮藏过程中花生油的脂肪酸组成变化进行分析,通过主成分分析和相关性分析研究紫外线辐照花生油脂肪酸组成在贮藏过程中的相互关系,为提高紫外线辐照花生油的品质和贮藏性能提供参考。
1 材料与方法
1.1 材料与仪器
经过检测符合国家标准的花生油 由某花生油生产厂家提供;黄曲霉毒素B1含量超出国家标准限量值的花生油 自制;波长为254 nm的紫外灯 深圳永丰照明有限公司;盐酸(2∶1)溶液(盐酸-水)、石油醚-无水乙醚混合液(1+1)、正己烷、氢氧化钾甲醇溶液(0.5 mol/L)、三氟化硼甲醇溶液(14%) 均为分析纯;37种脂肪酸甲酯混标标准品25 mg ANPEL公司。
Agilent 7890B气相色谱色谱仪 美国安捷伦公司;MJ-150-Ⅱ霉菌培养箱 上海一恒科学仪器有限公司;SPX-800生化培养箱 宁波江南仪器厂。
1.2 实验方法
样品的预处理:把经过检测符合国家标准(黄曲霉毒素B1≤20 μg/kg[17])的花生油和黄曲霉毒素B1超出国家标准限量值的花生油混合,摇匀,作为该试验的对照组(对照组黄曲霉毒素B1含量为69.0 μg/kg);将对照组的花生油置于规格为9 cm的玻璃培养皿中,液体高度均为1 cm,在254 nm的紫外灯下辐照处理40 min[11],处理后的紫外组花生油符合国家标准对黄曲霉毒素B1的要求(紫外组的黄曲霉毒素B1含量为18.8 μg/kg),分装在100 mL的密封玻璃瓶中。
1.3 脂肪酸组成测定
1.3.1 样品的甲酯化 称取试样5 g至具塞50 mL比色管中,精确至0.1 mg。用移液管移取10 mL盐酸溶液溶解试样,涡旋混匀后置于74 ℃水浴锅中水浴加热3 h。放冷后加入1∶1(石油醚-无水乙醚)溶液20 mL,盖紧盖子摇匀,静置5 min后取上清液备用,重复2次(注意提取时候适当放气,防止盖子喷出)。第三次加入10 mL正己烷提取,摇匀静置后合并上清液待甲酯化备用[18]。
将合并后的上清液氮吹干(注意氮吹至近干时用正己烷洗壁再完全吹干),加入2 mL KOH甲醇溶液(2 mol/L),盖上塞后涡旋30 s,然后置于64 ℃水浴锅加热30 min(注意塞紧瓶塞),放冷到室温后加入1 mL 14%三氟化硼甲醇溶液,盖上塞后涡旋30 s,然后置于60 ℃水浴锅加热30 min(注意塞紧瓶塞),取出静置放冷到室温。准确移取10 mL正己烷定容。涡旋混匀后静置取上清液上机[18]。
1.3.2 气相色谱条件 色谱柱:DB-23(60 m×0.25 mm×0.15 μm);进样口温度:250 ℃;检测器温度:280 ℃;压力:206850 Pa(恒压控制);载气:氮气;进样方式:分流进样(25∶1);升温程序:初温50 ℃,保持1 min,以25 ℃/min升至150 ℃,保持4 min,以2 ℃/min升至180 ℃,保持4 min,以3 ℃/min 升至200 ℃,保持4 min,以1.5 ℃/min升至213 ℃,以15 ℃/min升至230 ℃,保持5 min;进样量:1.0 μL,空气流量:350 mL/min;氢气流量:40 mL/min,尾吹氮气流量:30 mL/min。
1.3.3 定性定量方法 采用保留时间进行定性,面积归一化法进行定量。试样中某个脂肪酸占总脂肪酸的百分比Yi按下式计算,通过测定相应峰面积对所有成分峰面积总和的百分数来计算给定组分i的含量:
式中:Yi-试样中某个脂肪酸占总脂肪酸的百分比,%;ASi-试样测定液中各脂肪酸甲酯的峰面积;FFAMEi-FAi-脂肪酸甲酯i转化成脂肪酸的系数;∑ASi-试样测定液中各脂肪酸甲酯的峰面积之和。
1.4 试验设计
1.4.1 紫外线辐照对花生油贮藏过程中脂肪酸组成的影响 分别分析加速氧化条件下(60 ℃)紫外组和对照组的脂肪酸变化,每隔7 d测定脂肪酸组成,研究紫外线辐照对花生油贮藏过程中脂肪酸组成的影响。
1.4.2 不同温度下紫外线辐照对花生油脂肪酸组成的影响 将紫外组和对照组花生油分别置于40、50和60 ℃的条件下加速氧化贮藏,每隔7 d测定脂肪酸组成,研究不同温度下花生油的脂肪酸变化情况。
1.4.3 紫外线辐照花生油贮藏过程中脂肪酸组成的主成分分析 采用SAS软件对加速氧化下(60 ℃)的紫外线辐照花生油脂肪酸组成进行主成分分析,研究影响紫外线辐照花生油脂肪酸组成变化的主要因素。
1.4.4 紫外线辐照花生油贮藏过程中脂肪酸的相关性分析 对60 ℃加速氧化下储存28 d(初级氧化阶段[12])的紫外线辐照花生油脂肪酸组成变化进行相关性分析,探究紫外辐照花生油中各脂肪酸之间的关联性。
1.5 数据处理
根据峰面积归一化法计算各脂肪酸的相对含量。应用SAS对所得数据进行主成分分析和相关性分析。
2 结果与分析
2.1 花生油中的脂肪酸组成进行分析测定
采用气相色谱法对花生油中的脂肪酸组成进行分析测定,37种脂肪酸甲酯标准溶液色谱图、紫外组花生油脂肪酸甲酯色谱图、对照组花生油脂肪酸甲酯色谱图如图1~图3所示。
图1 37种脂肪酸甲酯标准溶液色谱图
图2 紫外组花生油脂肪酸甲酯色谱图
图3 对照组花生油脂肪酸甲酯色谱图
从图中可以看出,在标准品和花生油样品中,各种脂肪酸甲酯的分离良好,紫外组和对照组花生油中共检出有10种主要脂肪酸,分别是棕榈酸(C16∶0)、十七烷酸(C17∶0)、硬脂酸(C18∶0)、油酸(C18∶1n9c)、亚油酸(C18∶2n6)、亚麻酸(C18∶3n3)、花生酸(C20∶0)、花生一烯酸(C20∶1)、山嵛酸(C22∶0)、木焦油酸(C24∶0)。
2.2 紫外线辐照对花生油贮藏过程中脂肪酸组成的影响
分别分析60 ℃下紫外组和对照组的脂肪酸变化,研究紫外线辐照对花生油贮藏过程中脂肪酸组成的影响,见图4和图5。
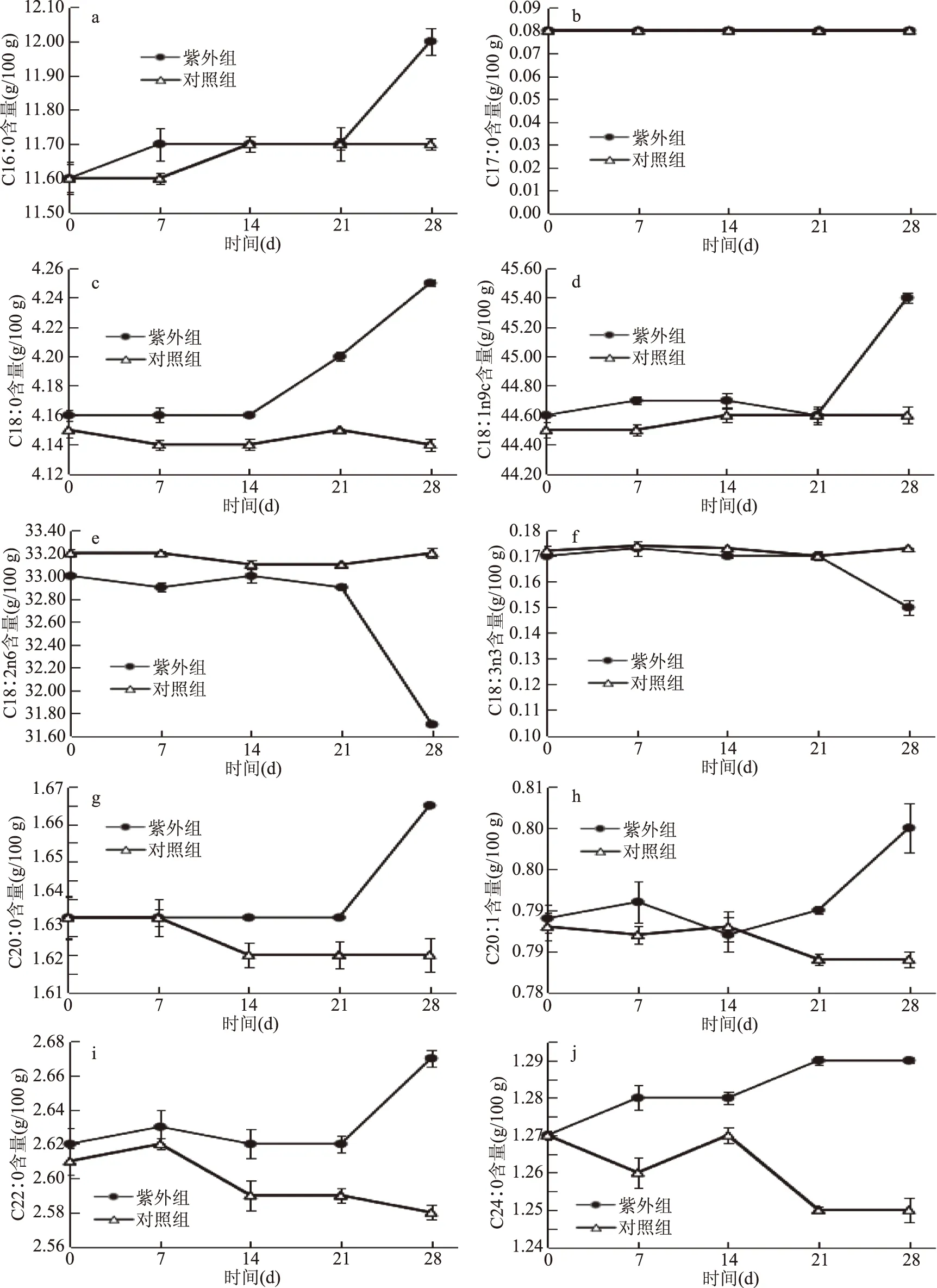
图4 紫外线辐照对花生油的贮藏过程中各种脂肪酸的影响
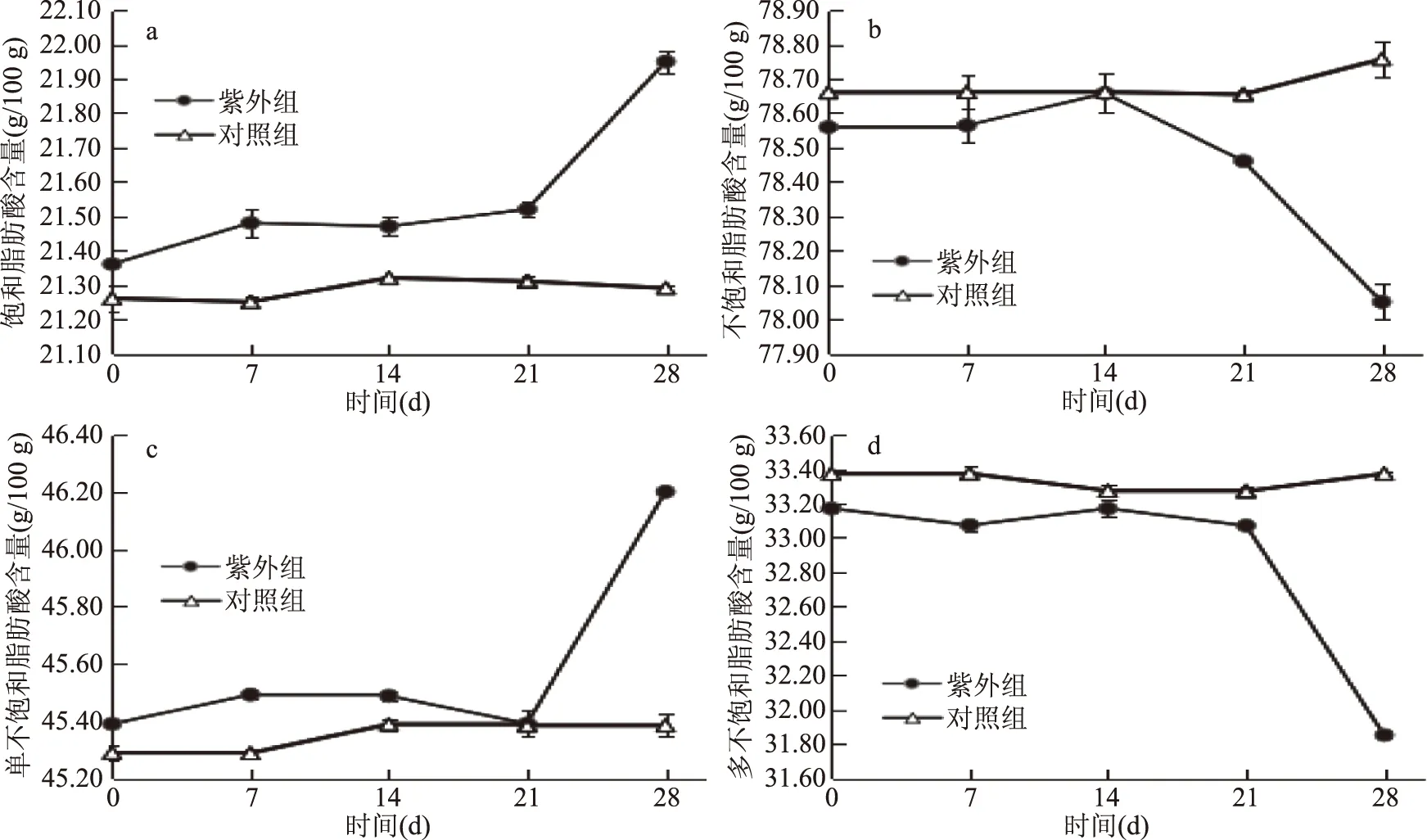
图5 紫外线辐照对花生油的贮藏过程中各类脂肪酸的影响
由图4可知,经紫外线辐照花生油各种脂肪酸在贮藏过程中变化幅度比对照组大,对照组花生油的各种脂肪酸在加速氧化贮藏过程中均变化不大。在加速氧化贮藏过程中,棕榈酸(C16∶0)、硬脂酸(C18∶0)、油酸(C18∶1n9c)、花生酸(C20∶0)、花生一烯酸(C20∶1)、山嵛酸(C22∶0)、木焦油酸(C24∶0)呈递增趋势,加速氧化贮藏后期递增幅度更大;亚油酸(C18∶2n6)和亚麻酸(C18∶3n3)前21 d含量均变化不大,贮藏第28 d,两种含量下降明显;十七烷酸(C17∶0)在加速氧化贮藏过程中含量不变。
分析紫外线辐照花生油和对照组中饱和脂肪酸、不饱和脂肪酸、单不饱和脂肪酸和多不饱和脂肪酸含量的变化,从图5可以看出,经紫外线辐照花生油饱和脂肪酸和单不饱和脂肪酸含量在贮藏后期呈递增趋势,不饱和脂肪酸和多不饱和脂肪酸在贮藏后期呈递减趋势;对照组花生油的各类脂肪酸在加速氧化贮藏过程中均变化不大。
脂肪酸的种类与含量都对油脂的氧化速率产生影响,含有不饱和双键的油脂更容易发生自动氧化反应,亚麻酸、亚油酸、油酸的相对氧化速率大约是20∶10∶1,饱和脂肪酸在正常情况下几乎不发生任何氧化。紫外组和对照组花生油的脂肪酸组成中,棕榈酸(C16∶0)、硬脂酸(C18∶0)、花生酸(C20∶0)、山嵛酸(C22∶0)、木焦油酸(C24∶0)为饱和脂肪酸,油酸(C18∶1n9c)、花生一烯酸(C20∶1)、亚油酸(C18∶2n6)和亚麻酸(C18∶3n3)为不饱和脂肪酸。其中油酸(C18∶1n9c)、花生一烯酸(C20∶1)属于单不饱和脂肪酸,亚油酸(C18∶2n6)和亚麻酸(C18∶3n3)属于多不饱和脂肪酸,分别含有两个和三个不饱和双键。在加速氧化贮藏过程中,可能经过紫外线辐照的花生油抗氧化能力降低,亚油酸(C18∶2n6)和亚麻酸(C18∶3n3)最先发生氧化反应,呈下降趋势[19-20]。
2.3 不同温度下紫外线辐照对花生油脂肪酸组成的影响
将紫外组花生油分别置于40、50和60 ℃的条件下加速氧化贮藏,每隔7 d测定脂肪酸组成,结果如图6和图7所示。
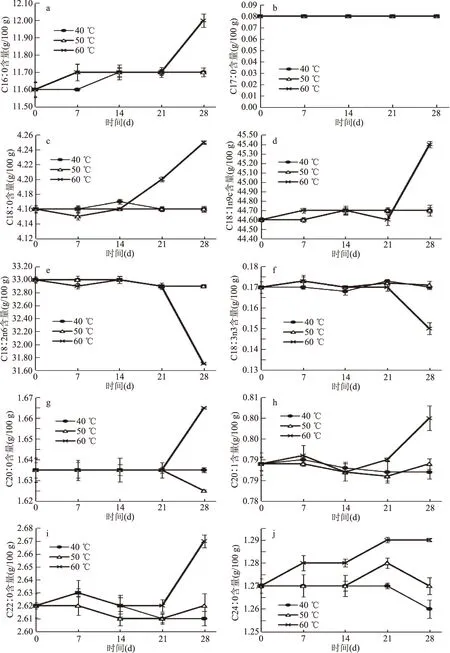
图6 不同温度对紫外线辐照花生油脂肪酸组成的影响
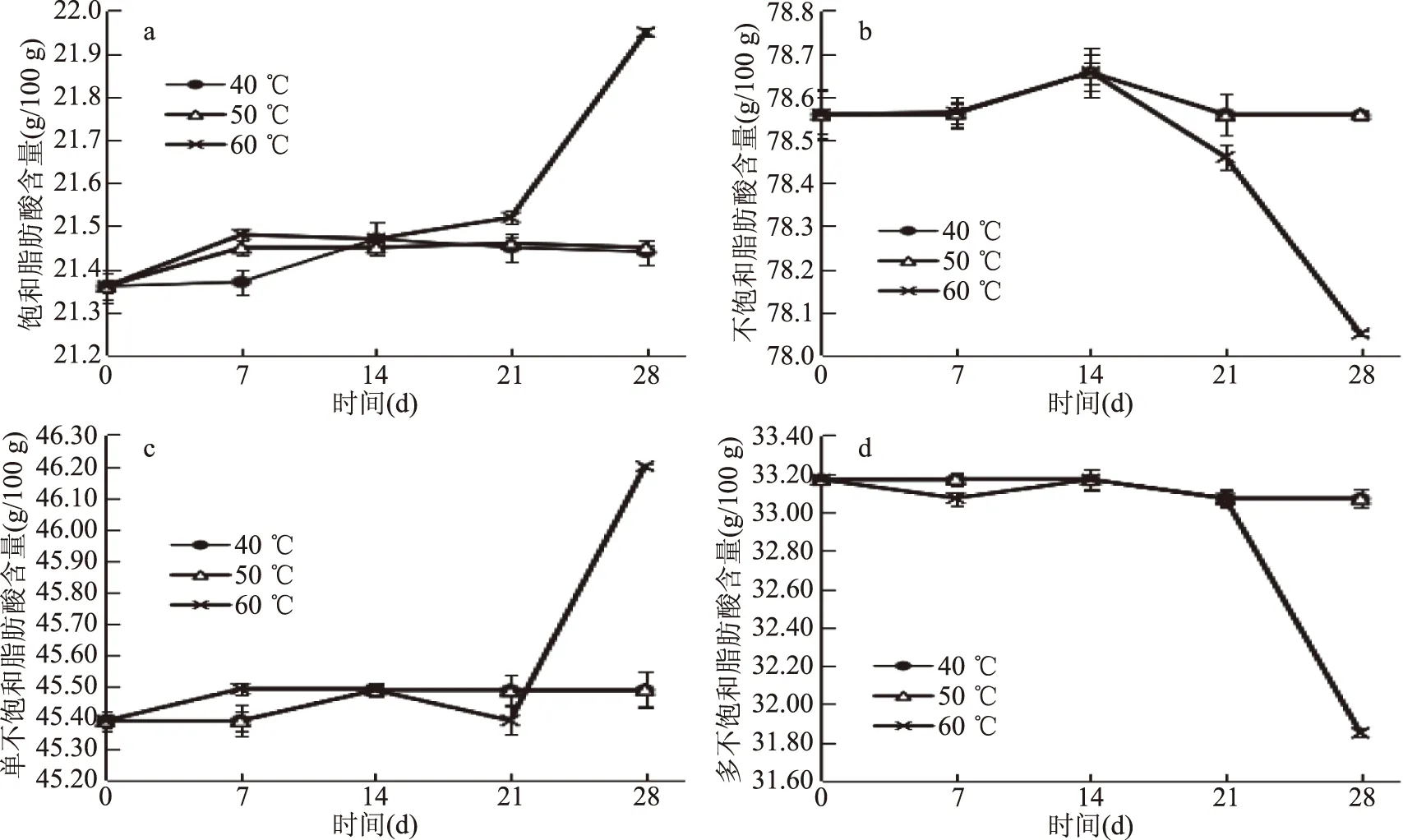
图7 不同温度对紫外线辐照花生油脂肪酸种类的影响
由图6可知,温度越高,经紫外线辐照花生油各种脂肪酸组成在贮藏过程中变化幅度越大,当贮藏温度为40 ℃和50 ℃时,各种脂肪酸在贮藏过程中的变化不大,当贮藏温度为60 ℃时,棕榈酸(C16∶0)、硬脂酸(C18∶0)、油酸(C18∶1n9c)、花生酸(C20∶0)、花生一烯酸(C20∶1)、山嵛酸(C22∶0)、木焦油酸(C24∶0)递增幅度明显;亚油酸(C18∶2n6)和亚麻酸(C18∶3n3)两种含量下降明显;十七烷酸(C17∶0)在不同温度下贮藏含量不变。说明较高的温度使紫外辐照花生油的饱和脂肪酸(棕榈酸(C16∶0)、硬脂酸(C18∶0)、花生酸(C20∶0)、山嵛酸(C22∶0)、木焦油酸(C24∶0))和单不饱和脂肪酸(油酸(C18∶1n9c)、花生一烯酸(C20∶1))递增,多不饱和脂肪酸(亚油酸(C18∶2n6)、亚麻酸(C18∶3n3))递减,较低温则影响不大。
分析不同温度下紫外线辐照花生油中饱和脂肪酸、不饱和脂肪酸、单不饱和脂肪酸和多不饱和脂肪酸含量的变化,从图7可以看出,当贮藏温度为40和50 ℃时,紫外线辐照花生油的各类脂肪酸在贮藏过程中均变化不大,当贮藏温度为60 ℃时,紫外线辐照花生油饱和脂肪酸和单不饱和脂肪酸含量在贮藏后期呈迅速递增趋势,多不饱和脂肪酸在贮藏后期呈迅速递减趋势。说明较高的温度使紫外辐照花生油的饱和脂肪酸总量和单不饱和脂肪酸总量递增,多不饱和脂肪酸总量递减,较低温度则影响不大。
2.4 紫外线辐照花生油贮藏过程中脂肪酸组成的主成分分析
主成分分析[21-23]是一种通过降维技术把多个变量化为少数几个主成分(即综合变量)的统计方法,利用模型“合成”为一个整体性的评价值,进而对样品总体进行评价,不但可将多指标问题转化为较少的综合指标,而且能给出较为客观的权重,为紫外线辐照花生油在贮藏过程中脂肪酸的变化提供科学而客观的评价方法。
采用SAS软件对60 ℃下加速氧化紫外线辐照花生油脂肪酸组成进行主成分分析(Principal Components),所得主要结果包括相关系数矩阵的特征值和特征向量,结果分别为表1和表2。

表1 特征值和方差贡献率
表1为相关系数矩阵的特征值,相关系数矩阵的特征值越大,它所对应的主成分变量包含的信息就越多。从表1可以看出,第1主成分的特征值最大,贡献率为90.12%,说明第一主成分包含了原来10个指标大部分的信息。前4个主成分提取了原来10个指标全部的信息。综合以上指标,对第1个主成分进行深入分析。
表2为主成分分析得到的特征向量,Y1~Y10分别为该主成分对应脂肪酸的特征向量,在第1主成分所对应的特征向量中,第1分量Y1(C16∶0)、第3分量Y3(C18∶0)、第4分量Y4(C18∶1n9c)、第5分量Y5(C18∶2n6)、第6分量Y6(C18∶3n3)、第7分量Y7(C20∶0)、第8主成分Y8(C20∶1)、第9分量Y9(C22∶0)的特征值比较相近,说明第1主成分以这几种脂肪酸的影响为主。其中,第5分量Y5(C18∶2n6)和第6分量Y6(C18∶3n3)的系数为负,第1分量Y1(C16∶0)、第3分量Y3(C18∶0)、第4分量Y4(C18∶1n9c)、第7分量Y7(C20∶0)、第8主成分Y8(C20∶1)、第9分量Y9(C22∶0)的系数为正,结合实际意义可以看出,亚油酸(C18∶2n6)和亚麻酸(C18∶3n3)为多不饱和脂肪酸,在花生油各种脂肪酸中氧化速率最大,容易最先被氧化;其它分量分别为单不饱和脂肪酸和饱和脂肪酸,相对不容易被氧化,且在贮藏过程中呈递增趋势,其内在具体的联系有待进一步的研究。
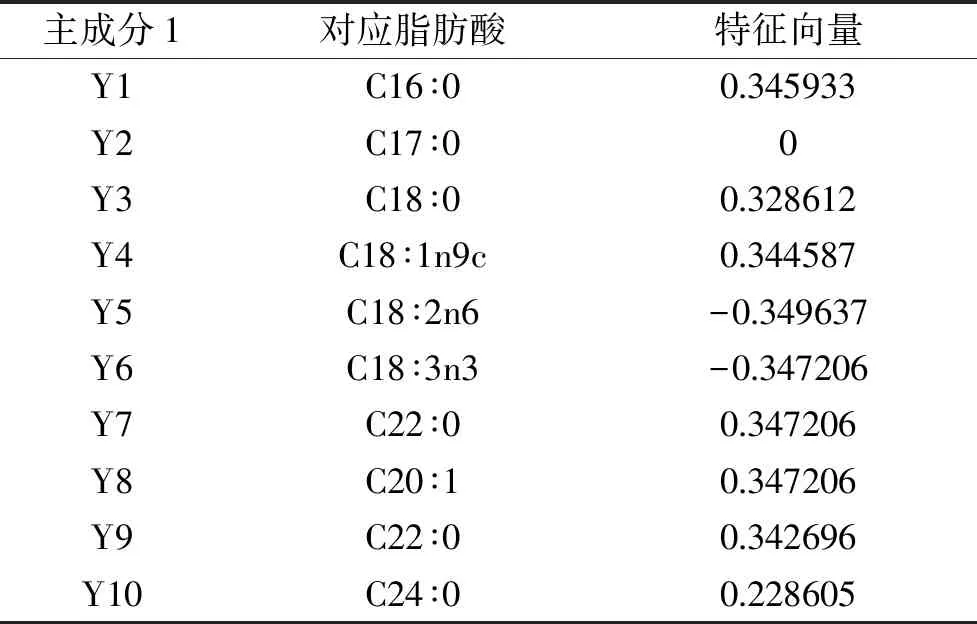
表2 各指标主成分特征向量
2.5 紫外线辐照花生油贮藏过程中脂肪酸的相关性分析
油脂在60 ℃条件下与在室温存储下具有相似的初级氧化产物、二级氧化产物及短链脂肪酸生成机制[24],根据化学反应动力学原理[26],可通过氧化动力学模型推测常温货架期的油脂品质变化情况。紫外线辐照花生油在60 ℃储存28 d时,过氧化值开始下降,二级氧化产物开始产生,60 ℃下贮藏前28 d属于油脂初级氧化阶段[12]。因此对其脂肪酸组成变化进行相关性分析,探究紫外辐照花生油贮藏过程中各脂肪酸之间的关联性。分析结果见表3和表4。

表3 紫外线辐照花生油贮藏过程中各种脂肪酸的相关性分析

表4 紫外线辐照花生油中各类脂肪酸含量间的相关性分析
由表3可知,棕榈酸(C16∶0)与油酸(C18∶1n9c)存在极显著正相关,与亚油酸(C18∶2n6)存在极显著负相关;油酸(C18∶1n9c)与亚油酸(C18∶2n6)、亚麻酸(C18∶3n3)存在极显著负相关,与花生酸(C20∶0)、山嵛酸(C22∶0)存在极显著正相关;亚油酸(C18∶2n6)与花生酸(C20∶0)、花生一烯酸(C20∶1)、山嵛酸(C22∶0)存在极显著负相关,与亚麻酸(C18∶3n3)存在极显著正相关;亚麻酸(C18∶3n3)与花生酸(C20∶0)存在极显著负相关;花生酸(C20∶0)、花生一烯酸(C20∶1)与山嵛酸(C22∶0)存在极显著正相关。
由表4可知,紫外线辐照花生油中多不饱和脂肪酸与单不饱和脂肪酸、饱和脂肪酸存在极显著或显著的负相关;单不饱和脂肪酸与饱和脂肪酸存在极显著的正相关。
结合相关性分析和主成分分析结果,推断紫外辐照花生油在脂质氧化诱导阶段和链传递阶段,多不饱和脂肪酸——亚油酸(C18∶2n6)和亚麻酸(C18∶3n3)最先被氧化[19-20]。由于花生油中富含多不饱和脂肪酸(PUFA)且氧化过程中多不饱和脂肪酸(PUFA)分解的比例高于饱和脂肪酸(SFA)和单不饱和脂肪酸(MUFA),因此,各种脂肪酸组成会发生不同程度的变化[25]。
3 结论
经紫外线辐照花生油在加速氧化贮藏过程中各种脂肪酸变化幅度比对照组大,对照组花生油的各种脂肪酸在加速氧化贮藏过程中均变化不大;当贮藏温度相对较低的时候,各种脂肪酸在贮藏过程中的变化不大。花生油适宜在常温下进行储藏保存;通过对加速氧化下紫外线辐照花生油贮藏过程中脂肪酸组成进行主成分分析和相关性分析,紫外线辐照花生油中亚油酸(C18∶2n6)、亚麻酸(C18∶3n3)与棕榈酸(C16∶0)、硬脂酸(C18∶0)、油酸(C18∶1n9c)、花生酸(C20∶0)、花生一烯酸(C20∶1)、山嵛酸(C22∶0)主要影响紫外组的脂肪酸组成,多不饱和脂肪酸与单不饱和脂肪酸、饱和脂肪酸存在极显著的负相关,单不饱和脂肪酸与饱和脂肪酸存在极显著的正相关。推断花生油中氧化过程中多不饱和脂肪酸(PUFA)分解的比例高于饱和脂肪酸(SFA)和单不饱和脂肪酸(MUFA),因此,各种脂肪酸组成会发生不同程度的变化。

