天然和热变性乳铁蛋白与姜黄素复合物的结构表征及结合机理研究
邓楚君,许琳霜,李 波,杨 伟
(河南科技学院食品学院,河南新乡 453003)
姜黄素(Cur)是从姜黄根茎中提取分离出的一种多酚类物质,具有抗菌和抗氧化等多种生物活性[1-4]。但其水溶性较差,生物利用率低,严重限制了其在食品体系中的应用。研究表明,利用食品传递体系能够有效提高Cur的水溶性和生物利用率,如纳米颗粒[5]和纳米乳液[6]等。
蛋白质能够作为壁材,用于包埋、传递食品功能因子[7]。乳铁蛋白(LF)是一种单链的球状糖蛋白。与其他蛋白质不同,LF具有多种生物活性功能,如抗菌、抗炎和免疫调节等[8-9]。
许多研究表明,球状蛋白可通过热变性形成纳米颗粒和微米颗粒[10-11]。Sneharani等[12]发现热变性β-乳球蛋白比天然β-乳球蛋白具有更高的运载Cur的能力。当LF在85 ℃条件下加热时,蛋白质构象发生改变,疏水性增加[13-14],因而可能有利于其与疏水性多酚(如Cur)形成复合物。Yamauchi等[15]研究表明,热变性LF能够形成纳米颗粒。然而,目前没有关于天然和热变性LF与Cur相互作用的研究报道。
本文采用多种光谱学方法研究了LF-Cur复合物的结构和相互作用机制。通过浊度法和动态光散射研究了复合物的颗粒特性,应用红外光谱和圆二色谱研究了LF-Cur复合物的结构特性,采用荧光光谱比较研究了Cur与天然和热变性LF的结合常数和结合位点数,以期为LF-Cur复合物在食品中的应用提供理论基础。
1 材料和方法
1.1 材料与仪器
LF(纯度>92%) 新西兰国际有限公司;Cur(纯度>98%) 美国Sigma公司;乙酸钠、冰乙酸 天津市德恩化学试剂有限公司;溴化钾 上海谱振生物科技有限公司;其他化学试剂均为分析纯。
HACH 2100N型浊度仪、DR390型可见光分光光度计 美国哈希公司;Zetasizer Nano-ZS90型纳米激光粒度仪 英国马尔文仪器有限公司;Spectrum Tensor27型傅立叶变换红外光谱仪 德国布鲁克科技有限公司;Pistar π-180型圆二色光谱 英国应用光物理公司;荧光分光光度计 美国安捷伦科技有限公司;THZ-82型水浴恒温振荡器 江苏金坛亿通电子有限公司;JA1003N型电子天平 上海菁海仪器有限公司。
1.2 实验方法
1.2.1 复合物的制备 在室温下,溶解一定量的LF于pH5.0、0.01 mol/L的醋酸缓冲液中,持续搅拌2 h,使LF在缓冲液中的最终浓度为4×10-4mol/L。同时,配制5.4×10-3mol/L的Cur无水乙醇溶液。
天然LF-Cur复合物制备:将天然LF(记为LF25 ℃)与不同浓度的Cur溶液等体积混合,使混合溶液中LF的终浓度为2×10-4mol/L,Cur的终浓度分别为0、1.4×10-5、2.7×10-5、5.4×10-5、8.1×10-5和1.08×10-4mol/L。
热变性LF-Cur复合物制备:将天然LF溶液装入直径1 cm的塑料管中,于90 ℃的恒温水浴中加热20 min。热处理后,将样品立即放入冰水中冷却以防止进一步变性。取热变性的LF(记为LF90 ℃)与不同浓度的Cur溶液等体积混合,使混合溶液中LF的终浓度和Cur的终浓度与天然LF-Cur复合物中保持一致。
其中,天然和热变性LF-Cur混合溶液中乙醇的最终浓度为2%(该乙醇浓度不会引起LF变性)。
1.2.2 浊度和粒径测定 取3 mL天然/热变性LF-Cur复合物溶液(Cur浓度分别为0、1.4×10-5、2.7×10-5、5.4×10-5、8.1×10-5和1.08×10-4mol/L)于试样瓶中,擦拭干净试样瓶外壁,放入浊度仪测定溶液的浊度数值并记录[16]。取1 mL Cur浓度分别为0、1.4×10-5、2.7×10-5、5.4×10-5、8.1×10-5和1.08×10-4mol/L的天然/热变性LF-Cur复合物溶液于玻璃皿中,采用纳米激光粒度仪分析复合物的粒径大小与粒径分布(PDI),扫描次数12次[17]。测定温度均为25 ℃,散射角165°。每个样品测定3次,结果以平均值表示。
1.2.3 ζ-电位测定 取1 mL Cur浓度分别为0、1.4×10-5、2.7×10-5、5.4×10-5、8.1×10-5和1.08×10-4mol/L的天然/热变性LF-Cur复合物溶液于电位皿中,采用纳米激光粒度仪测定复合物的ζ-电位。测定温度为25 ℃,扫描次数30次,每个样品测定3次,结果以平均值表示[18]。
1.2.4 圆二色光谱(CD)分析 取0.1 mL Cur浓度分别为5.4×10-5和1.08×10-4mol/L的天然/热变性LF-Cur复合物溶液于石英比色皿中,扫描波长为190~250 nm,响应时间2 s。使用在线圆二色光谱网站(http://dichroweb.cryst.bbk.ac.uk)[19]对数据进行分析。圆二色光谱图为三次测量结果的平均值。
1.2.5 傅立叶变换红外(FTIR)光谱分析 LF-Cur复合物(Cur的浓度为1.08×10-4mol/L)经过旋转蒸发除去乙醇,冷冻干燥后得到复合物粉末。分别取LF、Cur及LF-Cur复合物干燥粉末2 mg与200 mg溴化钾研细均匀后制成透明薄片,进行FTIR分析。测定波数为500~4000 cm-1,扫描次数为11次,分辨率为4 cm-1[20]。
1.2.6 荧光光谱分析 参考文献[21-22]方法,并做适当修改。取LF与不同浓度的Cur溶液等体积混合,使溶液中LF浓度为2×10-4mol/L,Cur浓度分别为2.71×10-6、5.43×10-6、8.14×10-6、1.086×10-5、1.629×10-5、2.172×10-5和2.715×10-5mol/L。在25 ℃静置2 h,然后进行荧光测定。激发波长设定为292 nm,激发和发射的狭缝宽度分别为5和10 nm[18]。荧光淬灭数据通过Stern-Volmer方程式(1)进行分析。
式(1)
式中:F0和F分别为不加Cur和添加Cur时的荧光强度;Kq为分子淬灭常数;τ0是没有淬灭剂时的荧光寿命;[Q]为Cur的浓度;Ksv为Stern-Volmer淬灭常数。结合常数Ka和结合位点数n通过双对数方程式(2)进行分析。
式(2)
式中:Ka为结合常数;n为结合位点数。
1.2.7 包埋率和运载率测定 参考文献[23]方法,并做适当修改。取10 mL Cur终浓度分别为0、1.4×10-5、2.7×10-5、5.4×10-5、8.1×10-5和1.08×10-4mol/L的天然/热变性LF-Cur复合物溶液于50 mL离心管中,在20000 r/min 条件下离心10 min。收集上清液,采用分光光度计在427 nm处测定Cur的吸光度;同时绘制标准曲线(y=6.31916x-0.44581,R2=0.9994)。所有测定均在25 ℃条件下进行。
包埋率(%)=上清液中Cur的量(mg)×100/总Cur的量(mg)
式(3)
1.3 数据处理
数据统计分析使用SPSS 16.0 for Windows软件(SPSS Inc.,Chicago,IL,USA)进行方差分析(ANOVA)和动力学回归分析,显著性水平为0.05,图表中小写字母不同表示在5%水平上差异显著(p<0.05)。多重比较采用LSD法。所有试验重复两次,所有分析检测试验重复三次,测定结果以平均值±标准差表示。
2 结果与分析
2.1 浊度和粒径分析
图1为LF-Cur复合物浊度随Cur浓度的变化曲线。由图 1可知,随着Cur浓度的增加,LF25 ℃-Cur复合物的浊度迅速增加;当Cur浓度为1.08×10-4mol/L时,浊度为(165±6.34)NTU。LF90 ℃-Cur复合物的浊度随Cur浓度的增加变化较小,由(0.75±0.12)NTU(Cur浓度为1.4×10-5mol/L)增加到(5.1±3.73)NTU(Cur浓度为1.08×10-4mol/L)。
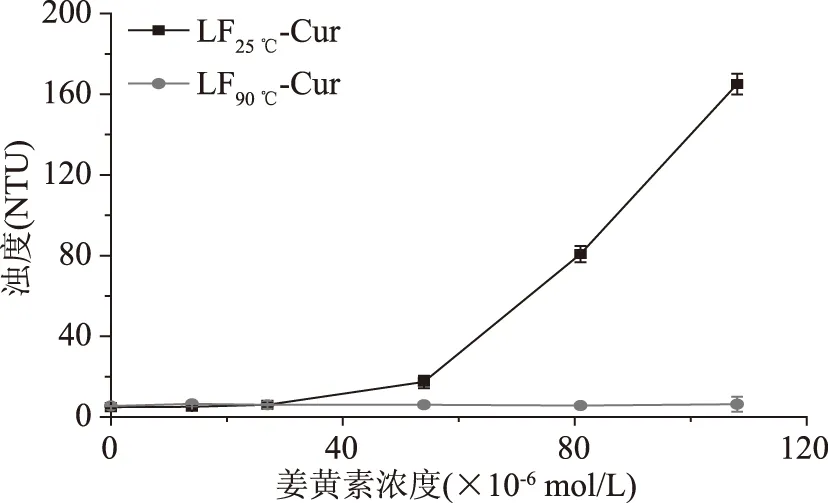
图1 LF-Cur复合物浊度随Cur浓度的变化曲线
图2为LF-Cur复合物粒径随Cur浓度的变化曲线。单独LF25 ℃和LF90 ℃的粒径分别为(12.65±0.48)和(29.96±0.61)nm。这是因为LF在90 ℃加热时发生聚集,从而导致热变性LF粒径的增加[24]。由图2可知,随Cur浓度的增加,LF-Cur复合物粒径增加:当Cur浓度为(1.4~2.7)×10-5mol/L时,粒径为13.32~15.18 nm;当Cur浓度进一步增加(从5.4×10-5mol/L增加到1.08×10-4mol/L),粒径由135.9 nm增加到334.9 nm,表明溶液中形成了更大的聚集体,这与浊度结果分析一致。研究表明,多酚能够与蛋白质结合形成复合物。当多酚含量较高时,结合在蛋白质表面的多酚能够通过桥联作用,使蛋白质-多酚复合物形成具有较大粒径的亚稳定状态的分散体[25-26]。Chen 等[27]研究表明,大豆分离蛋白-Cur复合物之间能够通过姜黄素的相互作用而结合,从而形成较大的颗粒。
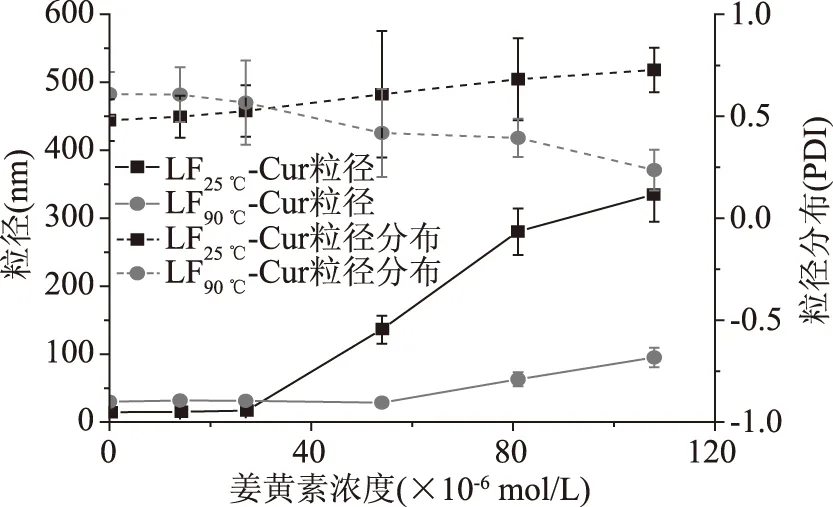
图2 LF-Cur复合物粒径随Cur浓度的变化曲线
由图2可知,相对于LF25 ℃-Cur复合物,LF90 ℃-Cur复合物的粒径变化较小。Cur浓度为1.4×10-5~1.08×10-4mol/L时,LF90 ℃-Cur复合物均为纳米颗粒(31.77~95.12 nm)。此外,随着Cur浓度的增加,LF90 ℃-Cur复合物粒径分布减小(PDI值从0.61降低到0.24),表明LF90 ℃-Cur复合物颗粒分布较为均一。
相比LF25 ℃-Cur复合物,LF90 ℃-Cur复合物的浊度和粒径变化较小。这可以归因于两个方面。一方面,LF90 ℃-Cur复合物的ζ-电位较大,复合物之间排斥力较强,不容易聚集,因此,浊度和粒径较小[28]。另一方面,由于热诱导的作用,LF变性,结构展开。在这一过程中,LF90 ℃可能会失去部分存在于表面的Cur结合位点,但同时暴露出位于LF90 ℃结构内部的结合位点。此时更多的Cur与这些结合位点结合。但由于空间位阻等作用,Cur不能够发挥“桥联”作用[29]。因此,LF90 ℃-Cur复合物主要是纳米颗粒,其浊度和粒径均较小。
2.2 ζ-电位分析
图3为Cur浓度对LF-Cur复合物ζ-电位的影响。单独LF25 ℃和LF90 ℃的ζ-电位分别为(7.72±0.35) mV和(8.20±0.19) mV。单独LF90 ℃的ζ-电位高于LF25 ℃,这与蛋白质90 ℃加热后,LF的两个叶片连续展开,最初位于LF疏水内部的更多阳离子基团暴露于溶液中,导致单独LF90 ℃ζ-电位的增加有关[30]。

图3 Cur浓度对LF-Cur复合物电位的影响
由图3可知,随着Cur浓度的增加,LF-Cur复合物的ζ-电位增加。这可能与Cur的添加导致LF结构的改变有关。该结果与Teng等[31]的相关研究结果一致。通常,溶液中颗粒带电荷越多,颗粒间聚集的可能性越小,溶液稳定性越高。LF90 ℃-Cur复合物的ζ-电位高于LF25 ℃-Cur复合物,这有利于提高复合物溶液的稳定性;同时,也解释了LF90 ℃-Cur复合物具有的较低浊度和粒径。
2.3 圆二色谱(CD)分析
如图4a1所示,在190~260 nm范围内,LF25 ℃的圆二色光谱有一个较宽的、位于208~210 nm中心的负峰和一个218~220 nm处的肩峰。与LF25 ℃相比,LF90 ℃的圆二色光谱图(形状和强度)发生了明显变化,表明加热使LF变性,蛋白质二级结构改变。当加入1.08×10-4mol/L Cur时,LF25 ℃和LF90 ℃的峰值减小,表明Cur能够诱导LF二级结构变化。
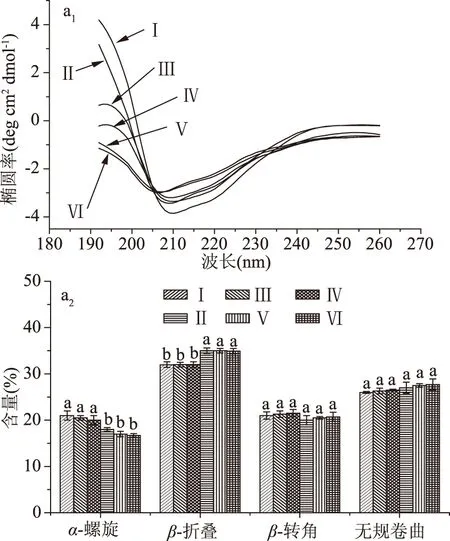
图4 LF和LF-Cur复合物远红外圆二光谱图(a1)和二级结构含量(a2)
通过DICHROWEB程序计算得到LF二级结构的含量[32]。通过SELCON3计算了α-螺旋、β-折叠、β-转角和无规卷曲的比例,如图4a2所示。LF25 ℃和LF90 ℃的二级结构中α-螺旋结构含量较低(LF25 ℃和LF90 ℃分别为21%和18%),β-折叠含量较高(LF25 ℃和LF90 ℃分别为32%和35%)。加热变性导致LF中的α-螺旋含量显著减小(p<0.05),β-折叠含量显著增加(p<0.05),而β-转角和无规卷曲差异不显著(p>0.05)。该结果表明,热变性能够稳定LF中的β-折叠结构;同时,使LF结构更为伸展。添加5.4×10-5和1.08×10-4mol/L Cur后,LF在LF25 ℃-Cur复合物和LF90 ℃-Cur复合物中的二级结构有不同程度的改变。其中,α-螺旋含量减少(p<0.05)。但β-折叠、β-转角和无规卷曲含量变化不显著(p>0.05)。也有研究表明:Cur不能引起β-乳球蛋白二级结构发生显著变化,这可能与Cur主要吸附在蛋白质表面有关[12]。
2.4 傅立叶变换红外(FTIR)光谱
图5为LF和LF-Cur复合物(Cur含量为1.08×10-4mol/L)的红外光谱。FTIR图谱显示LF25 ℃-Cur亚微米颗粒与LF90 ℃-Cur纳米颗粒之间存在一些明显的结构差异。
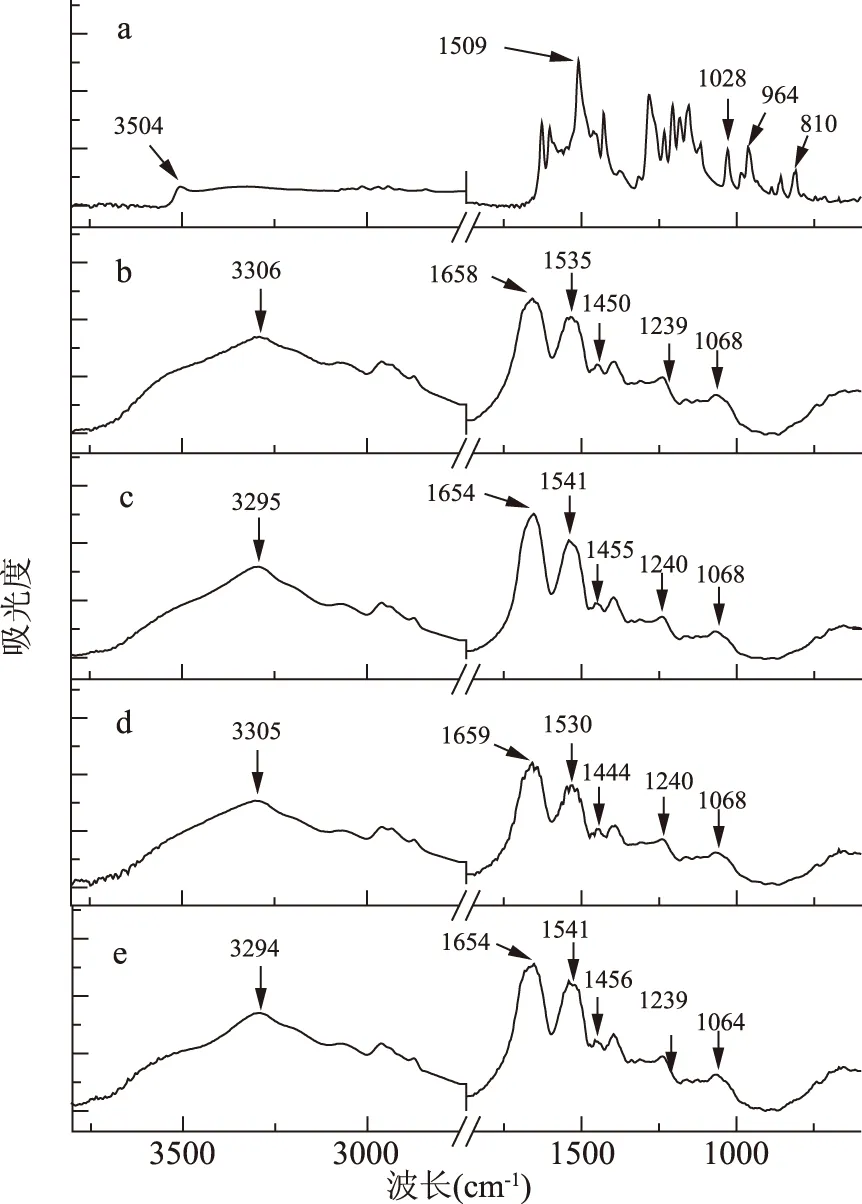
图5 傅里叶变换红外光谱
如图5a所示,Cur在3504 cm-1有一个特征峰,来自于-H键的伸缩振动;在1509和1028 cm-1处有两个特征峰,分别来自于酮基的伸缩振动和-NH的形变[33]。1605、1435和1285 cm-1的特征峰分别来自于苯环的伸缩振动、C-H弯曲振动和C-O伸缩振动[34]。在LF-Cur复合物的光谱中(图5d与图5e),Cur在3504、1509、1028、964和810 cm-1处的特征峰均消失,说明Cur与LF发生了结合。Liu等[35]在研究卵白蛋白与Cur复合物时也观察到类似的现象。如图5(b~e)所示,所有复合物在3300 cm-1附近均有一个较宽的峰,这与分子间H键和O-H伸缩振动有关。LF-Cur复合物与单一LF相比,3300 cm-1附近的峰型均有一定的变化,表明LF与Cur之间存在氢键作用[36]。该结果与文献[37-38]研究结果一致,表明多酚能够通过氢键部分得与蛋白质发生结合。
天然LF在1653 cm-1处和热变性LF在1654 cm-1处的吸收峰为酰胺Ⅰ带的C=O伸缩振动[39-40];如表1,LF25 ℃在1535 cm-1处和LF90 ℃在1541 cm-1处的吸收峰为酰胺Ⅱ带的N-H弯曲振动和C-N伸缩振动[41-43]。C=O键和C-N键的伸缩振动均与蛋白质二级结构单元间的氢键有关[44]。添加Cur(1.08×10-4mol/L)前后,LF在酰胺I带(1600~1700 cm-1处)没有明显差异,但在酰胺II带(1535 cm-1处)有明显红移(约4 cm-1)。LF25 ℃的酰胺II带从1535和1450 cm-1分别红移至1530和1444 cm-1;而LF90 ℃的酰胺II的峰从1455 cm-1蓝移至1456 cm-1。上述结果表明Cur与蛋白质亚基结构中的C=O和C-N基团发生了相互作用。

表1 LF与LF-Cur复合物傅里叶变换红外光谱的峰值
2.5 Cur与天然LF和热变性LF结合常数和结合位点的比较
由图6可知,加热处理后LF的荧光强度增加(约66.81%),这与热变性使得LF两叶依次展开,其构象发生了不可逆的改变有关[24]。随着Cur浓度的升高,LF的荧光强度逐渐减小,表明LF与Cur之间存在结合行为(图6)。在Cur存在下,LF25 ℃和LF90 ℃的λem有明显的蓝移现象(LF25 ℃从346 nm蓝移至337 nm,LF90 ℃从350 nm蓝移至341 nm),这可能与Cur结合到LF的疏水区域有关[45]。
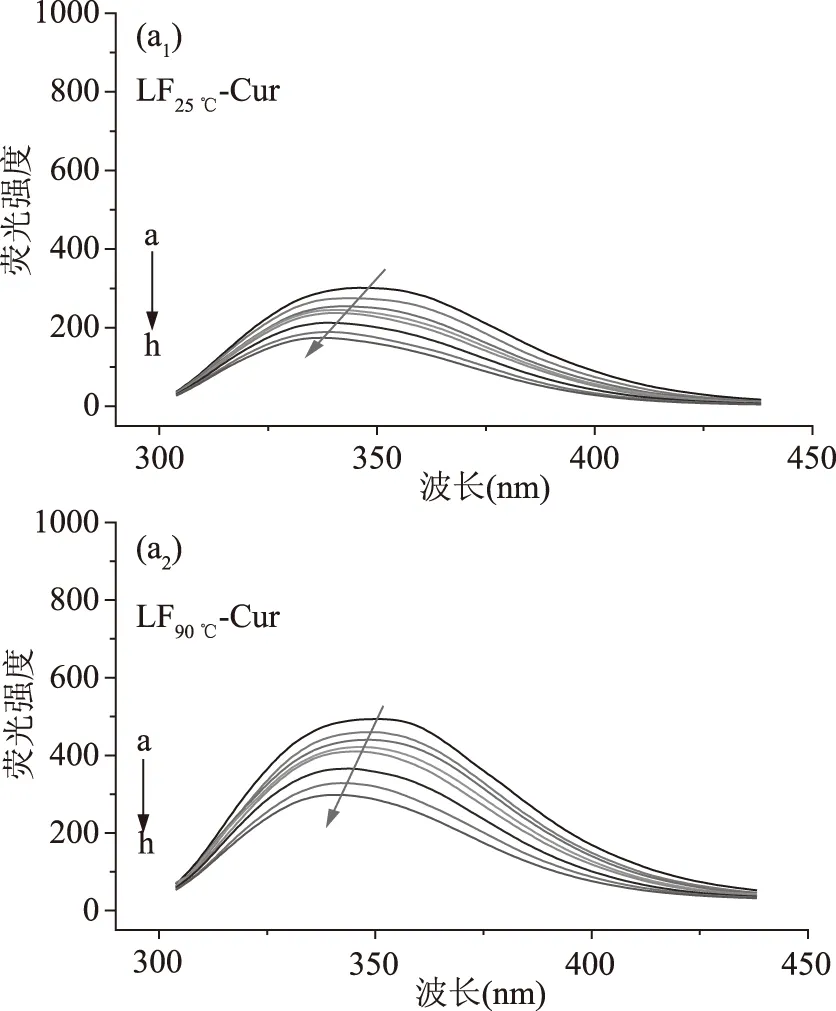
图6 LF-Cur复合物荧光光谱图
通过Stern-Volmer方程(式(1))和双对数方程(式(2))研究了Cur与LF的结合机制(图7)。表2总结了公式(1)和(2)的相关数据。在Stern-Volmer回归曲线的线性范围内,LF25 ℃和LF90 ℃的平均淬灭常数(Ksv)分别为2.69×104M-1和2.47×104M-1。有研究表明,色氨酸的τ0在2.33±0.15 ns与3.16±0.1 ns之间[46]。取τ0值3.16±0.1 ns进行计算,得到kq值分别为8.5×1012M-1s-1和7.8×1012M-1s-1,远高于2.0×1010M-1s-1(动态淬灭最大值)[47]。因此,LF与Cur的相互作用为静态淬灭过程。对于静态淬灭,双对数Stern-Volmer方程(公式(2))可以用于分析计算LF-Cur复合物形成过程的结合常数(Ka)和结合位点数(n)。由表2可知,与Cur的Ka和结合位点数(n)高于LF25 ℃,表明热变性LF与Cur的结合能力较强。

表2 Cur与天然或热变性LF相互作用的Stern-Volmer淬灭常数、结合常数和结合位点数
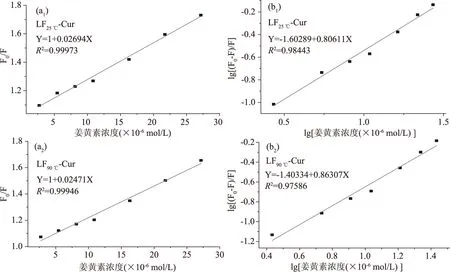
图7 Stern-Volmer方程(a1,a2)和双对数方程拟合图(b1,b2)
2.6 包埋率
表3为Cur在LF25 ℃-Cur复合物和LF90 ℃-Cur复合物的包埋率。由表3可知,与在LF25 ℃-Cur复合物中相比,Cur在LF90 ℃-Cur复合物中的包埋率显著提高。有研究表明,蛋白质疏水性提高有利于其与Cur结合[48]。另外,随Cur浓度的增加,LF对Cur的包埋率均减小,其中天然LF对Cur的包埋率从41.11%±1.71%下降到13.72%±1.77%,热变性LF对Cur的包埋率从62.40%±1.02%下降到26.01%±2.02%。Teng等[31]研究了β-乳球蛋白包埋运载Cur,结果表明,随着Cur浓度的增加,包埋率减小。
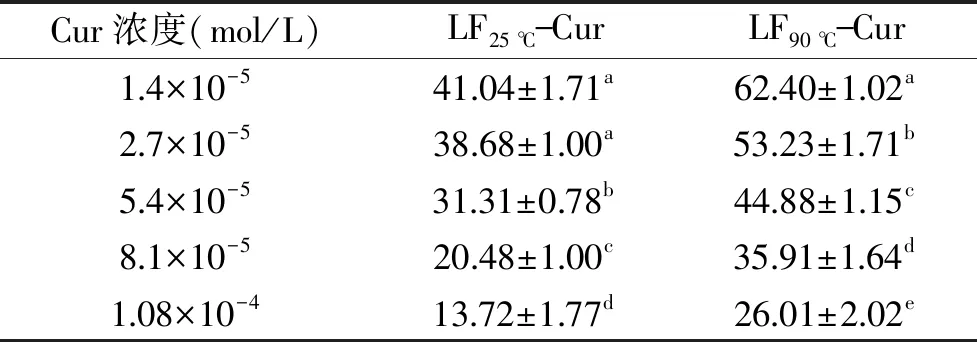
表3 LF-Cur复合物中Cur包埋率(%)
3 结论
LF-Cur复合物的浊度和粒径与Cur浓度和LF结构密切相关。当Cur浓度为(1.4~5.4)×10-5mol/L时,天然LF-Cur复合物为纳米颗粒,溶液浊度低;当Cur浓度为8.1×10-5~1.08×10-4mol/L时,天然LF-Cur复合物为亚微米颗粒,溶液浊度高。热变性LF-Cur复合物均为纳米颗粒,溶液浊度低。红外光谱和圆二光谱表明,Cur能够改变天然和热变性LF的二级结构结构。荧光光谱表明,Cur与天然和热变性LF的结合均为静态淬灭过程,且热变性LF与Cur的结合能力较强,热变性能够提高LF对Cur的包埋率。本研究为开发基于LF为载体运载疏水性多酚提供了理论依据。

