薰衣草提取物的体外抗氧化活性及酶抑制活性研究
王苗苗,严 欢,田 合,毛琼玲,张 倩,李慕春
(新疆维吾尔自治区分析测试研究院,新疆天然产物绿色加工工程技术研究中心,新疆乌鲁木齐 830011)
薰衣草(LavandulaangustifoliaMill.)又名灵香草,唇形科薰衣草属,原产于法国和意大利南部地中海沿海及非洲、西班牙等地,是一种珍贵的天然香料植物,其香气清香肃爽、浓郁宜人[1-2]。经过多年培植,薰衣草在天山脚下伊犁河畔形成规模。新疆伊犁哈萨克自治州,是中国薰衣草种植加工的主要产地,同时也是亚洲地区最大的香料生产基地。薰衣草作为维药入药已有多年的历史,维吾尔医用其治疗腹胀胸闷、感冒咳喘、头晕头痛、心悸气短,关节骨痛等[3-6]。薰衣草富含挥发油、黄酮、香豆素、单宁等,部分次生代谢物由植物防御机制产生,与其治疗特性有关[7-8]。事实上,目前许多植物衍生的药物正处于临床试验阶段,或者用于治疗各种疾病。
研究表明薰衣草等药用植物作为生物活性物质的来源,比如天然抗氧化剂、抗老化剂等,越来越受到人们的重视。许多研究证明,天然抗氧化剂可以降低各种慢性疾病的风险,如阿尔茨海默氏症(AD)等[9-10]。虽然阿尔茨海默氏症的发病机制尚不清楚,但目前可能的假设之一是由于海马体和大脑皮质缺乏乙酰胆碱所致[11-12]。在水解神经递质乙酰胆碱的过程中,乙酰胆碱酯酶(ACHE)和丁酰胆碱酯酶(BCHE)扮演着重要的角色,因此,使用这些酶的抑制剂被认为是一种有效的治疗方法。黑色素可以防止紫外线对皮肤、头发和眼睛造成伤害,但过量则与神经退行性疾病如帕金森病有关[13-15]。酪氨酸酶是一种催化生成黑色素的酶,它的抑制剂可能对治疗皮肤癌或其他与黑色素过度相关的皮肤病有益。然而,薰衣草对于乙/丁酰胆碱酯酶、酪氨酸酶抑制活性的研究鲜有报道。
基于此,本文研究薰衣草组分抗氧化活性及其对乙酰胆碱酯酶、丁酰胆碱酯酶、酪氨酸酶的抑制活性,为生物活性化合物的发现提供理论基础,为疾病的治疗提供实验数据。
1 材料与方法
1.1 材料与仪器
无水乙醇、乙腈、甲醇 天津富宇精细化工有限公司;磷酸氢二钠、磷酸二氢钠、磷酸氢二钾 天津市致远化学试剂有限公司;乙酸钠 天津市福晨化学试剂厂;三氯化铁、氢氧化钠 天津盛奥化学试剂有限公司;硫酸亚铁 西安化学试剂厂;三氯乙酸 天津市大茂化学试剂厂;1,1-二苯基-2-三硝基苯肼(DPPH)、2,4,6-三吡啶基三嗪(2,4,6-tripyridyl-s-triazine,TPTZ)、碘化硫代乙酰胆碱(Acetylthiocholine iodide,ATCI)、5,5′-二硫代双(2-硝基苯甲酸)(5,5′-Dithiobis(2-nitrobenzoic acid),DTNB)、石杉碱甲 阿拉丁试剂(上海)有限公司;抗坏血酸(Ascorbic Acid,VC) 郑州市化学试剂三厂;乙酰胆碱酯酶(Acetyl cholinesterase,ACHE)、氯化丁酰巯基胆碱(Butyl mercaptocholine chloride,BUSCH)、左旋多巴(L-多巴) 西格玛奥德里奇(上海)贸易有限公司;丁酰胆碱酯酶(Butyrylcholinesterase,BUCHE) 上海源叶生物科技有限公司;L-酪氨酸 天津市精细化工研究所;酪氨酸酶、曲酸 上海麦克林生化科技有限公司;总抗氧化能力检测试剂盒A015 南京建成生物工程研究所;薰衣草干花 伊犁紫苏丽人生物科技有限公司。
RT-02A碎样机 北京开创同和科技发展有限公司;TE612-L电子天平 赛多利斯科学仪器有限公司;XS-204电子天平 梅特勒-托利多仪器有限公司;LC-20AP岛津制备液相、UV-2700紫外分光光度计 日本岛津公司;数显恒温水浴锅 上海博迅实业有限公司医疗设备厂;Synergy H1伯腾酶标仪 美国伯腾仪器有限公司;Milli Q超纯水系统 美国密理特公司;石英比色皿 大连市日普利科技仪器有限公司。
1.2 实验方法
1.2.1 薰衣草组分库的制备 称取500.00 g薰衣草干花颗粒,不经粉碎,加入8 L石油醚,浸泡1 h,80 ℃,冷凝回流提取1.5 h,多层纱布过滤,留滤渣;滤渣风干后,加入8 L 70%乙醇溶液,80 ℃冷凝回流提取1.5 h,多层纱布过滤,重复提取一次,滤液合并。滤液于旋转蒸发仪中浓缩,真空冷冻干燥后,得到薰衣草提取物。
称5.00 g提取物用50 mL DMSO溶解后,得100 mg/mL溶液,通过岛津制备液相制备不同的组分。
制备液相分析条件如下:YMC Triart Prep C18柱(50 mm×250 mm×10 μm);流动相:以0.1%甲酸-水溶液为流动相A相,以乙腈为流动相B相;洗脱程序为:0~60 min,B由15%→25%;60~90 min,B由25%→30%;90~120 min,B由30%→60%;120~125 min,B由60%→15%;125~150 min,B由15%→15%;检测波长为280、254 nm;柱温:40 ℃;手动进样,进样量:2 mL;流速:40 mL/min;时间:150 min。采用馏分收集器收集洗脱液,每隔3 min收集一份,运行一次得50个组分。重复进样20针,浓缩,冻干,得薰衣草组分库(50个组分)。
分别称2.0 mg组分库各样品,用乙腈-水溶液溶解,定容至50 mL,配制成0.040 mg/mL的样品液,用于试验分析。
1.2.2 DPPH自由基清除实验 参照文献[16-17]方法。准确称量1,1-二苯基-2-三硝基苯肼(DPPH)粉末14.2 mg,乙醇充分溶解配制成0.72 mmol/L储备液,低温避光保存;临用前用乙醇稀释为0.072 mmol/L使用。实验时,样品组(A1):于10 mL比色管中加入1.0 mL样品液,再加入3.0 mL 72 μmol/L的DPPH溶液,充分混匀后,37 ℃避光反应1 h,测定516 nm处吸光度值;样品对照组(A2)使用异常替代DPPH,空白组(A0)使用乙醇替代样品液。抗坏血酸作为阳性对照。样品DPPH清除率的计算公式为:
DPPH清除率(%)=[1-(A1-A2)/A0]×100
1.2.3 铁离子还原力测定(FRAP)实验 FRAP工作液的配制:由300 mmol/L乙酸钠溶液(pH=3.6)、10 mmol/L TPTZ溶液(由40 mmol/L配制)及20 mmol/L三氯化铁溶液按体积比10∶1∶1配制而成,现用现配。配制好后置于37 ℃水浴中温育备用。
标准曲线制作:准确称取硫酸亚铁粉末55.6 mg,超纯水充分溶解后配制成4 mmol/L标准储备液。使用前稀释成0.001、0.005、0.010、0.025、0.100、0.200、0.400、0.500、0.750、1.000 mmol/L等不同浓度。分别取不同浓度硫酸亚铁标液200 μL于10 mL比色管中,加入配制好的FRAP工作液3.0 mL,加入超纯水1.9 mL,充分混匀,室温避光反应50 min,测定596 nm处吸光度值,制作标准曲线。超纯水做空白对照[18-19]。
样品测定:分别取各薰衣草样品200 μL于10 mL比色管中,加入配制好的FRAP工作液3.0 mL,加入超纯水1.9 mL,充分混匀,室温避光反应50 min,测定596 nm处吸光度值,由标准曲线查出相同吸光度值对应的硫酸亚铁浓度值,样品还原力用硫酸亚铁浓度(mmol/L)表示。抗坏血酸作为阳性对照。
1.2.4 总抗氧化能力(T-AOC)测定 配制T-AOC工作液:按总抗试剂盒说明书要求分别准备好试剂1、2、3溶液,按体积比2∶4∶1充分混合,置于37 ℃水浴中温育备用。
样品测定:样品组(A1):取0.1 mL样品加入3.5 mL工作液,充分混匀后,37 ℃水浴避光反应30 min,加入试剂4溶液0.1 mL,充分混匀后静置10 min,测定520 nm处吸光度值,超纯水做空白;对照组(A2)中样品在加入试剂4溶液后再加入,其余操作同样品组[20]。抗坏血酸作为阳性对照。
总抗氧化能力单位:在37 ℃时,每分钟每毫升样品液使反应体系的吸光度(OD)值每增加0.01时,为一个总抗氧化能力单位。总抗氧化能力计算公式如下:
总抗氧化能力(U/mL溶液)=(A1-A2)×3.7×1/0.01/30/0.1
式中:A1:样品测定组吸光度;A2:样品对照组吸光度;3.7:反应液总体积,mL;1:样品测试前稀释倍数;0.01:总抗氧化能力单位定义相关系数;30:反应时间,min;0.1:取样量,mL。
1.2.5 总还原力测定 在10 mL比色管中加入0.5 mL样品,加入2.5 mL PBS缓冲液(0.2 mol/L,pH=6.6),再加入2.5 mL 1%铁氰化钾溶液,50 ℃水浴20 min后,加入2.5 mL 10%三氯乙酸;3000 r/min离心10 min;取2.5 mL上清液于另一比色管中,加入2.5 mL超纯水和0.5 mL 0.1%的三氯化铁溶液,充分混合,静置10 min后,于700 nm处测定吸光度值[21]。
1.2.6 乙酰胆碱酯酶抑制剂筛选试验 参照Ellman法进行稍许修改,于96孔酶标板上进行样品乙酰胆碱酯酶抑制活性实验[22-23]。具体操作如下:样品组(A1):在96孔板中加入134 μL PB buffer(0.1 mol/L,pH=7.5)、4 μL 乙酰胆碱酯酶(ACHE,1 U/mL)和4 μL样品液,4 ℃孵育20 min后,加入DTNB(10 mmol/L)和ATCI(10 mmol/L)各4 μL,37 ℃孵育20 min,在405 nm处测定吸光度值;样品对照组(A2)使用4 μL PB buffer 替代4 μL ACHE,空白组(A3)使用4 μL PB buffer替代4 μL样品液,完全抑制组(A4)使用4 μL 10 μg/mL石杉碱甲替代4 μL样品液。样品乙酰胆碱酯酶活性抑制率计算公式如下:
抑制率(%)=[1-(A1-A2)/(A3-A4)]×100
1.2.7 丁酰胆碱酯酶抑制剂筛选试验 参照Ellman法进行稍许修改,于96孔酶标板上进行样品丁酰胆碱酯酶抑制活性实验[23-24]。具体操作如下:样品组(A1):在96孔板中加入160 μL PB buffer(0.1 mol/L,pH=7.5)、10 μL 丁酰胆碱酯酶(BUCHE,1 U/mL)和10 μL样品液,4 ℃孵育20 min后,加入DTNB(5 mmol/L)和BUSCH(5 mmol/L)各10 μL,37 ℃孵育20 min,在412 nm处测定吸光度值;样品对照组(A2)使用4 μL PB buffer替代4 μL BUCHE,空白组(A3)使用4 μL PB buffer替代4 μL样品液,完全抑制组(A4)使用4 μL 10 μg/mL石杉碱甲 替代4 μL样品液。样品丁酰胆碱酯酶活性抑制率计算公式如下:
抑制率(%)=[1-(A1-A2)/(A3-A4)]×100
1.2.8 酪氨酸抑制活性研究
1.2.8.1 单酚酶抑制活性的测定 样品组(A1):在96孔酶标板上加入L-酪氨酸(0.5 mmol/L)50 μL,样品液25 μL,混匀后37 ℃孵育5 min,加入酪氨酸酶50 μL(250 U/mL),混匀后37 ℃孵育25 min,于490 nm处测定吸光度值;样品对照组(A2)使用50 μL PBS替代50 μL酪氨酸酶;空白组(A3)使用25 μL PBS替代25 μL样品液;空白对照组(A4)使用25 μL PBS替代25 μL样品液,并使用50 μL PBS(0.2 mmol/L,pH=6.8)替代50 μL酪氨酸酶[25-27]。使用10 μg/mL曲酸作为阳性对照。抑制率计算公式如下:
抑制率(%)=[1-(A1-A2)/(A3-A4)]×100
1.2.8.2 二酚酶抑制活性的测定 样品组(A1):在96孔酶标板上加入L-多巴(0.5 mmol/L)50 μL,样品液30 μL,混匀后37 ℃孵育5 min,加入酪氨酸酶25 μL(100 U/mL),混匀后37 ℃孵育25 min,于475 nm处测定吸光度值;样品对照组(A2)使用25 μL PBS(0.2 mmol/L,pH=6.8)替代25 μL酪氨酸酶;空白组(A3)使用30 μL PBS替代30 μL样品液;空白对照组(A4)使用30 μL PBS替代30 μL样品液,并使用25 μL PBS替代25 μL酪氨酸酶。使用10 μg/mL曲酸作为阳性对照。抑制率计算公式如下:
抑制率(%)=[1-(A1-A2)/(A3-A4)]×100
1.3 数据处理
所有试验均做3组平行,采用SPSS 17.0和Origin 8进行数据分析处理,结果以平均值±标准差表示。
2 结果与分析
2.1 薰衣草组分库制备
对薰衣草组分库进行制备液相分析,结果如图1,运行时间150 min,每3 min收集一个馏分,获得0~49号管,共50个组分。
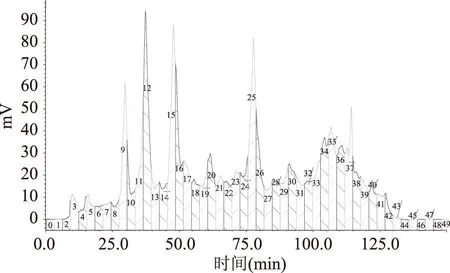
图1 薰衣草提取物的制备液相色谱图
2.2 DPPH自由基清除率测定结果
DPPH是一种比较稳定的自由基,其乙醇水溶液呈较深的紫色,在波长516 nm处有强吸收,如果样品中的抗氧化物质可将其清除,则吸光将会减弱,可以根据吸光度值减少的程度来判断样品抗氧化能力的强弱。
对薰衣草组分库的50个样品进行了DPPH自由基清除率测定,由表1可知,50个样品对DPPH表现出了不同程度的清除作用。其中25#(90.29%±4.51%)、26#(93.95%±4.70%)、27#(92.42%±4.62%)、35#(93.39%±4.67%)、36#(92.96%±4.65%)组分对DPPH自由基的清除率达到90%以上,具有较高的清除DPPH自由基活性,与50 μg/mL阳性化合物抗坏血酸(93.47%±4.67%)的清除率差异显著(p<0.05)。其余组分的DPPH自由基清除率在15%~25%和55%~75%之间,由此可知,薰衣草组分库的50个样品对DPPH的清除作用明显,抗氧化活性高。
2.3 FRAP测定结果
以FeSO4为标准物质绘制标准曲线(见图2),得标准曲线方程为A=0.9589C+0.0406,决定系数R2=0.999,由标准曲线查出样品吸光度值对应的硫酸亚铁浓度值(mmol/L),以此表示样品的抗氧化能力。
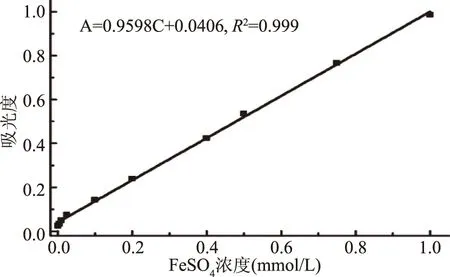
图2 FeSO4标准曲线
抗氧化物质在酸性条件下可以将Fe3+-TPTZ还原成为蓝色的Fe2+-TPTZ,之后在593 nm处测定吸光度,即可根据吸光度值大小判断样品抗氧化能力的大小。由表1可知26#(0.647±0.039 mmol/L FeSO4)、27#(0.499±0.030 mmol/L FeSO4)、36#(0.400±0.024 mmol/L FeSO4)组分的FRAP值均显著高于阳性对照10 μg/mL 抗坏血酸(0.387±0.023 mmol/L FeSO4)的FRAP值,具有较强的抗氧化活性,这与DPPH自由基清除率实验结果也具有一致性;但1#~8#、40#~50#组分的FRAP值小于0.1 mmol/L FeSO4,抗氧化活性弱;其余组分的FRAP值均在0.1~0.3 mmol/L FeSO4,抗氧化活性各不相同,但差异不显著。
2.4 总抗氧化能力测定结果
对薰衣草组分库中的50个样品进行总抗氧化能力的测定结果见表1,26#(6.210±0.373 U/mL)、27#(3.575±0.214 U/mL)组分具有较高的总抗氧化能力值,均显著(p<0.05)高于阳性对照10 μg/mL抗坏血酸(2.602±0.156 U/mL);31#(2.427±0.146 U/mL)、35#(2.427±0.146 U/mL)组分总抗氧化能力值小于阳性对照,具有较好的总抗氧化能力;10#~40#组分的总抗氧化能力虽各不相同,但都≥1 U/mL;其余个组分总抗氧化能力较弱。
2.5 还原力测定结果
还原力是抗氧化活性高低的一个重要指标。样品中的抗氧化物质将反应体系中的三价铁离子还原成二价铁离子,在波长700 nm处具有强吸收,吸光度越高表明还原能力越强。由表1可知,26#(0.234±0.026)、27#(0.179±0.020)、35#(0.122±0.013)、36#(0.137±0.015)组分具有高的吸光度值,具有强的还原能力;阳性对照100 μg/mL 抗坏血酸的吸光度(0.412±0.045),为这些组分的2~3倍;20#~25#吸光度在0.1000附近,还原能力次之;其余组分吸光度低,还原能力弱。通过DPPH、FRAP、T-AOC及还原力测定,可知组分库中26#、27#、35#、36#组分具有高的抗氧化活性,具有成为天然抗氧化剂的潜能,可进一步研究探索。

表1 抗氧化活性测定结果
2.6 胆碱酯酶抑制活性研究
对薰衣草组分库中的50个样品进行了乙/丁酰胆碱酯酶抑制剂筛选试验,结果见表2。由表2可知16#(66.37%±5.82%)、18#(69.73%±1.91%)、19#(68.20%±1.03%)、20#(74.98%±2.28%)、24#(60.83%±2.23%)、37#(76.37%±1.97%)组分乙酰胆碱酯酶抑制率均大于60%,抑制活性高。20#~40#组分的乙酰胆碱酯酶抑制活性显著高于其它组分,抑制率在40%~60%之间。其余组分抑制活性低。薰衣草组分库50个组分的丁酰胆碱酯酶抑制活性与乙酰胆碱酯酶抑制活性相比较低。其中24#(20.58%±3.71%)、25#(20.53%±2.97%)、39#(20.31%±3.48%)、43#(21.44%±2.16%)、46#(23.37%±3.69%)丁酰胆碱酯酶抑制率大于20%,其余各组分抑制率均小于20%,丁酰胆碱酯酶抑制活性普遍较低。其中24#对于乙酰胆碱酯酶和丁酰胆碱酯酶的综合抑制活性显著高于其他组分。

表2 乙酰胆碱酯酶抑制活性和丁酰胆碱酯酶抑制活性测定结果
2.7 酪氨酸抑制剂筛选
以L-酪氨酸为底物,对薰衣草组分库中的50个组分进行了酪氨酸酶单酚酶抑制活性研究,结果见表3。酪氨酸酶单酚酶抑制活性研究时需要较高活性的酪氨酸酶,薰衣草组分库的各组分对单酚酶的抑制率普遍低于70%。其中16#(58.73%±4.18%)、17#(59.92%±0.69%)、18#(59.92%±0.69%)、19#(59.92%±0.69%)、20#(58.33%±1.19%)组分对酪氨酸酶单酚酶的抑制活性较高,与阳性对照曲酸(67.86%±0.38%)的抑制率差异不显著;其余各组分对酪氨酸单酚酶的抑制率均小于50%,抑制活性弱。
以L-多巴为底物进行了薰衣草组分库50个组分的酪氨酸酶二酚酶抑制活性筛选实验。薰衣草组分库中组分对酪氨酸酶二酚酶的抑制活性普遍高于对酪氨酸酶单酚酶的抑制活性。由表3可知,1#~20#组分对酪氨酸酶二酚酶的抑制率几乎均高于70%,其中16#(94.69%±2.65%)、17#(92.04%±2.34%)、18#(92.04%±0.88%)、19#(92.92%±0.00%)、20#(90.56%±2.55%)组分的酪氨酸酶二酚酶抑制活性比较高,与阳性对照曲酸(92.92%±0.05%)的抑制率差异显著(p<0.05);21#~50#组分的酪氨酸酶二酚酶抑制率较低,抑制活性弱。其中组分16#~20#对酪氨酸单/二酚酶抑制活性均较优,具有进一步开发研究的潜能。
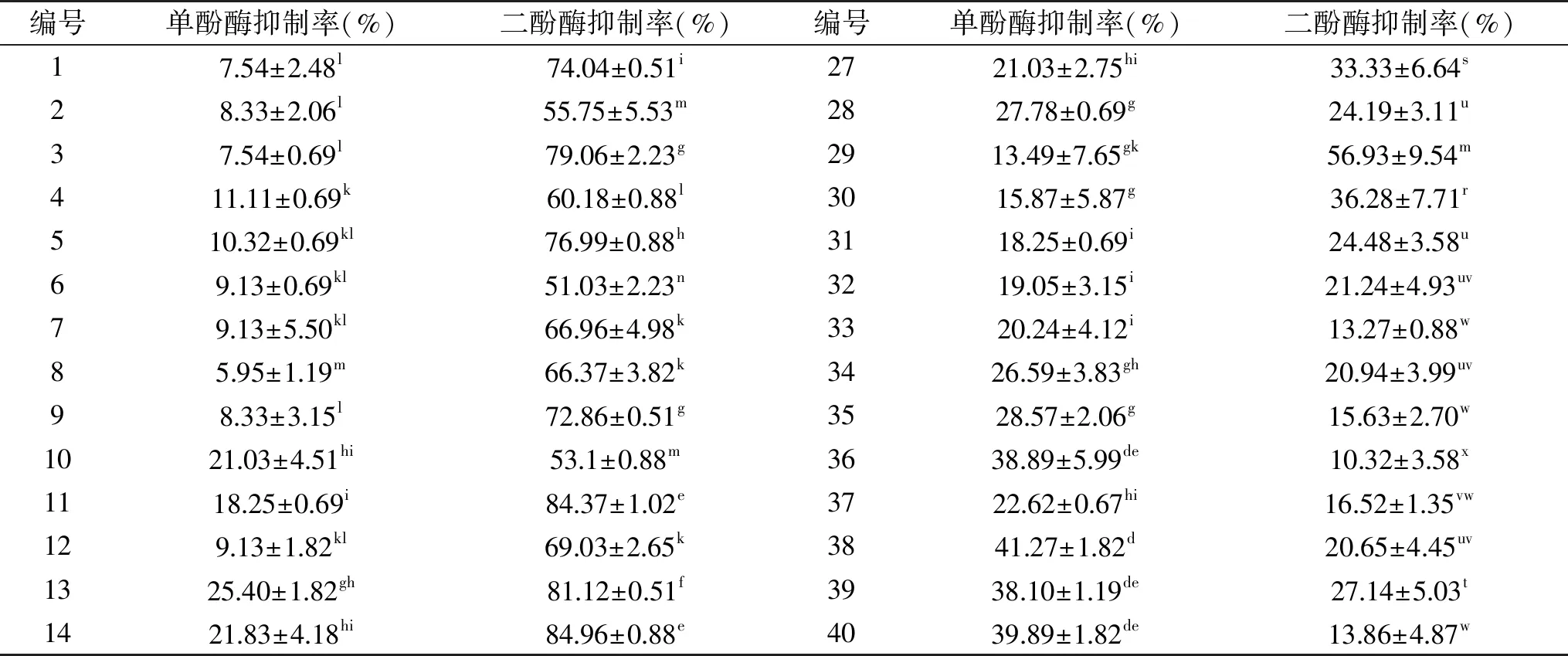
表3 酪氨酸酶抑制活性测定结果

续表
3 结论
通过薰衣草抗氧化实验,可以得知组分25#、26#、27#、35#、36#有较高的抗氧化活性,具有成为天然抗氧化剂的潜能;16#、17#、18#、19#、20#组分对胆碱酯酶和酪氨酸酶的抑制活性显著(p<0.05),有开发成为治疗阿尔茨海默症或皮肤癌等相关疾病药物的潜能。研究表明,薰衣草含有的挥发油、黄酮、多酚、花色苷等物质具有抗氧化活性,保护神经系统、治疗老年痴呆及美白的疗效。由此可知,薰衣草提取物具有的抗氧化活性及抑制胆碱酯酶、酪氨酸酶活性可能是多种活性物质共同作用的结果,仍需进一步研究求证。在后续研究中,对于活性较好的组分,综合运用多种方法,设置多个浓度梯度,进一步更精准的考察、评价其抗氧化及酶抑制活性及相关的物质基础。

