异硫氰酸苄酯及其类似物抑菌活性的初步探究
王 翠,李 萍,朱华平,2,*,李 超,杨强强,随宝斌
(1.天津科技大学食品工程与生物技术学院,省部共建食品营养与安全重点实验室,天津 300457;2.中国农村技术开发中心,北京 100045)
异硫氰酸苄酯(Benzyl isothiocyanate)是一种广泛存在于十字花科蔬菜中的有机硫化合物,由异硫氰酸基团(-N=C=S)、亚甲基和苯环构成,属于典型的异硫氰酸酯类(Isothiocyanates,ITCs)[1]。ITCs是植物中次级代谢产物硫代葡萄糖苷(Glucosinolate,GS)的酶解产物,十字花科植物在被外力破坏时会激活其细胞内硫代葡萄糖苷酶(芥子酶)的活性,从而使GS水解为ITCs[2]。异硫氰酸苄酯对许多肿瘤系细胞都具有较强的抑制作用,如肝癌[3]、皮肤癌[4]、前列腺癌[5]、乳腺癌[6]等。除此之外,异硫氰酸苄酯具有广谱抑菌性,如对产气荚膜梭菌[7]、副溶血性弧菌[8]、空肠弯曲杆菌[9]、大肠杆菌[10]等均有不同程度的抑制活性。
异硫氰酸苄酯常见的结构类似物有异氰酸苄酯、异硫氰酸苯酯、异硫氰酸苯乙酯、异硫氰酸乙酯等(结构见图1),其中异氰酸苄酯是合成生物素中常用的关环试剂[11],对于优化工艺有重要的意义;异硫氰酸苯酯和异硫氰酸苯乙酯的结构与异硫氰酸苄酯相似,主要差异在于亚甲基的个数不同,具有一定的抑菌性能[8,12];异硫氰酸乙酯也是一种典型的异硫氰酸酯类,但与异硫氰酸苄酯相比缺少苯环,可用于果蔬灰霉病和扩张性青霉感染的防治,在农业及制药行业中承担着重要的角色[13]。
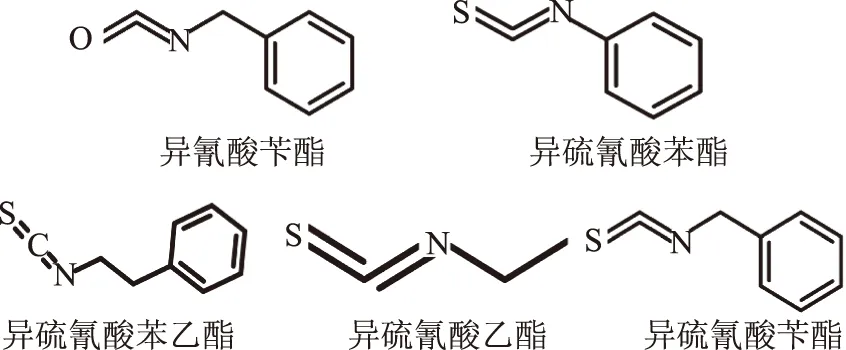
图1 异硫氰酸苄酯及其类似物的结构
国内外对异硫氰酸苄酯的抗癌、抑菌的研究主要集中在其作用机理及其作用范围方面,对其抑菌活性的相关基团的研究鲜有报道。因此,本研究选取了异硫氰酸苄酯及其常见的4种结构类似物质(异氰酸苄酯、异硫氰酸苯酯、异硫氰酸苯乙酯、异硫氰酸乙酯),通过初步研究其对革兰氏阴性菌(大肠杆菌)以及革兰氏阳性菌(金黄色葡萄球菌)抑菌活性,阐明异硫氰酸苄酯的抑菌活性基团及抑菌机理,为异硫氰酸苄酯的临床应用提供理论基础。
1 材料与方法
1.1 材料与仪器
异氰酸苄酯(98%)、异硫氰酸苯酯(98%)、异硫氰酸苯乙酯(99%)、异硫氰酸乙酯(95%)、异硫氰酸苄酯(98%)、罗丹明123、二甲基亚砜(DMSO) 美国Sigma公司;大肠杆菌ATCC 10305(E.coliATCC 10305)、金黄色葡萄球菌ATCC 25923(S.aureusATCC 25923) 天津科技大学菌种库;胰蛋白胨、酵母浸取物、琼脂、葡萄糖 英国OXOID公司;己糖激酶(HK)测试盒、丙酮酸激酶(PK)测试盒、果糖磷酸激酶(PFK)测试盒、超微量总ATP酶测试盒 南京建成生物工程研究所;LB液体培养基:胰蛋白胨2.0 g,酵母膏1.0 g,氯化钠2.0 g,去离子水200 mL,121 ℃下高压灭菌15 min,备用;LB固体培养基:胰蛋白胨2.0 g,酵母膏1.0 g,氯化钠2.0 g,琼脂3.0 g,去离子水200 mL,121 ℃下灭菌15 min,倾注于无菌培养皿中冷却,备用;罗丹明123试剂:配制浓度为5 μg/mL,溶剂为DMSO,备用。
酶标仪、荧光分光光度计、摇床、恒温培养箱 美国Thermo公司;电导率仪 上海雷磁创益仪表有限公司;紫外分光光度计 德国Eppendorf公司。
1.2 实验方法
1.2.1 抑菌定性实验 采用打孔法[14]对异硫氰酸苄酯、异氰酸苄酯、异硫氰酸苯酯、异硫氰酸苯乙酯及异硫氰酸乙酯进行抑菌定性实验。取1 mL浓度为106cfu/mL的菌液均匀涂布于LB固体培养基上,置于无菌操作台中吹干,打孔器打孔(直径为6 mm),加入等体积同浓度(均用DMSO配制成20 μg/mL)的5种试剂,DMSO作为阴性对照。最后将培养皿密封后置于37 ℃恒温培养箱中培养24 h,测量抑菌圈直径。抑菌圈直径≥7 mm,则认为该物质具有抑菌性能[15]。
1.2.2 最低抑菌浓度(MIC)及最低杀菌浓度(MBC)的测定 采用2倍稀释法[16]对具有抑菌活性的物质测定MIC和MBC。使用96孔板进行实验,96孔板从左至右分别标记为A1~A12,所用菌液浓度为106cfu/mL。
在A1列中加入160 μL菌液、40 μL抑菌物质(使A1终浓度为8000 μg/L),在A2~A10列内加入100 μL菌液,在A11列中加入100 μL LB培养液作为阴性对照,在A12列中加入100 μL菌液作为阳性对照。从A1中吸取混合液100 μL至A2,再从A2吸取100 μL至A3,依次吸取直至A10,完成2倍稀释(A1~A10中抑菌物质浓度分别为8000、4000、2000、1000、250、125、62.5、31.25、15.625、7.8125 μg/L)。将96孔板置于37 ℃摇床中培养5~6 h后,用酶标仪测定吸光度,确定MIC。在此基础上,从每孔中取10 μL混合液涂布到LB培养基上,37 ℃培养24 h后,观察菌落生长情况。未见菌落生长时的抑菌剂最低添加浓度即为MBC。
通过下式计算抑菌率:
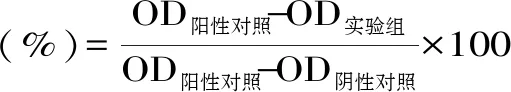
注:其中阴性对照为LB的吸光度值,阳性对照为未添加抑菌物质的正常菌液,本实验中将抑菌率达到60%以上的浓度定义为MIC。
1.2.3 抑菌生长曲线的测定 采用比浊法测定微生物的抑菌生长曲线。取单菌落至LB液体培养基中,摇床(37 ℃,200 r/min)摇菌,以获取106cfu/mL菌液,在菌液中添加抑菌物质(使抑菌物质终浓度均为抑菌作用最强的抑菌物质的MIC值),摇床(37 ℃,200 r/min)培养12 h,每隔1 h取菌液,于波长600 nm处测定OD值。以时间为横坐标,以OD600值为纵坐标,绘制抑菌生长曲线。
1.2.4 抑菌机理研究
1.2.4.1 菌体膜电位的测定 使用罗丹明123染色试剂来检测细菌膜电位的变化[17],以此反映菌体的代谢活力。在106cfu/mL的菌液中加入一定量罗丹明123储备液,使终浓度为10 μg/mL,摇床培养10 min,以PBS洗菌,重悬于LB培养液中,分管后分别加入不同的抑菌物质(终浓度为各抑菌物质的MIC值),37 ℃摇床摇菌 60 min后检测其荧光强度,未加入任何抑菌物质的样品为空白对照。
1.2.4.2 能量代谢相关酶活的测定 利用高压破壁(大肠杆菌)及反复冻融(金黄色葡萄球菌)的方法对过夜菌液进行破壁处理,获得粗酶液后用不同抑菌剂处理30 min,按试剂盒相关操作步骤,对处理前后粗酶液中的ATP酶、HK酶、PK酶及PFK酶的酶活进行检测。
1.3 数据处理
每个实验均进行3次以上重复,数据由Origin 8.0软件进行分析,并以平均值±标准偏差表示,组间比较采用单因素方差分析。
2 结果与分析
2.1 抑菌活性基团探究
2.1.1 抑菌定性实验 由表1、图2可看出,5种物质对E.coli及S.aureus均具有不同程度的抑菌活性,且S.aureus对抑菌物质更敏感。异硫氰酸苄酯及异氰酸苄酯在固体培养基上产生的抑菌圈较大,其次为异硫氰酸苯酯,但由于本实验中所用的5种物质均为脂溶性物质,可能会造成在固体培养基上的扩散性不一致,进而会导致其抑菌圈大小与实际抑菌效果强弱的偏差,因此需要在液体培养基中进一步抑菌实验。
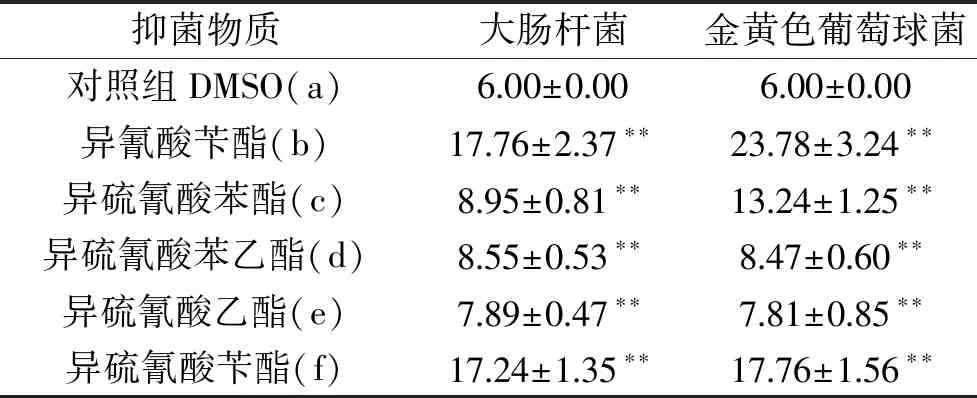
表1 不同物质的抑菌圈直径(mm)
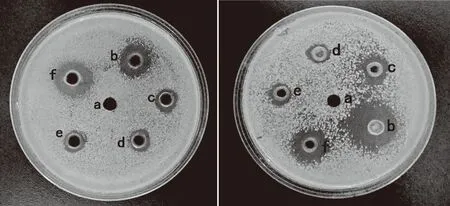
图2 大肠杆菌(左图)和金黄色葡萄球菌(右图)的抑菌定性实验
2.1.2 最低抑菌浓度及最小杀菌浓度的测定 表2与表3分别是5种物质对两种致病菌的MIC及MBC。根据数据的统计分析可知,5种抑菌物质对E.coli和S.aureus均存在较强的抑菌性,但在作用效果上也存在一定的差异。其中,异硫氰酸苄酯、异硫氰酸苯酯以及异硫氰酸乙酯抑菌效果突出,表2中异硫氰酸苯酯对E.coli的MIC为500 μg/L、MBC为2000 μg/L,表3可以看出,异硫氰酸乙酯MIC则为500 μg/L、MBC为1000 μg/L,异硫氰酸苄酯为1000 μg/L、MBC为2000 μg/L;异硫氰酸苄酯以及异硫氰酸苯酯对S.aureus的MIC为500 μg/L、MBC为2000 μg/L,异硫氰酸乙酯MIC则为250 μg/L、MBC为1000 μg/L。整体上,MBC与MIC浓度变化呈现一致性,并且S.aureus对抑菌物质呈现高的敏感性,这与抑菌圈定性实验的结果相一致。
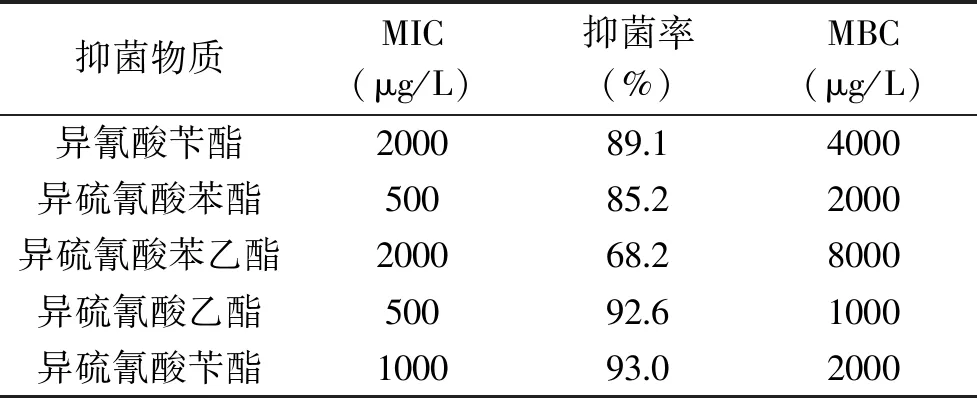
表2 不同抑菌物质对大肠杆菌的MIC及MBC
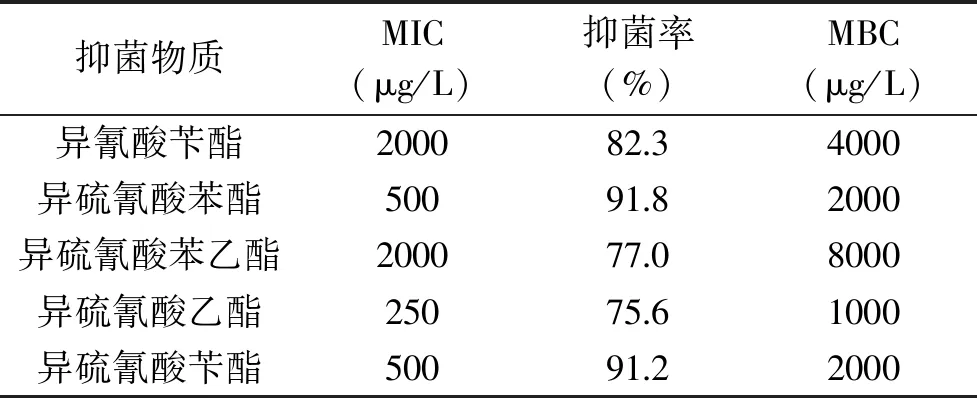
表3 不同抑菌物质对金黄色葡萄球菌的最低抑菌浓度(MIC)
2.1.3 抑菌生长曲线的测定 选取抑菌性能最强的抑菌物质(异硫氰酸乙酯)的MIC作为抑菌生长曲线测定中抑菌剂的添加浓度。E.coli的抑菌剂添加浓度为500 μg/L,由图3可以发现,添加异硫氰酸苯乙酯、异氰酸苄酯以及异硫氰酸苄酯的菌液分别在1、2和3 h出现生长现象,并且在后期生长状态与原菌液相似,而添加异硫氰酸乙酯与异硫氰酸苯酯的样品直至实验结束时,细菌的OD值基本未发生改变;S.aureus抑菌剂添加浓度为250 μg/L。结果表明,添加异硫氰酸苯乙酯的菌液与原菌液基本无差异,添加异氰酸苄酯、异硫氰酸苄酯及异硫氰酸苯酯的菌液分别在2、3以及6 h出现生长现象,添加异硫氰酸乙酯的菌液OD值未发生明显改变。
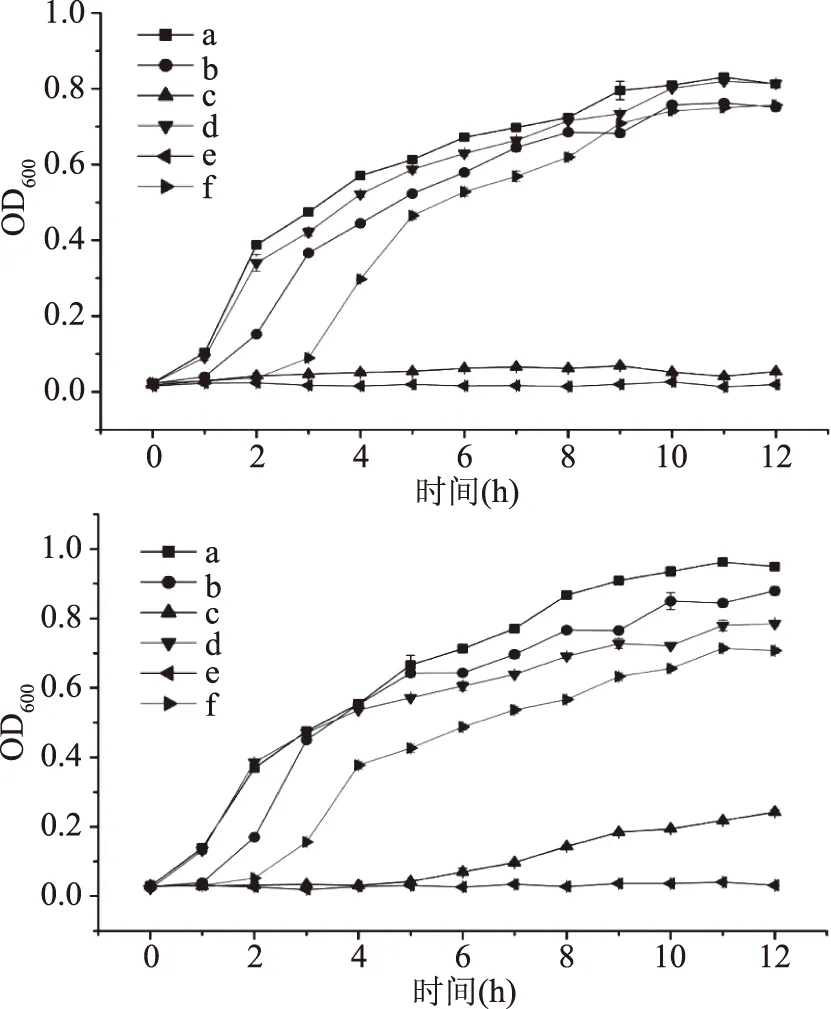
图3 大肠杆菌(左)和金黄色葡萄球菌(右)的抑菌生长曲线
2.1.4 抑菌活性基团的探讨 通过对抑菌圈大小、MIC、MBC和抑菌生长曲线的测定,可知异硫氰酸苄酯及4种结构类似物质均具有抑菌性,尤其对S.aureus的抑制作用更强。抑制作用强弱顺序依次为异硫氰酸乙酯>异硫氰酸苯酯>异硫氰酸苄酯>异氰酸苄酯>异硫氰酸苯乙酯。
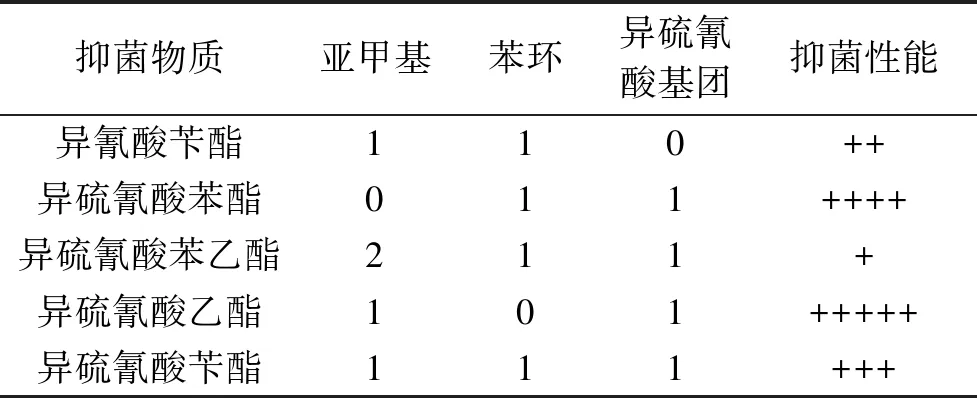
表4 5种物质的结构差异及抑菌活性比较
结合物质结构分析可知,对于R-(CH2)n-NCS结构的异硫氰酸酯类,随着n值的增加,物质的抑菌活性逐渐减弱,这与王岩等[18]的研究结果相一致;对于缺失苯环的异硫氰酸酯类(如异硫氰酸乙酯)而言,抑菌活性仍然很强,甚至高于异硫氰酸苄酯;对于异硫氰酸基团残缺但具有苯环的物质(如异氰酸苄酯)抑菌活性明显降低。因此,可以初步推断异硫氰酸苄酯的抑菌活性并不是某个基团独立的作用,而是其苯环、异硫氰酸基团及亚甲基三者协同作用的结果,并且三者中异硫氰酸基团对其抑菌活性的决定性作用最大、亚甲基次之、苯环最弱,且苯环的存在可能对其抑菌作用存在抑制作用。
2.2 抑菌机理初步研究
2.2.1 菌体膜电位的测定 研究表明,异硫氰酸苄酯在发挥抗癌作用时功能相关部位造成影响[19],膜电位能反应细胞代谢活性,因此本实验中选用了罗丹明123作为荧光指示剂,测定菌体膜电位,结果见图4。
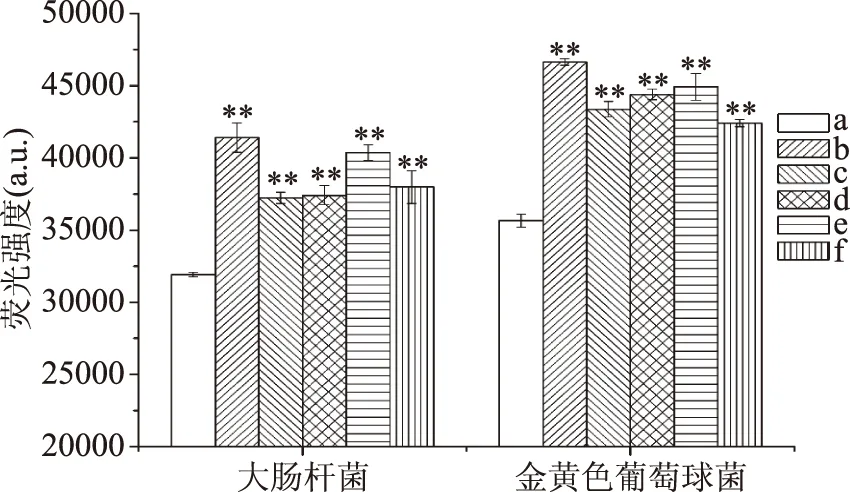
图4 5种物质对大肠杆菌和金黄色葡萄球菌细胞膜电位的影响
图4表明,抑菌物质处理后的样品,其荧光强度均发生了不同程度的极显著(p<00.1)上升,即不同抑菌剂均造成了菌体膜电位的改变,对细菌代谢活性产生了影响,从而抑制了其生长。此外,由图4可以看出,异氰酸苄酯(具有-N=C=O)作用于菌体后其荧光强度上升最为明显,这可能是由于氧原子比硫原子更加活泼,因此导致异氰酸苄酯对菌体代谢活性的影响更加显著;其余4种异硫氰酸酯类抑菌物质中,异硫氰酸乙酯(无苯环)对膜电位的影响较大,同时具有苯环及异硫氰酸基团的3种物质对膜电位的影响较小,这说明苯环的存在可能抑制了抑菌物质对膜电位的影响。
2.2.2 能量代谢相关酶活的测定 ATP酶是一种跨膜的氧化磷酸化途径关键酶,HK酶、PK酶以及PFK酶是糖酵解途径的3种关键酶,这4种酶与菌体的能量代谢息息相关。因此,通过对这4种典型酶类酶活的测定,进一步检测5种抑菌物质对细菌能量代谢的影响。结果如图5所示,5种抑菌物质对ATP酶的活性均产生不同程度的抑制作用,其中异氰酸苄酯(-N=C=O)对ATP酶活的影响最为显著,可使S.aureus中的ATP酶基本失活;异硫氰酸乙酯(无苯环)对ATP酶的作用次之,但比同时具有苯环及异硫氰酸基团的异硫氰酸酯类抑菌物质作用效果强,这与膜电位结果相一致。对于HK酶、PK酶及PFK酶而言,异氰酸苄酯与异硫氰酸乙酯的作用规律呈现一致性,其中异氰酸苄酯作用效果最强,异硫氰酸乙酯次之;在S.aureus中,对于HK酶而言,这种作用效果更强。其余3种同时具有苯环及异硫氰酸基团的异硫氰酸酯类物质对这3种酶的酶活均不造成显著性影响,这可能与苯环的存在有关。
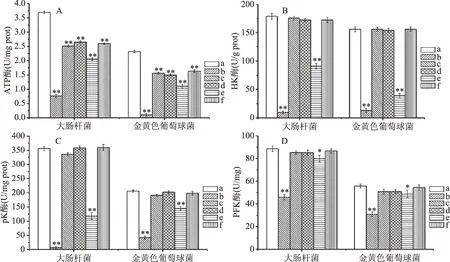
图5 5种物质对能量代谢相关酶活的影响
3 结论
异硫氰酸苄酯的抑菌活性并不是某一个基团单独作用的结果,而是异硫氰酸基团、苯环以及连接它们的亚甲基协同作用的结果,三者中异硫氰酸基团对其抑菌活性的决定性作用最大、亚甲基次之、苯环最弱,甚至对其抑菌活性有一定的抑制作用。结果也表明,5种抑菌物质对细菌的能量代谢均具有影响,且结构不同的抑菌物质对细菌的代谢活性以及相关酶活性的影响不同。其中硫原子被氧原子取代的异氰酸苄酯对菌体膜电位和能量代谢相关酶的影响最大,缺失苯环的异硫氰酸乙酯次之,而具有苯环的3种异硫氰酸酯类物质作用效果更弱,即苯环在其对菌体代谢的影响上存在抑制作用。另外,对能量代谢影响最为明显的异氰酸苄酯,其抑菌活性并不是最强的,这说明这些基团对菌体很可能还存在其他抑制机理。
异硫氰酸苄酯具有良好的生物活性,在抑菌、抗癌方面具有广阔的应用前景,本研究中关于其抑菌活性基团以及类似物的研究也将为其进一步应用提供理论依据。

