艾灸预处理天枢穴对溃疡性结肠炎大鼠结肠TLR4/TRIF信号通路调节作用的研究
杨玲,黄艳,黄任佳,马晓芃,马喆,刘雅楠,郑寒丹,朱毅,刘慧荣,王照钦,吴璐一
(1.上海市针灸经络研究所,上海 200030;2.上海中医药大学附属岳阳中西医结合医院,上海 200437;3.上海中医药大学针灸免疫效应重点研究室,上海 200030)
溃疡性结肠炎(ulcerative colitis, UC)是一种病因未明的慢性非特异性肠道炎性疾病,好发于年轻人,病程慢性迁延且易反复发作,临床治愈率低并有癌变的可能,严重影响患者的生活质量。UC属于现代难治病,发病机制尚未完全阐明,主要与遗传易感性、肠黏膜屏障缺陷、免疫反应失调、环境因素等有关[1]。
Toll样受体(Toll-like receptors, TLRs)是最早被发现的一类模式识别受体(pattern recognition receptors, PRRs),是连接天然免疫和特异性免疫的跨膜信号转导受体家族,其最突出的生物学功能是促进细胞因子的合成与释放,引发炎症反应[2]。TLR4是TLRs家族中研究最为广泛的一种,活化的TLR4可激活MyD88依赖性信号转导通路,TLR4通过招募主要接头蛋白MAL(TIRAP)和MyD88,激活IKKα、IKKβ等一系列蛋白磷酸化激酶,导致转录因子 NF-κB激活并入核而启动炎症因子基因表达[3-4]。对MyD88基因敲除小鼠的研究发现,MyD88基因敲除小鼠对LPS仍有反应性,仍能激活NF-κB的信号转导,表明TLR4介导的信号转导通路中除了MyD88依赖性途径外,还存在MyD88非依赖途径[5]。β干扰素 TIR结构域衔接蛋白(TRIF)是和MyD88同样具有 TIR结构域结构的接头蛋白,在 TLR4介导的MyD88非依赖途径中起关键作用。研究发现UC患者结肠黏膜中TLR4表达显著升高,且与UC的发生发展有关[6-9]。以TLR4为靶点,寻找UC的特异性疗法,可能是UC防治的一个切入点。
艾灸具有抗炎、调节机体免疫的作用,在UC的临床应用中具有一定的优势[10-11]。“艾灸预处理”属于中医治未病的范畴,应用于 UC的防治,可拓展艾灸的临床应用范围。课题组前期研究发现,艾灸预处理能够调节 UC大鼠肠黏膜屏障相关蛋白,降低炎症反应,改善UC大鼠结肠的病理状态,达到预防UC的目的[12]。基于前期研究基础,本研究拟从TLR4介导的MyD88非依赖途径——TLR4/TRIF信号通路角度,探讨艾灸预处理“天枢”穴防治UC的免疫机制。
1 材料和方法
1.1 实验对象
清洁级 Sprague Dawley(SD)大鼠 28只,体质量(180±20)g,委托上海中医药大学实验动物中心订购,并提供适宜的饲养环境:12 h昼夜节律交替、室温(20±2)℃,室内湿度 50%~70%,所有实验操作均在上海中医药大学动物伦理委员会指导下进行。
1.2 主要药物和试剂
1.3 实验分组
大鼠适应性饲养1周后,采用完全随机设计方法,分成正常组、模型组、隔药灸预处理组和温和灸预处理组,每组7只。
1.4 干预方法
本实验共分为两个阶段干预,第一阶段为预处理阶段,第二阶段为模型制备阶段。
艾灸预处理(第 1~7天):隔药灸预处理组,行隔药灸干预;温和灸预处理组,行温和灸干预;正常组、模型组不予干预,只做与隔药灸预处理组相同的抓取与固定。隔药灸预处理干预方法:将药饼(直径1 cm、厚度0.5 cm)置于大鼠天枢穴区,上置艾炷(重量为90 mg)施灸,每日1次,每次每穴灸2壮,连续灸7 d;温和灸预处理方法:采用大鼠实验专用艾条(直径 7 mm、长120 mm,重 2 g)距离天枢穴 2 cm处施灸,间隔 2 min刮取艾灰1次,每日1次,每次每穴灸10 min,连续灸7 d。
模型制备(第8~14天):隔药灸预处理组、温和灸预处理组、模型组,均予 4%DSS水溶液连续饮用制备UC模型[13];正常组不予处理。
1.5 标本的采集和处理
大鼠予腹腔注射2%的戊巴比妥钠(30~40 mg/kg)麻醉处理后,暴露大鼠腹腔,分离结肠,自耻骨联合处—盲肠取下整段结肠,沿肠系膜纵行剖开,予生理盐水轻柔漂洗后肉眼观察结肠大体形态,自下而上截取结肠6~8 cm,分成两部分,一部分固定于4%多聚甲醛固定液中,用于形态学观察;剩余部分置于液氮1 h后转移至-80℃冰箱保存备用。
1.6 指标检测
1.6.1 结肠组织病理学观察
结肠组织切片采用HE染色后,于光学显微镜下观察大鼠结肠组织病理学变化。主要步骤包括切片常规脱蜡至水,二甲苯Ⅰ、Ⅱ各 20 min;100%、95%、90%、80%、70%乙醇各5 min;双蒸水5 min×2次;苏木素浸染2~3 min;流水冲洗10 min;1%盐酸乙醇分化1~2 s;流水冲洗5 min;伊红浸染2~3 min;70%、80%、90%、100%乙醇各1~2 s;二甲苯Ⅰ、Ⅱ各15 min;封片,置于光学显微镜下观察。
综上所述,肝局灶性结节增生是发病率较低的一类良性占位病变,该疾病不是真正的肿瘤疾病,发病原因还不清楚,女性患者发病率比男性高。临床中对肝局灶性结节性增生患者使用CT平扫和增强扫描的效果比较好,能够很好的观察分析患者的病理特征和供血情况,对患者的血管肿瘤鉴别效果比较理想,有些特殊影像特征会对诊断带来一些影响,临床中应该要引起重视。
1.6.2 TLR4、IRF3、TRAF6蛋白表达的检测
采用免疫组织化学检测法检测。取大鼠结肠组织石蜡切片,依次经脱蜡、水化、抗原修复、封闭等流程后滴加一抗:TLR4(浓度 1:50);IRF3(浓度 1:100);TRAF6(浓度 1:200),4℃冰箱过夜后滴加二抗孵育,完成PBS冲洗、DAB显色、苏木素染色、脱水等流程后封片。在光学显微镜下随机选择3~5个视野进行图像信息的采集,采用Image-Plus Pro 6.0软件对采集的图像进行分析,计算出每张切片的平均光密度值(AOD),AOD=积分光密度(IOD)/阳性目标阳性面积(Area)。
1.6.3 TRIF、IKK蛋白表达的检测
采用免疫印迹检测法检测。取大鼠结肠组织经研磨、RIPA裂解、离心取上清等流程后,采用BCA蛋白定量法测定各样本蛋白浓度,调整各样本浓度一致、变性后,经电泳,转膜后加入封闭液(5%脱脂奶粉)室温封闭 1 h,加入一抗:TRIF(浓度为 1:1000);IKK(浓度为1:2000),4℃孵育过夜,洗膜后分别加入对应的二抗,室温孵育1 h,于暗室中用X胶片感光、显影、定影。
1.7 统计学方法
采用SPSS24.0统计软件进行统计学分析。符合正态分布的计量资料用均数±标准差表示,组间比较采用单因素方差分析法;不符合正态性分布者以中位数(四分位数)[Median(P25, P75)]表示,组间比较采用非参数检验法。所有检验采用双侧检验,以α=0.05为检验水准,P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠结肠组织病理学观察结果
正常组可见结肠黏膜结构清晰,上皮组织完整,腺体排列整齐,杯状细胞清晰可见,无炎性细胞浸润,未见充血、水肿;模型组可见结肠黏膜结构不清,上皮脱落,腺体破坏,杯状细胞基本消失,黏膜及黏膜下层可见大量的炎性细胞浸润,伴有充血、水肿;隔药灸预处理组、温和灸预处理组结肠黏膜结构亦有不同程度的破坏,上皮均较为完整,腺体部分破坏,杯状细胞部分消失,黏膜及黏膜下层可见炎性细胞浸润,伴有轻度充血、水肿(图1)。
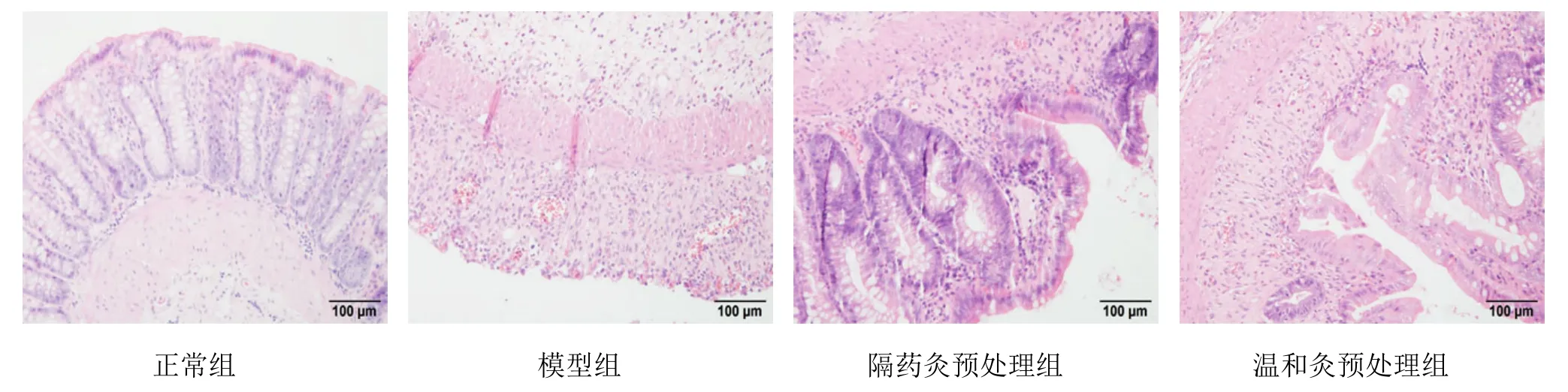
图1 大鼠结肠组织病理学检测结果
2.2 各组大鼠结肠组织TLR4免疫组化检测结果
TLR4蛋白主要表达在黏膜层、黏膜下层及固有层的胞质及胞膜中,为弥漫性棕黄色颗粒。正常组 TLR4蛋白表达较弱;模型组TLR4蛋白大量表达于黏膜层、黏膜下层及固有层的胞质及胞膜中,且染色深,分布密集;隔药灸预处理组、温和灸预处理组大鼠结肠组织TLR4蛋白在黏膜层、黏膜下层及固有层的胞质及胞膜亦有不同程度的阳性表达(图2)。定量结果表明,与正常组比较,模型组大鼠结肠组织TLR4蛋白表达显著升高,差异有统计学意义(P<0.05);与模型组比较,隔药灸预处理组、温和灸预处理组大鼠结肠组织TLR4蛋白表达均显著降低,差异均有统计学意义(P<0.05);与隔药灸预处理组比较,温和灸预处理组大鼠结肠组织TLR4蛋白表达差异无统计学意义(P>0.05)(表1)。
表1 各组大鼠结肠组织TLR4蛋白表达 (±s)
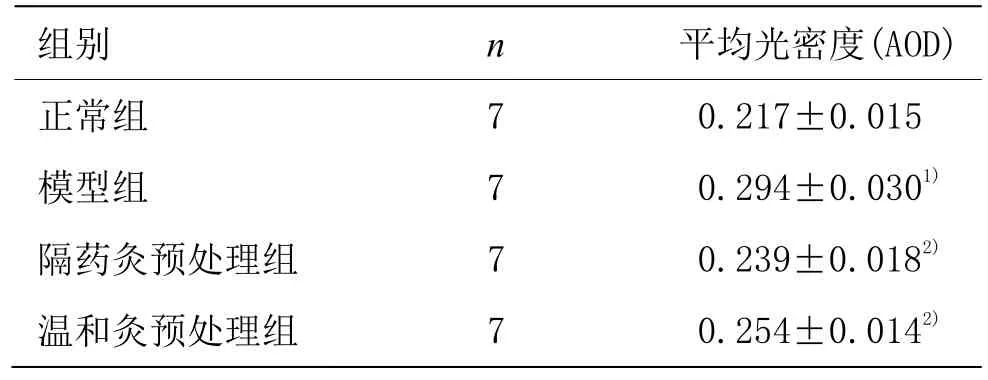
表1 各组大鼠结肠组织TLR4蛋白表达 (±s)
注:与正常组比较1)P<0.05;与模型组比较2)P<0.05
组别 n 平均光密度(AOD)正常组 7 0.217±0.015模型组 7 0.294±0.0301)隔药灸预处理组 7 0.239±0.0182)温和灸预处理组 7 0.254±0.0142)

图2 各组大鼠结肠组织TLR4免疫组化检测结果
2.3 各组大鼠结肠组织TRIF免疫印迹检测结果
表2 各组大鼠结肠组织TRIF蛋白表达 (±s)
注:与正常组比较1)P<0.05;与模型组比较2)P<0.05
组别 n 蛋白表达量(Fold change)正常组 7 0.418±0.451模型组 7 1.287±0.8631)隔药灸预处理组 7 0.529±0.5222)温和灸预处理组 7 0.522±0.2372)
与正常组比较,模型组大鼠结肠组织TRIF蛋白表达显著升高,差异有统计学意义(P<0.05);与模型组比较,隔药灸预处理组、温和灸预处理组大鼠结肠组织TRIF蛋白表达均显著降低,差异均有统计学意义(P<0.05);与隔药灸预处理组比较,温和灸预处理组大鼠结肠组织TRIF蛋白表达差异无统计学意义(P>0.05)(表2,图 3)。
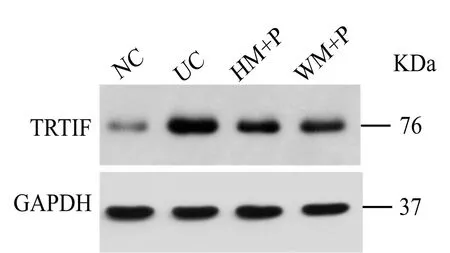
图3 各组大鼠结肠组织TRIF免疫印迹检测结果
2.4 各组大鼠结肠组织TRAF6免疫组化检测结果
TRAF6蛋白主要表达在黏膜层胞质及胞膜中,为棕黄色颗粒。正常组仅有少量TRAF6蛋白表达在黏膜层胞质及胞膜中;模型组 TRAF6蛋白大量表达于黏膜层胞质及胞膜中,部分呈胞核表达,且染色深,分布密集;隔药灸预处理组、温和灸预处理组大鼠结肠组织TRAF6蛋白大量表达在黏膜层胞质及胞膜中有不同程度的阳性表达,亦可见少量胞核表达(图4)。定量结果表明,与正常组比较,模型组大鼠结肠组织TRAF6蛋白表达显著升高,差异有统计学意义(P<0.05);与模型组比较,隔药灸预处理组、温和灸预处理组大鼠结肠组织 TRAF6的表达均显著降低,差异均有统计学意义(P<0.05),与隔药灸预处理组比较,温和灸预处理组大鼠结肠组织 TRAF6蛋白表达差异无统计学意义(P>0.05)(表 3)。
表3 各组大鼠结肠组织TRAF6蛋白表达 (±s)

表3 各组大鼠结肠组织TRAF6蛋白表达 (±s)
注:与正常组比较1)P<0.05;与模型组比较2)P<0.05
组别 n 平均光密度(AOD)正常组 7 0.223±0.018模型组 7 0.368±0.0491)隔药灸预处理组 7 0.281±0.0302)温和灸预处理组 7 0.274±0.0202)

图4 各组大鼠结肠组织TRAF6免疫组化检测结果
2.5 各组大鼠结肠组织IRF3免疫组化检测结果
IRF3蛋白主要表达在黏膜层的胞浆及胞膜中,为棕黄色颗粒。正常组IRF3蛋白均匀表达在黏膜层胞浆及胞膜中,未见胞核表达;模型组 IRF3蛋白部分表达于黏膜层胞浆及胞膜中,部分呈胞核表达,且染色深,分布密集;隔药灸预处理组、温和灸预处理组结肠组织IRF3蛋白在黏膜层胞质及胞膜中均有不同程度的表达,亦可见少量胞核表达(图 5)。定量结果表明,与正常组比较,模型组大鼠结肠组织IRF3蛋白表达显著升高,差异有统计学意义(P<0.05);与模型组比较,隔药灸预处理组、温和灸预处理组大鼠结肠组织IRF3的表达均显著降低,差异均有统计学意义(P<0.05);与隔药灸预处理组比较,温和灸预处理组大鼠结肠组织IRF3蛋白表达差异无统计学意义(P>0.05)(表4)。
表4 各组大鼠结肠组织IRF3表达 (±s)

表4 各组大鼠结肠组织IRF3表达 (±s)
注:与正常组比较1)P<0.05;与模型组比较2)P<0.05
组别 n 平均光密度(AOD)正常组 7 0.236±0.024模型组 7 0.319±0.0231)隔药灸预处理组 7 0.283±0.0242)温和灸预处理组 7 0.290±0.0252)

图5 各组大鼠结肠组织IRF3免疫组化检测结果
2.6 各组大鼠结肠组织IKK免疫印迹检测结果
与正常组比较,模型组大鼠结肠组织 IKK蛋白表达显著升高,差异有统计学意义(P<0.05)。与模型组比较,隔药灸预处理组大鼠结肠组织 IKK蛋白表达显著降低,差异有统计学意义(P<0.05);温和灸预处理组大鼠结肠组织 IKK蛋白表达虽降低,但差异无统计学意义(P>0.05)(表5,图6)。

表5 各组大鼠结肠组织IKK蛋白表达[Median(P25,P75)]
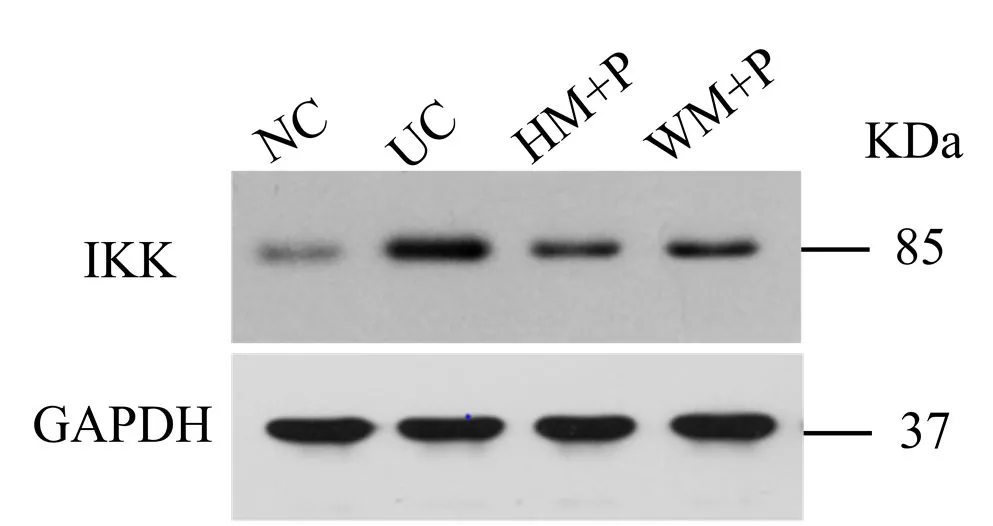
图6 各组大鼠结肠组织IKK免疫印迹检测结果
3 讨论
溃疡性结肠炎属于临床难治病,西医治疗主要采用免疫抑制剂、糖皮质激素等药物,但此类药物临床疗效不理想且反复使用后会打乱机体正常的免疫机制。作为中医药特色疗法中的一种,艾灸疗法经过数千年的更迭,仍生生不息。隔药灸疗法属于艾灸疗法的一种,通过艾火的温热之性并协同药物功效来共同发挥治疗作用[14-15];温和灸疗法因具有治疗安全、有效、无毒副反应、经济、易操作、患者依从性高等多种优点,临床应用也较为广泛[16-17]。两种艾灸疗法均是在经络理论的指导下应用于临床治疗疾病,通过刺激腧穴局部,促进腧穴局部气血的恢复,并通过经络的作用调节全身,温养脏腑,达到温经散寒、活血通络、调和阴阳的作用。天枢穴作为大肠之募穴,能疏调肠腑、理气行滞,善治肠腑疾病。古代天枢穴常应用于泄泻、痢疾、腹痛、便秘的治疗,善于健脾和胃、理气散寒补虚;现代研究发现,天枢穴用于治疗消化系统相关性疾病的比例最高,是治疗UC最常用的腧穴之一[18-20]。
艾灸治疗 UC的疗效显著,在调节机体免疫平衡,改善肠道黏膜病变,控制肠道炎症中起重要作用[21-23]。艾灸治疗UC的机制研究结果提示,艾灸可纠正结肠黏膜的病理性改变,重建人体免疫系统内环境的平衡及稳定性,调整黏蛋白比例,有效地纠正结肠黏膜病变,控制 UC肠道炎症[24-26]。艾灸预处理即“逆灸”,它以中医学“治未病”思想为主要理论基础,通过艾灸穴位激发经络之气,提高机体抗病能力,从而达到防止疾病的发生、减轻后续疾病的损害和保健延年的目的[27-29]。现代医学研究中,“针灸良性预应激假说”较好地阐释了艾灸预处理的作用机制,认为艾灸预处理的作用机制可能与现代应激学说密切相关[30]。
研究表明 TLRs最突出的生物学功能是促进细胞因子的合成与释放,引发炎症反应。TLR4是TLRs家族中研究最为广泛的一种,与UC的发生发展密切相关。TLR4C端包含一个 Toll/IL-1受体(Toll/IL-1receptor, TIR)结构域,TIR与IL-1受体家族成员具有较高的同源性,主要用来激活下游信号通路,在免疫应答的诱导和炎性反应中发挥重要作用。TRIF是和MyD88同样具有TIR结构域结构的接头蛋白,因此,本研究聚焦TLR4介导的MyD88非依赖途径开展研究,即从TLR4/TRIF通路探讨艾灸预处理干预UC的免疫机制。研究结果发现UC模型组大鼠TLR4蛋白明显升高,病理学检测结果显示模型组大鼠黏膜层有大量炎性细胞浸润,溃疡,炎症反应明显,与既往研究结果一致;而隔药灸预处理组和温和灸预处理组大鼠 TLR4蛋白明显降低,病理学检测结果显示炎性细胞浸润和溃疡面积较模型组明显减少,表明艾灸预处理参与调控TLR4蛋白的表达,且与UC炎症反应相关。TRIF在TLR4介导的MyD88非依赖途径中具有关键作用,其N末端结合结构域可与肿瘤坏死因子受体相关因子 6(TNF receptorassociated factor 6, TRAF6)结合,激活IKK复合体,活化IκB,导致NF-κB入核引起炎症反应[31-33]。本研究通过对TLR4/TRIF通路中TRAF6和IKK蛋白的观察发现,隔药灸预处理组可以降低这两种蛋白的表达,温和灸预处理组能降低TRAF6蛋白表达。以上结果提示艾灸预处理可能通过调节TLR4/TRIF通路中相关蛋白的表达,降低UC的炎症反应。
IRF3是调节Ⅰ型IFN表达的关键转录因子,能在转录水平调节Ⅰ型 IFN的分泌,在机体抵御外来微生物入侵的固有免疫中发挥重要作用。研究表明,当细胞受到炎症刺激后,IRF3可被激活并发生核转位,在核内 IRF3通过诱导目标基因的转录表达而发挥生物学效应[34]。IRF3参与了TLR4介导TRIF依赖的Ⅰ型IFN的分泌,TRIF通过招募TRAF3,调节IRF-3的活化和核转位,诱导 IFN-β的表达,引起炎症反应[35]。本研究发现模型组大鼠IRF3蛋白表达明显增加,且部分呈核表达,而隔药灸预处理组和温和灸预处理组大鼠结肠IRF3蛋白的表达量较模型组均明显减少,且仅有少量核表达,提示艾灸预处理可能通过调节 IRF-3的活化和核转位,预防了UC的发生发展进程。
综上所述,本研究观察了艾灸预处理天枢穴干预UC大鼠结肠TLR4/TRIF通路的变化,结果表明艾灸预处理可调节结肠 TLR4/TRIF通路中相关蛋白的表达,减轻UC的炎症反应,研究结果可为UC的防治提供一定的研究依据。

