脑微出血相关危险因素及对认知功能的影响
闫俊强,杜莉莉,赖小艺,李丹丹,吴剑男
脑微出血(cerebral microbleeds,CMBs)是脑内微小血管(<200 μm)破裂或血液微量渗漏所致的脑实质亚临床损害[1],血液裂解成分(含铁血黄素、铁蛋白和脱氧血红蛋白) 沉积在脑微小血管周围间隙[2],这些裂解成分在MRI梯度回波T2WI或磁敏感加权成像(susceptibility-weighted imaging,SWI)上表现为直径2~5 mm,最大可达10 mm,圆形或椭圆形,性质均一、边界清晰的低信号或信号缺失灶,T1WI、T2WI 上不表现为高信号(排除海绵状血管瘤)[3]。
CMBs在缺血性卒中的发生率为33.5%~71%,在脑出血中的发生率为50%~80%, 在健康人群中的发生率为3%~7%[4]。 CMBs的危险因素包括年龄、高血压、高血脂、淀粉样脑血管病、炎症等[5-6]。CMBs逐渐被认为是脑小血管疾病的重要表现,且与认知功能障碍密切相关,是主要的小血管性认知障碍类型。本研究通过分析研究对象一般资料、生化检测指标以及蒙特利尔量表评分(montreal cognitive assessment,MoCA),研究CMBs发生和认知功能下降的危险因素,为预防CMBs的发生、发展及认知功能损害提供临床参考。
1 资料与方法
1.1 研究对象收集2017年10月至2018年6月河南科技大学第一附属医院神经内科住院及门诊磁共振检查脑微出血患者93例为观察组,磁共振检查正常者90例为对照组。排除标准:① SWI或部分检查指标缺失;②既往存在精神异常或有认知功能障碍者;③有急性的短暂性脑缺血发作(transient ischemic attacks,TIA)、脑梗死、血液系统疾病和其他影响出血的脑部疾病;④因听力下降、失语或失认而影响表达者;⑤拒绝参与本次研究者。患者或家属签署知情同意书,本研究获本院伦理委员会批准。
1.2 记录一般资料性别、年龄、受教育程度、吸烟史、饮酒史、冠心病、糖尿病、高血压病、高脂血症、颈动脉斑块及既往脑血管病史。抽取入院第二天清晨空腹的肘静脉血,送本院实验室完成血常规、高敏C反应蛋白(high sensitivity c-reactive protein,HCRP)、同型半胱氨酸(homocysteine,HCY)、血生化、血凝、血糖(glucose,GLU)、糖化、尿酸、血脂、磷脂酶A2等相关指标的检查并收集数据。以本院的正常值作为标准。
1.3 认知功能评估采用MoCA量表评分,该量表是由加拿大Charles Le Moyne医院神经科临床研究中心Nasreddine等根据临床经验并参考MMSE的认知项目设置和评分标准而修订[7]。由受过专业训练的临床医师独立完成量表评价,总分<26分认为存在认知功能损害,受教育年限≤12 a者总分加1分,得分越高,说明认知功能越好。MoCA包括视空间及执行功能(5分)、命名(3分)、记忆(5分)、注意(3分)、语言(3分)、抽象思维(2分)、计算(3分)、定向(6分)8个认知领域。
1.4 影像学评估采用美国GE公司超导型3.0 T磁共振头颅T1WI、T2WI、磁敏感加权成像,由2位神经病学影像学专家对影像资料进行盲评,双方意见不一致时通过协商达到统一意见,最后再让放射科主任医师进行审核,增加结果的可靠性。
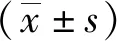
2 结果
2.1 基本资料及病史两组年龄、性别、教育程度、吸烟史、饮酒史、糖尿病、冠心病、高脂血症、是否合并白质高信号等比较差异无统计学意义(P>0.05),而高血压比较差异有统计学意义(P<0.05),见表1。
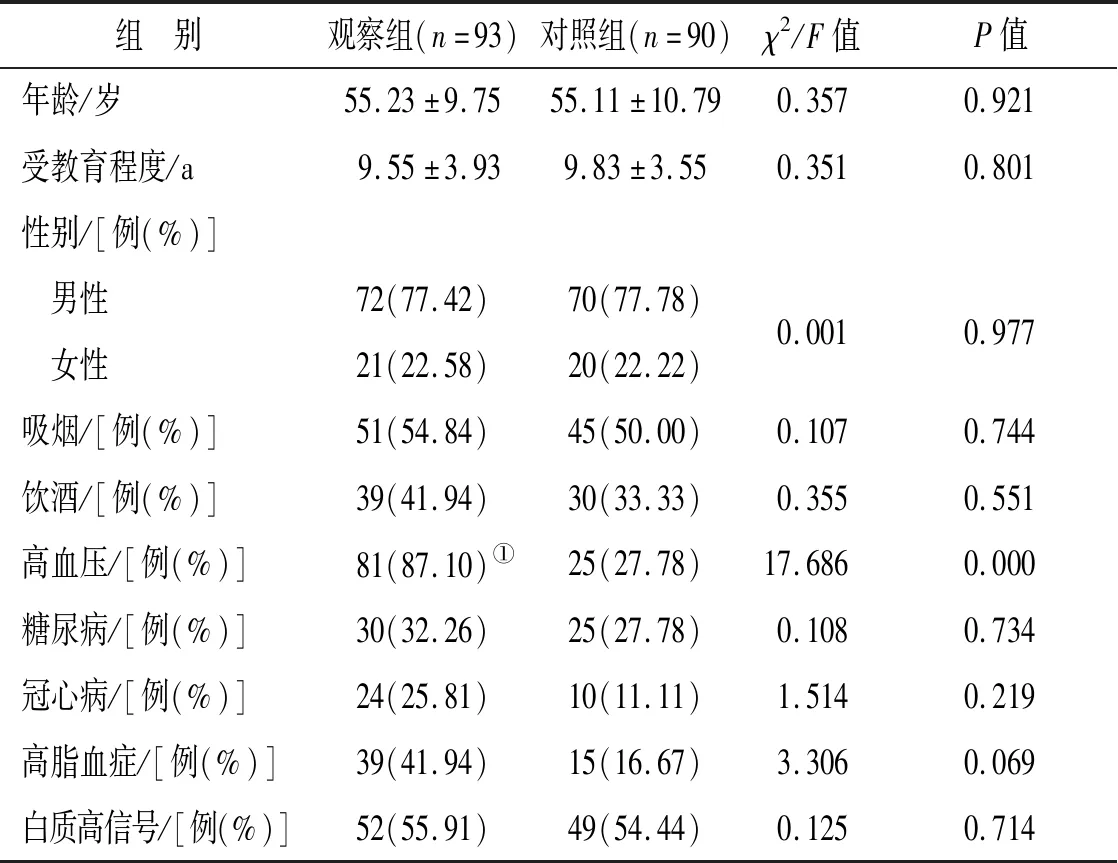
表1 脑微出血组与对照组一般资料比较
注:①与对照组比较,P<0.05。
2.2 两组MoCA评分比较两组MoCA评分中计算、语言重复方面比较,差异无统计学意义(P>0.05)。而观察组MoCA总分及执行功能、命名、记忆、注意力、语言流畅、抽象思维、定向力评分均低于对照组,差异有统计学意义(P<0.05),见表2。
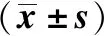
表2 两组MoCA总分及各认知域评分比较
注:①与对照组比较,P<0.05。
2.3 两组血清生化指标分析观察组患者中性粒细胞计数(neutrophil,NEU)、中性/淋巴细胞比值(neutrophil tolymphocyte ratio,NLR)、低密度脂蛋白(low density lipoprotein,LDL-C)、β2微球蛋白(β2microglobulin,BMG)、纤维蛋白原(fibrinogen,FIB)、HCPR、HCY均明显大于对照组,但血小板计数(blood platelet,PLT)计数明显低于对照组,差异有统计学意义(P<0.05)(见表3)。将单因素分析结果中有统计学意义的变量纳入Logistic回归分析结果显示:高血压 (OR=3.512, 95%CI:1.313-8.698)、NLR (OR=1.372, 95%CI:1.056-1.845)与 CMBs 独立相关,见表4。
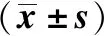
表3 两组血清生化指标分析
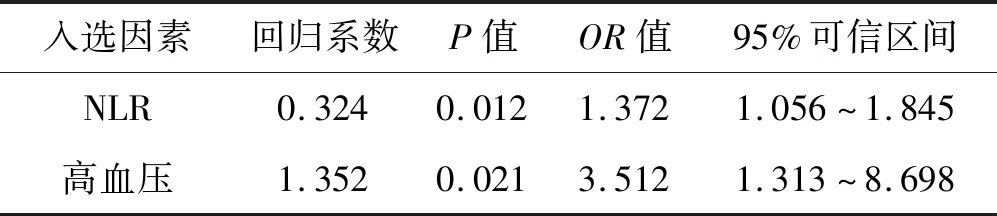
表4 两组危险因素多因素Logistic回归
2.4 观察组认知功能损害危险因素相关性分析以观察组患者的MoCA评分为变量,与各种危险因素进行相关性分析,连续变量采用Person相关性分析,二分类变量采用Spearman相关性分析。结果显示:年龄、HCRP、HCY、GLU 、FIB、TBA与MoCA评分呈负相关(P<0.05),提示随着年龄、HCRP、HCY、GLU 、FIB、总胆汁酸(total bile acid,TBA)升高,认知下降越明显;受教育程度、胆碱酯酶(cholineterase,CHE)与MoCA呈正相关(P<0.05),提示较高的受教育程度和CHE可能是认知下降的保护因素。见表5。
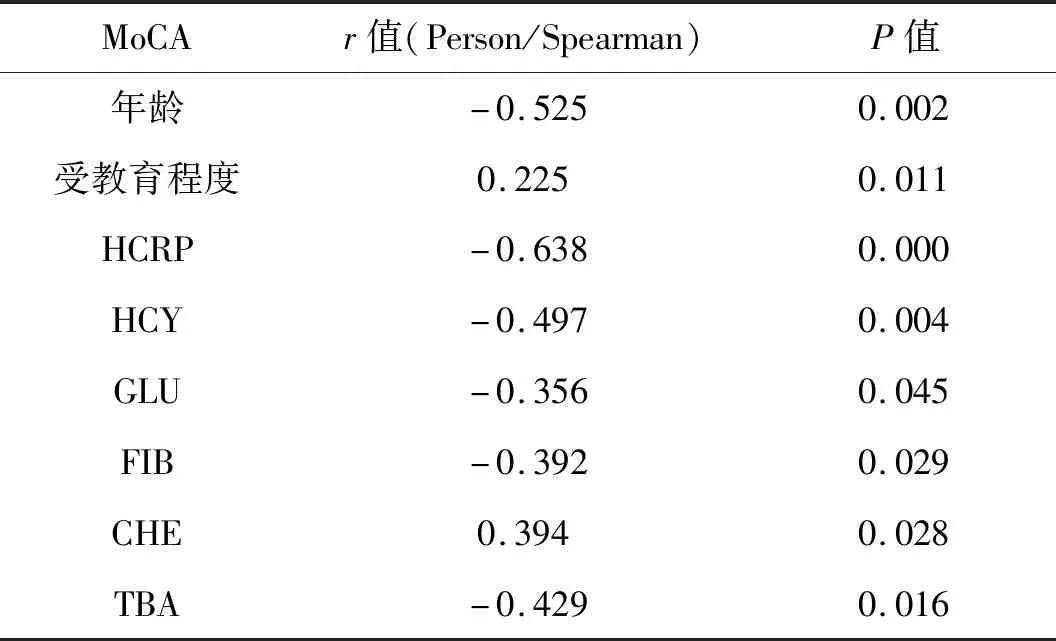
表5 观察组认知功能损害的危险因素相关性分析
3 讨论
CMBs的危险因素众多,高血压是CMBs的独立危险因素,其机制可能是长期高血压可造成脑内小动脉脂质玻璃样变性,血管平滑肌被纤维组织或坏死组织取代,继而导致血管破裂形成 CMBs。研究显示高血压会增加脑深部及幕下CMBs的发生率[8-9]。血压变异度是脑深部及幕下CMBs的独立危险因素,这可能是由于脑深部及幕下的穿支动脉直接由大动脉发出,比脑叶的皮层动脉更容易受到血压波动的影响[10]。高血压引发 CMBs 的概率与年龄、高血压病程及级别密切相关[11],对于大于 45 岁、病程 5 a以上、2 级以上高血压的患者应引起足够重视。本研究发现:观察组高血压病史的比例高于对照组,单因素分析及多因素 Logistic 回归分析均有统计学意义,也证明高血压为 CMBs的独立危险因素。
炎性反应是CMBs的发病机制之一,其中IL-6、HCRP是炎性反应中起着重要作用的介质,且与脑小血管病及CMBs密切相关[12]。研究发现老年人的毛细血管周围沉积有含铁血黄素,含铁血黄素经外渗到扩大的血管间隙,进一步促进炎症反应,并导致腔隙梗死形成,这一发现在某种程度上支持炎性过程是脑小血管病和CMBs 的发病机制[13]。近年来,NLR因其整合了白细胞的两种亚型,被认为是新型稳定有效的炎症标志物,可综合反映免疫炎症状态[14]。目前临床研究证实,NLR与脑血管病(如脑梗死、脑出血、颅内动脉瘤等)的发生、严重程度及预后相关[15-16]。本研究发现:两组间NLR差异有统计学意义,且NLR为CMBs独立的危险因素,与上述研究结果相符。但本研究不足之处在于样本量较少,可能还需要大量资料进一步证实。
本研究发现观察组患者NEU、LDL-C、BMG、FIB、HCRP、HCY均明显高于对照组,但PLT明显低于对照组,差异有统计学意义,因此,考虑上述因素可能与CMBs有关。积极控制上述危险因素对预防脑微出血有重要意义。
关于CMBs与认知功能之间的关系,是近年来研究的热点,研究发现,认知功能障碍与CMBs有显著的相关性[17]。CMBs可造成客观和主观认知能力下降,同时可能通过阻断额叶—基底节之间的联系来增加认知损害风险。本研究比较观察组和对照组MoCA 总分及各认知域评分,结果发现观察组患者存在明显的认知功能障碍,主要表现在执行功能、命名、注意力、记忆、语言流畅、抽象思维、定向力方面评分下降。提示CMBs是引起认知功能损害的一个重要因素。然而,CMBs可发生于大脑的不同部位,如大脑皮层、皮层下白质区、丘脑、基底节、胼胝体白质、小脑和脑干等,对于CMBs发生的不同区域对认知功能的影响仍需深入研究。对CMBs患者的MoCA评分进行Spearman/Person双变量相关性分析,发现认知功能下降程度随着年龄、HCRP、HCY、GLU 、FIB、TBA的升高而加重,随着受教育程度的增加、CHE升高,其风险下降。
综上所述, CMBs可导致患者认知功能障碍,高血压、NLR是CMBs的独立危险因素。随着年龄、HCRP、HCY、GLU 、FIB、TBA升高CMBs 患者易发生认知功能障碍,而较高的受教育程度及CHE升高是认知损害的保护因素。因此,在临床实践中,临床医生对CMBs的危险因素应进行早干预、对于可能存在认知功能障碍的患者及时给予磁共振SWI检测并用MoCA量表评估,防止出现明显的认知功能障碍。

