疫苗用原辅料中猪源性病毒PCR检测方法的建立
谷海燕,律苗,丁玲,马萌,张楠,李拓,李娜
疫苗用原辅料中猪源性病毒PCR检测方法的建立
谷海燕,律苗,丁玲,马萌,张楠,李拓,李娜
100176 北京生物制品研究所有限责任公司质量检定室(谷海燕、律苗、丁玲、马萌、李拓、李娜),疫苗 5 室(张楠)
猪源性病毒是一类广泛寄生于猪体内的病毒,其不只感染猪,对人和多种哺乳动物也能造成感染,并可能致病[1-2]。2015 版《中国药典》要求[3],制备疫苗用的动物细胞需要检测猪源性病毒为阴性。目前生物制品中越来越多涉及到猪来源的原料或辅料,如疫苗生产中使用的胰蛋白酶和水解乳蛋白及明胶等。虽然目前法规并未将猪源性病毒纳入原辅料质控,但是一些猪来源原辅料有携带猪源性病毒的风险,其中包括猪圆环病毒 1(porcine circovirus 1,PCV1)、猪圆环病毒 2(porcine circovirus 2,PCV2)及猪细小病毒(porcine parvovirus,PPV)。确保生产用原辅料不携带猪源性病毒是生产出合格疫苗产品的保证,因此质控原辅料中猪源性病毒至关重要。
1 材料与方法
1.1 材料
1.1.1 病毒、细菌、质粒、胰蛋白酶及水解乳蛋白 大肠杆菌(批号:2017053104-3)、金黄色葡萄球菌(批号:2017053104-3)、麻疹病毒标准品(批号:20150902213)、风疹病毒标准品(批号:2015S0401)及所有标准菌毒株均购自中国食品药品检定研究院;水解乳蛋白(批号:1833902)和胰蛋白酶(批号:C01171008)均购自美国 Gibco 公司。PCV1、PCV2、PPV 阳性质粒由生工生物工程(上海)股份有限公司合成构建。
1.1.2 主要试剂及仪器 胰蛋白酶和酵母提取物购自美国 Oxid 公司;Taq DNA 聚合酶购自日本 Takara 公司;DNA marker、Gel-red、病毒 DNA/RNA 提取试剂盒、质粒小提试剂盒均购自天根生化科技有限公司;琼脂糖和氯化钠购自国药化学试剂有限公司;PCR 仪、电泳仪、凝胶成像系统为美国 Bio-Rad 公司设备。
1.2 方法
1.2.1 基因组合成 根据 GenBank 中的登录号,PCV1(GenBank:AY193712.1)合成其 929 ~ 1655 bp 位点核酸序列,PCV2(GenBank:AY181946.1)合成其 1151 ~1584 bp 位点核酸序列,PPV(NC:001718)合成其 3001 ~ 3531 bp 位点核酸序列,合成的序列构入 pUC57 载体,并转化 top10 感受态细胞,由生工生物工程(上海)股份有限公司完成。
1.2.2 阳性模板 分别取 10 μl 3 种菌液,涂布于 Amp 抗性的 LB 平板,37 ℃过夜培养,挑取单克隆菌落,接种于 LB 液体培养基,220 r/min、37 ℃培养 16 h 后收集菌体,利用质粒小提试剂盒对菌体中质粒进行提取,检测浓度和纯度后作为实验用阳性对照模板。
1.2.3 引物设计及合成 利用文献[4]报道的猪源性病毒检测引物,由生工生物工程(上海)股份有限公司合成,合成后的引物稀释成 10 μmol/L 备用,设计引物如表 1所示。

表 1 引物信息
1.2.4 PCR 反应条件优化 PCR 反应体系为:阳性模板 2.5 μl,上游引物(10 μmol/L)1.25 μl,下游引物(10 μmol/L)1.25 μl,Ex Taq 0.25 μl,dNTPs(2.5 mmol/L)2 μl,10 × Buffer 2.5 μl,灭菌水补至 25 μl。将体系放入 PCR 仪,反应条件为:94 ℃预变性 4 min,95 ℃变性 30 s,(50 ~ 64 ℃)退火 30 s,72 ℃延伸 1 min,72 ℃延伸最后一次 10 min,4 ℃保温。在 PCR 退火温度设置中,设置了 50 ~ 64 ℃8 个退火温度,PCR 完成后取 5 μl 样品进行凝胶电泳分析,确定其最佳退火条件。
1.2.5 方法验证[5-8]
1.2.5.1 中间精密度 由两名实验人员分别进行,时间间隔 24 h,连续 5 d 检测同一阳性样品 5 次,评价此方法检测原辅料中猪源性病毒的中间精密度。
1.2.5.2 专属性验证 分别取阳性样品、大肠杆菌标准品、金黄色葡萄球菌标准品、麻疹病毒标准品、风疹病毒标准品及无菌水,编号为 1 ~ 6,对 6 个样品分别利用 3 对引物进行 PCR 检测,验证实验室常见的微生物,验证此方法对 PCV、PPV 检测的专属性。
1.2.5.3 检测限验证 将提取的质粒浓度调整为 1 ng/μl,再用无菌水将质粒进行 10 倍梯度稀释,对稀释后的质粒进行 PCR 检测,验证此方法对猪源性病毒的最低检测限度。
1.2.5.4 重复性验证 同时取阳性样品 6 份,在相同的测量环境下,对 6 份样品进行 PCR检测。验证此方法对原辅料中猪源性病毒检测的重复性。
1.2.5.5 耐用性验证 取 2 份阳性样品,在相同的环境下配制反应体系,然后将反应体系分别在室温放置 15、30 min后进行 PCR 检测。验证在日常工作中室温对体系耐用性造成的影响。
1.2.6 样品检测 取一批供试品胰蛋白酶及两批水解乳蛋白,溶解后利用病毒基因组提取试剂盒,按照说明书提取病毒基因组 DNA,再进行 PCR、电泳后凝胶成像,进行 PCV1、PCV2 及 PPV 检测。
2 结果
2.1 PCR 反应条件优化
实验结果表明,在引物浓度为 10 µmol/L 时候,PCR 扩增效果很好。在 PCV1 和 PPV 实验组中设置了 50 ~57 ℃的退火温度范围,实验表明,在 54 ℃退火 30 s 时,PCR 扩增效果最佳,扩增条带明亮清晰,条带特异。在 PCV2 实验组中首先设置了 50 ~ 57 ℃退火温度范围,结果无特异条带产生,将退火温度提高至 64 ℃时,产生特异条带,PCR 扩增结果见图 1。
2.2 中间精密度
经过 2 名实验员每次间隔 24 h,连续 5 d 对 3 种阳性对照连续进行 PCR 检测,均在目标区域产生特异性条带,中间精密度验证结果良好,结果如表 2 所示。
2.3 专属性验证
为了验证该方法是否容易被实验室常见的微生物污染,选用大肠杆菌、金黄色葡萄球菌、风疹病毒、麻疹病毒作为 PCR 模板,利用优化的反应条件,进行 PCR 检测。结果表明,选择的引物对实验室常见的核酸模板不具有特异性,其专属性良好(图 2)。
2.4 检测限验证
对稀释后的阳性样品进行 PCR 检测,验证此方法对猪源性病毒的最低检测限度。结果如图 3 所示,在阳性质粒稀释度为 100 fg/μl 时仍可检测出。
2.5 重复性验证
为了验证 PCR 检测原辅料中猪源性病毒的重复性,在同一条件下,取同一阳性样品分为 6 份,对 6 份样品在相同的条件下进行 PCR 检测。结果表明,6 次检测均能在特异大小区域得到特异的条带,该方法重复性较好,试验结果如表 3 所示。
2.6 耐用性验证
为了验证 PCR 体系的耐用性,将配置好的 PCR 反应体系分别在室温放置 15 和 30 min,然后进行 PCR 检测。结果表明,在放置 30 min 后,该反应体系依然能很好检测出特异的目标条带,结果如图 4 所示。
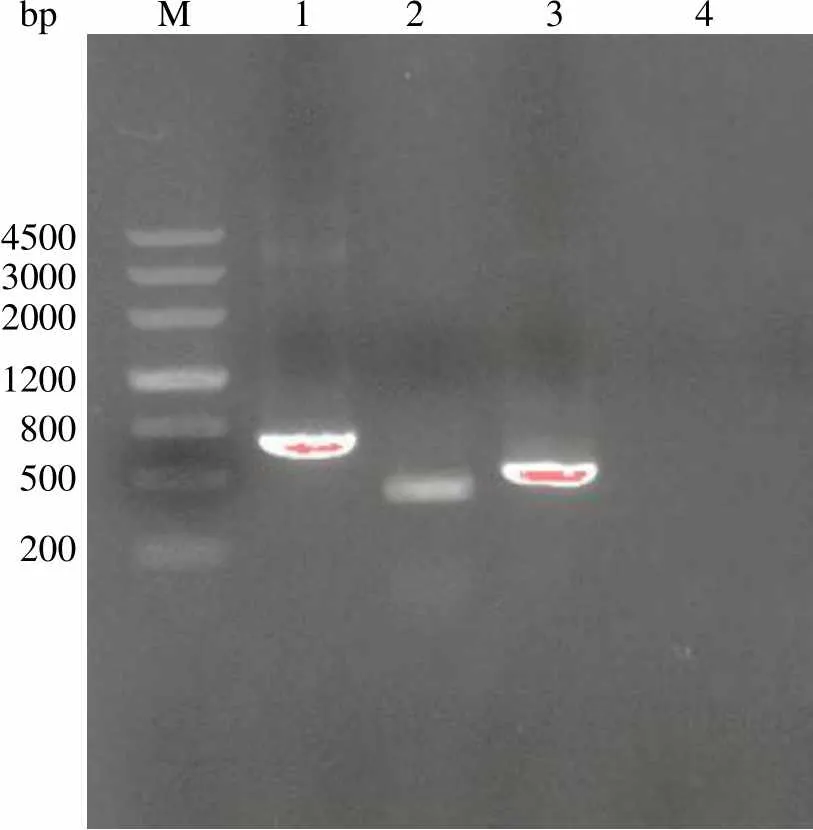
bp M 1 2 3 4 4500300020001200800500 200
表 2 方法验证的中间精密度结果

bp M 1 2 3 4 5 6 7 8 4500300020001200800500200
2.7 样品检测结果
取一批供试品胰酶及两批水解乳蛋白,样品溶解后使用试剂盒提取病毒基因组 DNA,再运用 PCR 对其进行 PCV1、PCV2 及 PPV 检测,电泳后凝胶成像结果如图 5 所示,两批样品中 PCV1、PCV2 及 PPV 都呈阴性。

bp M 1 2 3 4 5 6 7 8 9 10 11 12 13 4500300020001200800500 200

表 3 重复性验证结果
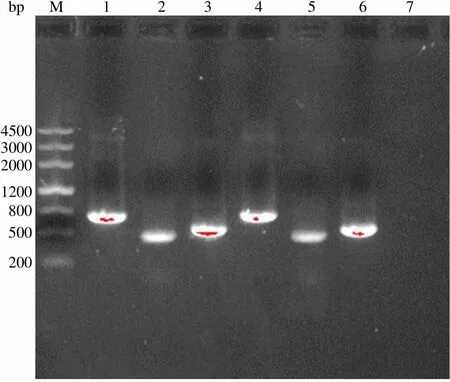
bp M 1 2 3 4 5 6 7 4500300020001200800500200

bp M 1 2 3 4 5 M 6 7 8 9 10 M 11 12 13 14 15 20001000750500200100
M:DNA marker;1:PCV1 阳性;2:水解乳蛋白 1 PCV1 检测;3:水解乳蛋白 2 PCV1 检测;4:胰酶 PCV1 检测;5:PCV1 阴性对照;6:PCV2 阳性;7:水解乳蛋白 1 PCV2 检测;8:水解乳蛋白 2 PCV2 检测;9:胰酶 PCV2 检测;10:PCV2 阴性对照;11:PPV 阳性;12:水解乳蛋白 1 PPV 检测;13:水解乳蛋白 2 PPV 检测;14:胰酶 PPV 检测;15:PPV 阴性对照
图 5 PCR 检测 3 批样品 PCV1、PCV2、PPV 结果
3 讨论
随着生物技术的不断发展以及对生物制品认识越来越全面,人们对生物制品质量控制的要求越来越高,要求我们对生物制品中的有效成分及杂质含量能够充分了解,并评估杂质存在可能造成的影响。2010 年科学家 Victoria 等[9]利用基因组学技术发现某疫苗中含有 PCV1 病毒基因组序列,随后其他生物制品中发现猪源性病毒污染。人用生物制品中外源病毒成为了各国药监部门关注的焦点,也使得生物制品在外源因子质量控制方面向前迈进一步。本文利用合成病毒基因作为阳性对照模板[4],验证 PCR 法检测疫苗用原辅料中猪源性病毒,分别从中间精密度、专属性、检测限、重复性和耐用性 5 个方面来验证该方法检测 PCV1、PCV2 及 PPV的可行性。结果达到预期,PCR 法可用于疫苗用原辅料中猪源性病毒检测。
猪源性病毒实验室检测方法众多,传统检测有酶联免疫吸附试验、巢式 PCR 法、实时定量 PCR 法、环介导恒温扩增法、基因芯片等一系列方法[10]。其中荧光定量 PCR 检测猪源性病毒灵敏度更高,但是荧光定量 PCR 法存在一些缺点,如成本高、技术要求高、极易出现假阳性等。对疫苗生产企业来说需要选择一种灵敏度适合、特异性好、费用更低、操作更简便、检验结果更稳定的方法。本研究验证的 PCR 法检测疫苗用原辅料中猪源性病毒具有高效、省时的优点,灵敏度和特异性也能达到我们的需求,可用于疫苗用原辅料中猪源性病毒快速检测。
[1] Allan G, Krakowka S, Ellis J, et al. Discovery and evolving history of two genetically related but phenotypically different viruses, porcine circoviruses 1 and 2. Virus Res, 2012, 164(1-2):4-9.
[2] Sun SY, Wu D. Porcine parvovirus disease and research progress. Chin J Prev Vet Med, 2000, 22(s1):214-215. (in Chinese)
孙绍元, 吴丹. 猪细小病毒病及研究进展. 中国预防兽医学报, 2000, 22(s1):214-215.
[3] Chinese Pharmacopoeia Commission. Pharmacopoeia of the People’s Republic of China. Volume 3, 2015. Beijing: China Medical Science Press, 2015. (in Chinese)
国家药典委员会. 中华人民共和国药典. 2015年版三部. 北京: 中国医药科技出版社, 2015.
[4] Huang M, Lv BL, Yuan LY, et al. Development and verification of a PCR assay for porcine circovirus in live attenuated Japanese encephalitis vaccine. Chin J Biol, 2016, 29(12):1346-1348, 1354. (in Chinese)
黄敏, 吕冰凌, 袁良玉, 等. 乙型脑炎减毒活疫苗中猪圆环病毒PCR检测方法的建立及验证. 中国生物制品学杂志, 2016, 29(12): 1346-1348, 1354.
[5] Qian XL, Ren FF, Song CH, et al. Development and verification of a PCR assay for porcine circovirus in vaccines for human use and cells used for production. Chin J Biol, 2018, 31(5):543-546, 551. (in Chinese)
钱兴丽, 任芳芳, 宋彩花, 等. 人用疫苗及生产用细胞中猪圆环病毒PCR检测方法的建立及验证. 中国生物制品学杂志, 2018, 31(5): 543-546, 551.
[6] Han Y, Guo ZL, Li W, et al. The study of verification of the qualitative method for GMO foods. J Inspection Quarantine, 2017, 27(1):5-9. (in Chinese)
韩玥, 郭铮蕾, 李伟, 等. 食品转基因定性检测的方法验证研究. 检验检疫学刊, 2017, 27(1):5-9.
[7] Jiang LL, Wang XL, Wang HL, et al. Discussion of the performance verification procedures of the real-time quantitative polymerase chain reaction for determination of virus nucleic acid. J Mol Diagn Ther, 2012, 4(5):321-325. (in Chinese)
蒋玲丽, 王雪亮, 王华梁, 等. 实时荧光定量PCR检测病毒核酸方法学性能验证程序的探讨. 分子诊断与治疗杂志, 2012, 4(5):321- 325.
[8] Wang J, Lv BL, Meng L, et al. Method of loop mediated thermostatic amplification (LAMP) for detection of mycobacteria in Japanese encephalitis attenuated live vaccine was established//Proceedings of the 2013 China biological products annual conference and the 13th national symposium on biological products. Shanghai, 2013:185-189. (in Chinese)
王静, 吕冰凌, 孟丽, 等. 乙型脑炎减毒活疫苗质控中建立环介导恒温扩增法(LAMP)检测分枝杆菌//2013中国生物制品年会暨第十三次全国生物制品学术研讨会论文集. 上海, 2013:185-189.
[9] Victoria JG, Wang C, Jones MS, et al. Viral nucleic acids in live-attenuated vaccines: detection of minority variants and an adventitious virus. J Virol, 2010, 84(12):6033-6040.
[10] Mcclenahan SD, Krause PR, Uhlenhaut C. MolecuLar and infectivity studies of porcine circovirus in vaccines. Vaccine, 2011, 29(29-30): 4745-4753.
“重大新药创制”国家科技重大专项(2018ZX09738003)
李娜,Email:115735267@qq.com
2019-03-20
10.3969/j.issn.1673-713X.2019.04.016
——一道江苏高考题的奥秘解读和拓展

