重组人源超氧化物歧化酶研究进展
李星论,巩婷,陈晶晶,陈天娇,乔云明,杨金玲,朱平
重组人源超氧化物歧化酶研究进展
李星论,巩婷,陈晶晶,陈天娇,乔云明,杨金玲,朱平
100050 北京,中国医学科学院北京协和医学院天然药物活性物质与功能国家重点实验室/国家卫健委天然药物生物合成重点实验室<
超氧化物歧化酶(superoxide dismutase,SOD)是动物、植物和微生物中普遍存在的一类酶,是生物抗氧化系统的第一道防线,也是体内唯一能够特异性清除氧自由基的抗氧化酶。SOD 为金属酶,按其结合的金属离子种类不同,目前已知的 SOD 主要分为三类,即 Cu/Zn-SOD(SOD1)、Mn-SOD(SOD2)和 Fe-SOD(SOD3)[1]。人体内外源化合物在各种酶的作用下会产生氧自由基,氧自由基在 SOD 的催化作用下转变为过氧化氢,体内的过氧化氢酶(CAT)和过氧化物酶(POD)会立即将其分解为完全无害的水(图 1)。当生物体没有足够多的 SOD 时,活性氧将会大量累积,如不能及时清除就会引发氧化损伤,导致机体损害,比如碱基突变、DNA 链断裂、膜脂过氧化和蛋白质损伤等,从而加速衰老或导致疾病[2]。除了抗氧化作用外,SOD 还具有抗炎[3]、抗肿瘤[4]及调控免疫[5]等重要作用,并且在免疫防御中起杀死病毒的作用[6]。SOD 具有广泛的医疗价值,临床上可用 SOD 治疗和预防急性炎症和水肿、氧中毒、肺气肿、辐射病、老年性白内障及衰老等。此外,SOD 还可以作为食品和化妆品的添加剂。
国外主要从牛羊等动物的血液中提取SOD,国内主要从猪的血液中提取 SOD[7]。动物来源的 SOD 存在与人交叉感染、过敏性反应等不良现象。此外,因为疯牛病等致病因子的传播,从动物血液中提取SOD 的安全性受到严重质疑。欧盟于 1999 年已禁止将动物来源的 SOD 用于人类医疗和保健。但因为从动物血液中提取 SOD 成本低、工艺简单,至今无法全面禁止[8]。天然 SOD 在应用方面有其局限性:①半衰期短(5 ~ 10 min),代谢迅速[9];②异源性——由于天然 SOD 的制剂多来源于动物或微生物,对人体来说存在免疫原性问题[10];③不易透皮或透膜,吸收困难。天然 SOD 属于大分子蛋白,在细胞膜上没有专一受体,难以迅速进入细胞内发挥作用[11]。多年来人们一直不断尝试各种方法来获取 SOD 并改造其结构和性质,从而拓展其应用范围。常用的方法有化学修饰法[12]、SOD 模拟化合物[13]和基因工程法[14]等,其中通过基因工程技术获取和改造 SOD 的相关研究发展尤为迅速。1983 年,Sherman 等[15]首次克隆得到人源 Cu/Zn-SOD(hCu/Zn-SOD)的 cDNA 序列,为通过基因工程获取和改造 SOD 奠定了基础。近年来,科
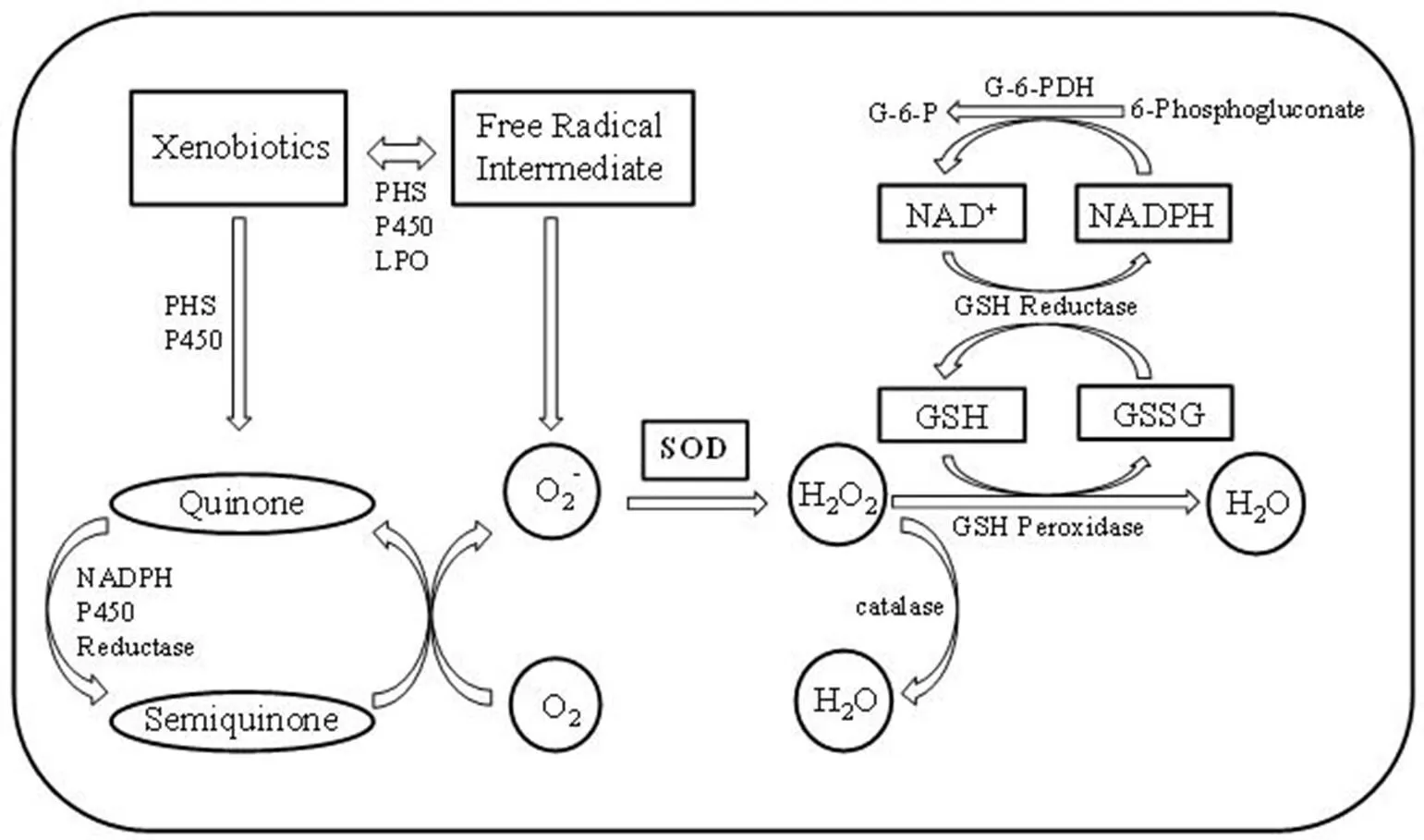
图 1 SOD 的作用机制(GSH:还原型谷胱甘肽;GSSG:氧化型谷胱甘肽;PHS:前列腺素合成酶;LPO:脂质过氧化物;NAD+:辅酶 I;NADPH:还原型辅酶 II;G-6-P:6-磷酸葡萄糖;G-6-PDH:6-葡萄糖磷酸脱氢酶;6-phosphogluconate:6-磷酸葡萄糖酸酯)学家们通过基因工程技术,并结合细胞工程、酶工程、蛋白质工程和微生物工程等技术,大大推动了重组 SOD 在医药领域的应用。目前,基因工程在工业化生产 SOD 中的地位愈发重要,与化学修饰法和 SOD 模拟化合物方法相比,基因工程广开酶源,潜力巨大,是降低 SOD 生产成本和获得无抗原性人源 SOD 的有效途径[16]。
目前,关于 SOD 的综述有很多,研究者们分别从 SOD 的来源、分类、功能和催化机理等方面进行了总结,并列举了 SOD 在医学、农业、化妆品和食品开发等方面的应用现状及前景[16]。本文重点综述了重组人源 SOD 的研究策略与进展,以期为 SOD 的理论研究与实际应用提供参考。
1 表达系统的选择
选择合适的表达系统是决定重组人源 SOD 高效表达的重要因素(表 1)。在选择蛋白表达系统时,需要考虑的主要因素是蛋白活性、可溶性、得率及培养周期等。
1.1 大肠杆菌表达系统
在各种表达系统中,最早开展研究的是大肠杆菌表达系统,它也是目前最成熟的表达系统。大肠杆菌表达系统具有遗传背景清楚、表达量高、繁殖快、成本低、稳定性好、抗污染能力强和产物容易纯化等优点[17]。张弘浩等[18]将人源 SOD 基因导入大肠杆菌,得到包涵体形式的重组蛋白,经过尿素处理、透析,重组蛋白由包涵体转化为可溶性蛋白。研究指出 Cu2+、Zn2+的加入对于恢复 SOD 的活性和稳定性是必不可少的,且适当提高温度将大大缩短复性时间,获得的重组人源 SOD 比活力可达到 6000 U/mg 以上。Zhu 等[19]克隆了人源胞外超氧化物歧化酶(human extracellular superoxide dismutase,hEC-SOD)的 cDNA,并在大肠杆菌中进行了重组表达,得到包涵体形式的重组蛋白。通过尿素处理获得可溶性蛋白,并通过固定化金属亲和层析柱对重组 hEC-SOD 进行逐步复性,得到了正确折叠的二聚体蛋白和单体蛋白,两种蛋白的比活力分别为 3475 U/mg 和 510 U/mg,二聚体的活性明显高于单体。
大肠杆菌表达系统虽有许多优点,但存在蛋白不能正确折叠、易形成包涵体、密码子体系与真核生物差别较大、翻译后修饰不完善和内毒素等应用瓶颈。
1.2 酵母表达系统
酵母表达系统可高水平表达蛋白,并具有翻译后修饰功能,兼具原核与真核表达系统的优点,因此在基因工程领域中得到日益广泛的应用。其中甲醇酵母表达系统是目前应用最广泛的酵母表达系统,并以毕赤酵母应用最多。酿酒酵母分泌外源蛋白效率低,且大规模发酵时产生的乙醇会影响菌体自身生长,因此难以进行高密度发酵[20]。林士森等[21]将 hEC-SOD 在毕赤酵母中表达,从上清液中获得重组蛋白,经纯化后测得重组蛋白的比活力为 1700 U/mg。郑屹峰等[22]以表达 hCu/Zn-SOD 的重组毕赤酵母为出发菌株,采用甲醇-甘油混合饲喂的方法进行 5 L 发酵罐高密度发酵培养,最终获得的重组 hCu/Zn-SOD 比活力达到 13 539 U/ml。毕赤酵母表达体系表达的重组蛋白能够直接分泌至胞外,故有利于工业化分离与纯化,其表达的蛋白能够形成二硫键、进行糖基化修饰等,且表达量高[23]。然而,毕赤酵母表达体系不足之处在于使用甲醇作为诱导剂,具有一定危害,且糖基化与哺乳动物细胞有所不同。
1.3 植物表达系统
植物表达系统能够表达来自病毒、细菌和动物等的蛋白,易于大规模培养与生产,在基因表达及修饰方面也有独特的优势。目前已在烟草、水稻、红花和马铃薯等植物中实现了许多外源蛋白的表达[24]。由于烟草具有生物产量高、转化简单、不进入食物链及生物安全风险小等优势,因此成为目前发展最成熟的植物表达体系。Park 等[25]通过植物瞬时表达系统在烟草叶细胞中表达出具有催化活性的重组hEC-SOD,为植物表达系统生产重组 SOD 开启了新的大门。但由于利用植物表达生产外源蛋白相关技术起步较晚,部分技术并非特别成熟,因此目前利用植物系统生产目的蛋白与其他系统相比尚不具备竞争力[26]。
1.4 昆虫细胞表达系统
20 世纪 80 年代起,以杆状病毒为载体的外源基因表达体系日趋成熟,极大促进了昆虫细胞表达系统的发展。昆虫细胞表达系统既能表达原核基因也能表达真核基因,并兼具了原核表达系统产量高和真核表达系统蛋白翻译后修饰的优点。昆虫细胞表达载体采用了昆虫核型多角体病毒(multiple nuclear polyhedrosis virus,MNPV)中多角体蛋白基因(polyhedrin gene,phg)的强启动子,可以实现很多真核蛋白的有效表达。常用的宿主细胞则来源于草地贪夜蛾的 Sf-9 和 Sf-21 细胞系[27]。范立强等[28]将 hEC-SOD 基因插入昆虫杆状病毒供体质粒 pFastBacHTb 中,再将其转染粉纹夜蛾细胞 Tn-5B1-4,SDS-PAGE 和 Western blot 结果显示 hEC-SOD 在粉纹夜蛾细胞中成功表达,其细胞裂解物中的hEC-SOD比活力为 260 U/mg。Shrestha 等[29]将全长和截短的 hEC-SOD 基因分别克隆到供体质粒 pFastBacHTb,并转染到 SF9 杆状病毒表达系统,也成功表达出了有活性的全长和截短的 hEC-SOD,且 Western blot 显示重组 hEC-SOD 同时以单体(33 kD)和二聚体(66 kD)形式存在。
昆虫细胞表达系统可以同时表达数个外源基因,在生产蛋白复合体时尤其有效。目前,昆虫表达系统已经广泛应用于疫苗生产和重组病毒杀虫剂等众多领域。但由于鳞翅类昆虫的蛋白加工路径和高等真核生物不同,且杆状病毒感染可能对宿主的蛋白加工具有负面影响,因此其应用还存在一定的限制。
1.5 哺乳动物细胞表达系统
一般通过质粒转染或病毒载体感染的方法在哺乳动物细胞中表达外源蛋白。利用病毒表达体系可以快速感染细胞,在几天内使外源基因整合到病毒载体中,而利用质粒转染获得稳定的转染细胞则需要几周甚至几个月时间。Lu 等[30]采用编码 hCu/Zn-SOD 和 hEC-SOD 的两个序列,以及山羊 β-酪蛋白的 5' 端和 3' 端的调控元件,构建了乳腺特异性表达载体,通过共转染法制备山羊胚胎成纤维细胞作为供体细胞,Western blot 检测显示重组 hCu/Zn-SOD 和 hEC-SOD 在转双基因山羊乳腺中均有表达。联合酶联免疫吸附试验(ELISA)显示,重组 hCu/Zn-SOD 的表达量为 100.14 mg/L,重组 hEC-SOD 的表达量为 279.10 mg/L。酶活性测定结果显示,羊奶中重组 hCu/Zn-SOD 和 hEC-SOD 的总生物活性为 1451 U/ml。这些结果证明了哺乳动物细胞具有生产重组 SOD 的潜力。
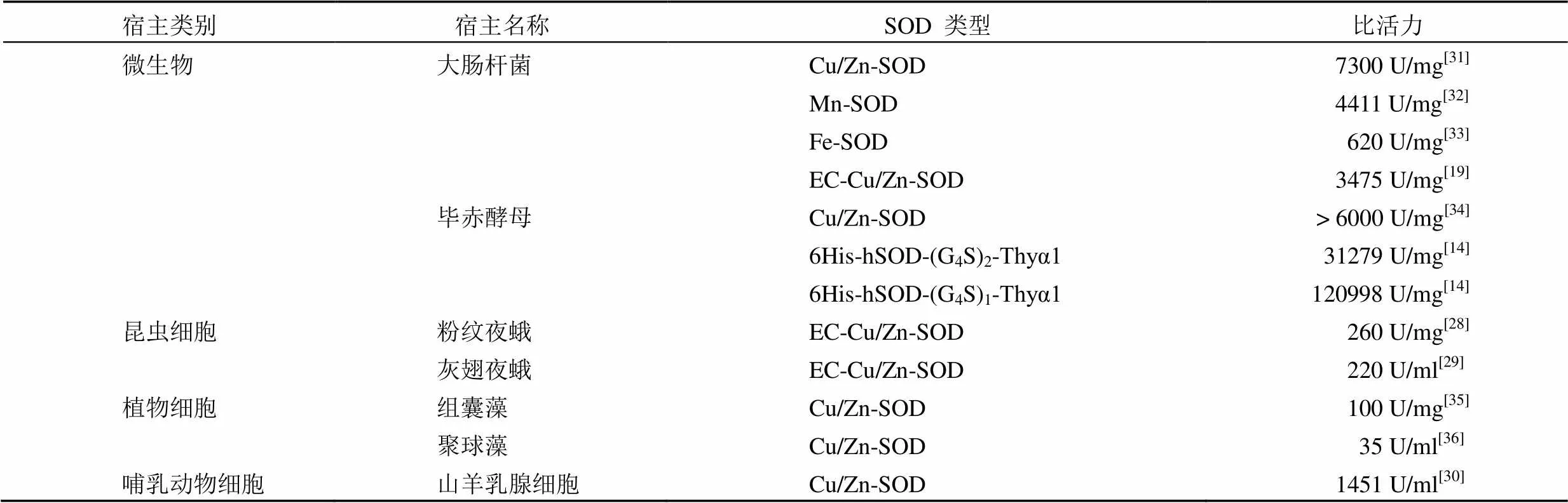
表 1 不同系统表达的重组人源 SOD 比活力比较
2 通过基因突变改善 SOD 的性能
hCu/Zn-SOD 作为抗氧化酶能够减轻活性氧自由基对细胞的损伤,且不会引起免疫反应,但是hCu/Zn-SOD 的大规模生产和临床使用受到产量和可溶性的限制。通过定点突变改变 hCu/Zn-SOD 的一些氨基酸残基可以改善其产量和品质。
hCu/Zn-SOD 包含 2 个亚基,每个亚基又包含 4 个半胱氨酸(Cys)残基,其对应的位置分别是 6、57、111 和 146,其中 Cys57 和 Cys146 之间形成分子内二硫键,6 位和 111 位是游离的半胱氨酸残基。周赞虎等[36]应用 PCR 定点突变技术把 hCu/Zn-SOD 基因的 Cys111密码子突变为 Ala111密码子,通过随机同源重组将突变后的 hCu/Zn-SOD 整合到聚球藻sp. PCC7942 中并实现表达,表达产物在 80 ℃保温 30 min 后仍具有 95% 的活力,耐热能力比天然 hCu/Zn-SOD 有了较大的提高。张琨等[37]通过重叠 PCR 技术将天然 hCu/Zn-SOD 基因的 Cys6密码子突变为 Ala6密码子,Cys111密码子突变为 Ser111密码子,通过大肠杆菌重组表达得到改构体蛋白 rmhCu/Zn-SOD6Ala,111Ser,从 1 g 湿菌体中获得的活性蛋白总量高于未改构体的 2 倍,改构体的热稳定性也获得大幅度提高。高淑彬[38]分别构建天然 hCu/Zn-SOD 和 Cys111突变成 Ala111的突变 hCu/Zn-SOD 表达载体,并在大肠杆菌中表达,其表达量都占菌体总蛋白的 45%以上,突变 hCu/Zn-SOD 酶活力和稳定性均高于天然 hCu/Zn-SOD,证明通过基因突变可以改善酶的性能。通过随机整合方式将突变的 hCu/Zn-SOD 基因整合到蓝藻sp.PCC7942 染色体上,动物实验证明转突变 hCu/Zn-SOD 基因的蓝藻口服后具有较强的抗氧化作用,为进一步研究开发半衰期长的可直接口服的 hCu/Zn-SOD 奠定了基础。Zhang 等[39]将 hCu/Zn-SOD 的 6 位和 111 位的半胱氨酸(C)突变为丝氨酸(S),构建了 3 个突变体 mhSOD1/C6S、mhSOD1/C111S 和 mhSOD1/C6S/C111S。结果表明,与野生型相比,除了 C6S 突变使重组蛋白可溶性表达降低以外,C111S 和 C6S/C111S 突变均能增加重组蛋白在大肠杆菌中的可溶性表达,进而提高重组蛋白的产量,且 C111S 突变效果优于 C6S/C111S。此外,mhSOD1/C111S 显示了更低的毒性和更强的美白和抗辐射活性。因此,C111S 突变是工业化大规模生产和开发重组人源 SOD 的一个有效策略。
3 通过融合蛋白技术改善 SOD 的性能
融合蛋白技术是指利用基因工程技术,将两段或多段编码功能蛋白的基因有目的地连接在一起并进行表达,从而产生一种新的人工融合蛋白的方法。由相对较小的结构域拼装成较大的多功能蛋白是自然进化的一个重要因素。因此,在基因水平上将不同的结构域进行连接,并且使其表达成融合蛋白,是形成多功能蛋白、降低原蛋白毒副作用及改造天然蛋白的重要方法。由于有新功能蛋白加入,融合蛋白的性能被优化,并产生新的生物功能和活性,所以这种新型的人工蛋白具有重要的理论意义和潜在的应用价值[40]。
3.1 PTD-SOD 融合蛋白
细胞膜上没有专一的 SOD 通道或受体,外源 SOD 难以进入细胞内发挥抗氧化作用,因而限制了其临床应用[11]。HIV-1 反式激活蛋白 TAT 的蛋白转导结构域(protein transduction domain,PTD)是一种广谱的能携带大分子物质穿透动物细胞膜的小分子多肽,可以解决 SOD 蛋白透膜相关难题。PTD 可以引导多种多肽和蛋白进入目标细胞,具有转导速度快、效率高和温度适应性广等优点,且能够透过血脑屏障[41]。大部分 PTD 或与 PTD 共价结合的蛋白在跨过细胞膜后转运到细胞核而不是细胞质或其他细胞器,因此PTD 运输系统只适用于在细胞核内发挥功能的药物分子的转运[42]。王宇等[43]研究 PTD4 介导的 Cu/Zn-SOD 对大鼠心肌细胞缺氧-复氧损伤(HRI)的影响,发现重组的 PTD4-Cu/Zn-SOD 融合蛋白可以明显减少 HRI 导致的细胞凋亡,从而减轻大鼠心肌细胞的 HRI,证明了重组 PTD4-Cu/Zn-SOD 可以高效穿透心肌细胞,改善心肌细胞缺血再灌注损伤。Yao 等[44]在骨癌研究中发现,活性氧在一定程度上参与了肿瘤疼痛的发展和持续,而重组 PTD-Cu/Zn-SOD 可以减弱这种作用,因此其在骨癌治疗中可作为一种潜在的辅助治疗剂。Zhang 等[45]将所获得的 Mn-SOD、PTD-Mn-SOD 和脂质体 Mn-SOD 用于保护人脐静脉内皮细胞(HUVECs)氧化损伤,结果发现,与天然 Mn-SOD 相比,PTD-Mn-SOD 和脂质体 Mn-SOD 可发挥更强的药理作用。孟丽华和薛荣亮[46]通过检测 PTD4-Cu/Zn-SOD 进入人星形胶质细胞内的荧光蛋白的分布情况,发现 PTD4-Cu/Zn-SOD 融合蛋白能够穿过细胞膜,且可以降低因细胞缺氧损伤所致的细胞凋亡。PTD 与 SOD 进行融合的方法简单易行,可提供大量廉价、安全、高活性的重组 SOD 制品。需要强调的是,尽管 PTD-Cu/Zn-SOD 融合蛋白具有良好的穿透细胞膜特性,但没有组织特异性,若是静脉给药可能会迅速导入血管内皮细胞或血细胞,不能很好地到达靶区发挥作用,因此需要进一步改进结构或给药途径以解决其靶向问题[47]。
3.2 PEP-SOD 融合蛋白
PEP-1 是一种人工设计的主要用于转导大分子蛋白的细胞穿透肽(cell penetrating peptide,CPP),它能高效率地携带具有治疗效果的蛋白进入细胞并发挥其生物学效应。Liu 等[48]构建了表达 PEP-1-hMnSOD 融合蛋白的表达载体,并在双歧杆菌中成功表达了 PEP-1-hMnSOD 融合蛋白。在进一步临床研究中,将透膜性和稳定性较差的 hMnSOD 通过 PEP-1 递送到结肠炎症细胞内,通过对炎症细胞因子 TNF-α、IL-1β、IL-6 和 IL-8 水平以及结肠组织学损伤检测,发现 PEP-1-hMnSOD 融合蛋白能够有效地减轻葡聚糖硫酸钠诱导的溃疡性结肠炎。因此口服表达 PEP-1-hMnSOD 融合蛋白的双歧杆菌工程菌可作为治疗溃疡性结肠炎的新方法。
神经干细胞(neural stem cells,NSCs)移植已被证明是一种潜在的治疗创伤性脑损伤(traumatic brain injury,TBI)的策略。Jia 等[49]探索 NSCs 移植配合 PEP-1-SOD1 共同治疗大鼠脑缺血的可能性。体外实验证明,PEP-1-SOD1 能提高神经干细胞的增殖和分化;体内实验表明,与单独 NSCs 移植相比,PEP-1-SOD1 联合 NSCs 移植策略对大鼠 TBI 后的功能恢复有明显的促进作用。Yoo 等[50]探讨了Cu/Zn-SOD 对脂肪组织来源间充质干细胞(adipose tissue-derived mesenchymal stromal cells,Ad-MSCs)抗脊髓缺血损伤的促进作用。结果显示 PEP-1-SOD1 和 Ad-MSCs联合应用进一步增强了 Ad-MSCs 对神经元缺血损伤的保护作用。相对于 PTD 融合蛋白,PEP 融合蛋白具有其独特优势。PTD 融合蛋白进入细胞后,所携带的功能蛋白需要在细胞内分子伴侣 HSP90 的帮助下重折叠才能发挥其生物学效应,靶蛋白的生物活性依赖于细胞内 HSP90 的重折叠效率,因此 PTD 融合蛋白技术的临床应用受到了一定限制[51]。而 PEP 融合蛋白能够直接携带具有生物活性的功能蛋白进入细胞发挥生物学效应,同时它还具有转导效率高、无毒性及不受血清影响等优势,这使细胞穿透肽 PEP 在应用上更具有潜力,可能成为更适合于蛋白治疗的载体工具。
3.3 多功能融合蛋白
研究者们曾尝试将不同功能的蛋白与 SOD 进行组合,将不同蛋白的优势和特点融合在一起,以赋予目的蛋白多种新的属性和功能。周宇飞等[14]为了增强胸腺素 α1(Thyα1)的稳定性和免疫功能,采用胸腺素 α1 与人源 SOD 融合的策略,构建了 6His-hSOD-(G4S)1-Thyα1 和 6His-hSOD-(G4S)2-Thyα1 两个融合基因,并在毕赤酵母中实现了高水平表达。重组表达的融合蛋白经过进一步纯化后进行了活性检测,结果表明这两个融合蛋白既有 SOD 的活性,又有 Thyα1 的活性。盛明明等[52]采用基因工程技术通过大肠杆菌制备一种兼具人源 SOD 和过氧化氢酶(CAT)活性的多功能融合蛋白 CAT-PTD-SOD,该融合蛋白大部分以兼具 SOD 和 CAT 活性的可溶形式存在。在 0.033 mol/L、甚至 0.067 mol/L 的 H2O2溶液中,SOD 活性在 20 min 内无明显下降,证明其具备抗氧化和分解过氧化氢的双重作用。潘剑茹等[53]构建了 SOD1 和穿膜肽 R9 的融合蛋白表达质粒 GST(谷胱甘肽巯基转移酶)-SOD1-R9,通过大肠杆菌 BL21(DE3)表达出具有双效抗氧化功能的 GST-SOD1-R9 融合蛋白。该融合蛋白不仅能够清除多余的活性氧自由基,而且还能够修复或清除体内已被氧化损伤的生物分子,并再生氧化损伤的含巯基蛋白。Pan 等[54]研究了 GST-TAT-SOD 对顺铂损伤细胞的保护作用,证明 GST-TAT-SOD 通过直接清除多余的细胞内自由基和增强细胞抗氧化防御,可以解除顺铂治疗引起的生长抑制和细胞凋亡,因此GST-TAT-SOD 可以作为顺铂诱导的细胞损伤的保护剂。此外,Pan 等[55]还通过小鼠全身X 射线辐射实验,表明双功能 GST-TAT-SOD 对 X 射线辐射所致损伤有一定的防护作用,能够有效提高小鼠脾脏和肝脏的抗氧化能力、脾脏白髓数目和胸腺指数等,不仅显著提高了X 射线辐照小鼠体重增长率,而且提高了接受致死量照射小鼠的存活率。GST-TAT-SOD 的整体效果比阿米福汀好一些,所以 GST-TAT-SOD 可作为一种安全的辐射防护剂。Luangwattananun 等[56]设计并研制了三功能融合蛋白CAT-CuZnSOD/6His-CuZnSOD-TAT(CS/S-TAT),与其之前设计的 6His-MnSOD-TAT/CAT-MnSOD(M-TAT/CM)相比,分子大小减小 42%,其 SOD 和 CAT 活性分别提高 22% 和 99%。在 70 ℃孵育 10 min 后,CS/S-TAT 保留了 54% 的残余 SOD 活性,而 M-TAT/CM 的 SOD 活性完全消除。此外,在 70 ℃时,CS/S-TAT 的半衰期比 M-TAT/CM 提高了 5 倍。该酶能够跨膜进入哺乳动物细胞,可作为氧化损伤细胞的保护剂或治疗剂。因此,这项工作为设计和合成一种更稳定的多功能抗氧化酶提供了参考。总之,多功能的融合蛋白在抗氧化方面,往往比单一的抗氧化蛋白具有更大的优势。因此,融合蛋白的巨大优势使其有望成为新一代抗氧化药物的有力竞争者,为开发高效率抗氧化蛋白开辟了新途径。
4 总结与展望
SOD 是生物体内一种重要的氧自由基清除剂,具有重要的生物学功能。许多疾病(如肌萎缩侧索硬化、动脉硬化闭塞症、肿瘤转移和感染性疾病等)的产生和发展与 SOD 缺乏或不正确折叠有关[57-60]。随着 SOD 研究不断深入和工业化生产规模逐渐扩大,SOD 还被应用于化学、生物学、食品科学和植物病害预防等多个领域。但是受天然 SOD 的理化性质所限,如静脉注射后体内半衰期仅为 6 min[9],口服后在胃肠道中容易被破坏而失去疗效,膜透过率低等,这些因素使其在应用方面受到了很大的限制。目前,人们对 SOD 蛋白进行了化学修饰、人工有机合成 SOD 模拟物和运用基因工程法制备 SOD 等方面的探索,普遍认为通过基因工程制备重组人源 SOD 是最为经济、快捷、有效且安全的方法[16]。随着现代生物技术的快速发展,国内外在微生物发酵生产重组 SOD 的菌种选育、高产菌开发和发酵工艺的优化等方面都取得了一定进展。通过基因工程技术生产重组人源SOD,既降低了其他来源 SOD 的免疫原性问题,又解决了人源 SOD 的来源问题,并且可以克服传统工艺限制,使人们可以按照自己的意愿定向改造目的蛋白。随着研究的进一步深入,基于基因工程主导的生物工程将逐渐推进重组 SOD 实现产业化,利用 SOD 开发的产品也将会得到更为广泛的应用。
[1] Li C, Sun H, Chen A, et al. Identification and characterization of an intracellular Cu, Zn-superoxide dismutase (icCu/Zn-SOD) gene from clam Venerupis philippinarum. Fish Shellfish Immunol, 2010, 28(3): 499-503.
[2] Chen HP, Tan XF. Literature review of researches on superoxide dismutase. Nonwood Forest Res, 2007, 25(1):59-65. (in Chinese)
陈鸿鹏, 谭晓风. 超氧化物歧化酶(SOD)研究综述. 经济林研究, 2007, 25(1):59-65.
[3] Kim Y, Jeon YJ, Ryu K, et al. Zinc(II) ion promotes anti-inflammatory effects of rhSOD3 by increasing cellular association. BMB Rep, 2017, 50(2):85-90.
[4] Teoh ML, Fitzgerald MP, Oberley LW, et al. Overexpression of extracellular superoxide dismutase attenuates heparanase expression and inhibits breast carcinoma cell growth and invasion. Cancer Res, 2009, 69(15):6355-6363.
[5] Kwon MJ, Jeon YJ, Lee KY, et al. Superoxide dismutase 3 controls adaptive immune responses and contributes to the inhibition of ovalbumin-induced allergic airway inflammation in mice. Antioxid Redox Signal, 2012, 17(10):1376-1392.
[6] Wang W, Jin Y, Zeng N, et al. SOD2 facilitates the antiviral innate immune response by scavenging reactive oxygen species. Viral Iimmunol, 2017, 30(8):582-589.
[7] Liu XH, Li XD, Liu T, et al. Studies on purifying superoxide dismutase (SOD) in swine blood by heating denaturalization method.J Wuhan Polytechnic Univ, 2008, 27(1):8-10. (in Chinese)
刘晓红, 李向东, 刘婷, 等. 热变性法提纯猪血SOD的工艺优化. 武汉轻工大学学报, 2008, 27(1):8-10.
[8] Yan WJ, Li XM. Progress in preparation and application of main functional components from animal blood. Food Res Dev, 2018, 39(16):215-219. (in Chinese)
闫文杰, 李兴民. 动物血液主要功能成分制备及应用研究进展. 食品研究与开发, 2018, 39(16):215-219.
[9] Sun DY, He J, Gui XF. Studies on molecular weight of superoxide dismutase (SOD) by gel permeation chromatography (GPC). Chin J Chromatography, 1994, 12(4):281-282. (in Chinese)
孙定一, 何娟, 桂兴芬. 高效凝胶渗透色谱法研究超氧化物歧化酶的分子量. 色谱, 1994, 12(4):281-282.
[10] Liu PH, Lu P, Li QT, et al. Preparation and safety of superoxide dismutase from human blood for injection. Chin J Blood Transfus, 1993, 6(4):203-205. (in Chinese)
刘鹏翰, 卢平, 李清棠, 等. 注射用人血超氧化物歧化酶的制备及其安全性. 中国输血杂志, 1993, 6(4):203-205.
[11] Wang XX, Qi SH, Li RM, et al. Study on expression and trans-membrane activity of human Cu, Zn-SOD-PTD. J Mol Diagn Ther, 2016, 8(2):88-93. (in Chinese)
王晓勋, 杞少华, 李瑞明, 等. 高效hCu,Zn-SOD-PTD融合蛋白的表达及其穿膜功能的研究. 分子诊断与治疗杂志, 2016, 8(2):88-93.
[12] Chen JL, Gao F, Yi Y, et al. The development of superoxide dismutases chemical modification. Zhejiang Chem Ind, 2008, 39(7): 22-26. (in Chinese)
陈佳乐, 高飞, 易喻, 等. 超氧化物歧化酶化学修饰的研究进展及展望. 浙江化工, 2008, 39(7):22-26.
[13] Zhang LZ, Ma SL. Progress in studies on SOD mimics. Acta Pharm Sinica, 2002, 37(3):235-240. (in Chinese)
张龙泽, 马书林. SOD模拟化合物的研究进展. 药学学报, 2002, 37(3):235-240.
[14] Zhou YF, Zhou JG, Yuan HY, et al. Expression and activity determination of fusion protein hSOD-Thyα1 in Pichia pastoris.J Fudan Univ (Nat Sci), 2011, 50(2):178-184. (in Chinese)
周宇飞, 周峻岗, 袁汉英,等. 人超氧化物歧化酶-胸腺素α1融合蛋白在毕赤酵母中的表达与活性检测. 复旦学报(自然科学版), 2011, 50(2):178-184.
[15] Sherman L, Dafni N, Lieman-Hurwitz J, et al. Nucleotide sequence and expression of human chromosome 21-encoded superoxide dismutase mRNA.Proc Natl Acad Sci U S A, 1983, 80(18):5465-5469.
[16] Tian CM, Zhong QP. Advance in current research of superoxide dismutase. China Trop Med, 2005, 5(8):1730-1732. (in Chinese)
田春美, 钟秋平. 超氧化物歧化酶的现状研究进展. 中国热带医学, 2005, 5(8):1730-1732.
[17] Rong JJ, Diao ZY, Zhou GH. Research progress on E.coli expression system. Pharm Biotechnol, 2005, 12(6):416-420. (in Chinese)
戎晶晶, 刁振宇, 周国华. 大肠杆菌表达系统的研究进展. 药物生物技术, 2005, 12(6):416-420.
[18] Zhang HH, Zhao XY, Jing TY. Renaturation of recombinant human superoxide dismutase. Chin J Biochem Pharm, 2003, 24(1):32-33. (in Chinese)
张弘浩, 赵晓瑜, 静天玉. 重组人超氧化物歧化酶的复性. 中国生化药物杂志, 2003, 24(1):32-33.
[19] Zhu XQ, Li SX, He HJ, et al. On-column refolding of an insoluble His6-tagged recombinant EC-SOD overexpressed in Escherichia coli. Acta Biochim Biophys Sin (Shanghai), 2010, 37(4):265-269.
[20] Xue L. Fermentation and purification of recombinant hPDGF overexpressed in Saccharomyces cerevisiae. Guangzhou: South China University of Technology, 2009. (in Chinese)
薛亮. 重组hPDGF在酿酒酵母中高表达的发酵及纯化工艺研究. 广州: 华南理工大学, 2009.
[21] Lin SS, Liu WJ, Lin JY, et al. Construction of extracellular superoxide dismutase and expression in Pichia pastoris. J Fuzhou Univ (Nat Sci Ed), 2018, 46:281-285. (in Chinese)
林士森, 刘玮洁, 林靖颖, 等. 人源 EC-SOD 在毕赤酵母中的构建与表达. 福州大学学报(自然科学版), 2018, 46(2):281-285.
[22] Zheng YF, Sun JY, Wu QM, et al. Fermentation technology of expression of human Cu,Zn-SOD in recombinant Pichia pastoris. J Fuzhou Univ (Nat Sci Ed), 2014, 42(5):801-806. (in Chinese)
郑屹峰, 孙金钰, 巫启明, 等. 人Cu,Zn-SOD在重组毕赤酵母中表达的发酵工艺研究. 福州大学学报(自然科学版), 2014, 42(5):801-806.
[23] Gao BM, Zhangsun DT, Luo SL, et al. Study on separation and purification of recombinant proteins in Pichia pastoris expression system. Biotechnol Bull, 2009, (3):33-36. (in Chinese)
高炳淼, 长孙东亭, 罗素兰, 等. 毕赤酵母表达体系中重组蛋白的分离纯化. 生物技术通报, 2009, (3):33-36.
[24] Obembe OO, Popoola JO, Leelavathi S, et al. Advances in plant molecular farming. Biotechnol Adv, 2011, 29(2):210-222.
[25] Park KY, Kim EY, Lee W, et al. Expression, subcellular localization, and enzyme activityof a recombinant human extra-cellular superoxide dismutase in tobacco (Nicotiana benthamiana L.). Protein Expres Purif, 2016, 119:69-74.
[26] Yang HQ, He TP. Antibody processing and production of transgenic plants. Int J Biol, 2006, 29(3):123-125, 137. (in Chinese)
杨会强, 何太平. 转基因植物的抗体加工和生产. 国际生物制品学杂志, 2006, 29(3):123-125, 137.
[27] Yin CC, Liu J, Huang HL. Insect expression system and their application in antibodyengineering. Prog Biotechnol, 2001, 21(3):66- 70. (in Chinese)
尹长城, 刘晶, 黄华梁. 昆虫表达系统及其在基因工程抗体中的应用. 生物工程进展, 2001, 21(3):66-70.
[28] Fan LQ, He HJ, Yuan QS, et al. Cloning and high expression of human EC-SOD cDNA. J East China Univ Sci Technol (Nat Sci), 2002, 28(1):39-42, 62. (in Chinese)
范立强, 贺华君, 袁勤生, 等. 人EC-SOD的克隆及高效表达. 华东理工大学学报(自然科学版), 2002, 28(1):39-42, 62.
[29] Shrestha P, Yun JH, Kim WT, et al. Cloning, purification, and characterization of recombinant human extracellular superoxide dismutase in SF9 insect cells. Mol Cells, 2016, 39(3):242-249.
[30] Lu R, Zhang T, Wu DJ, et al. Production of functional human CuZn-SOD and EC-SOD in bitransgenic cloned goat milk. Transgenic Res, 2018, 27(4):343-354.
[31] Liu JR, Zhao XY, Bu DZ, et al. Renaturation and purification of inclusion body of recombinant human superoxide dismutase. Chin J Pharm, 2008, 39(6):417-420. (in Chinese)
刘建荣, 赵晓瑜, 步得志, 等. 重组人超氧化物歧化酶包涵体的复性和纯化. 中国医药工业杂志, 2008, 39(6):417-420.
[32] Cheng Y, Chen CS, Wu QY, et al. Study on purification condition of recombinant human manganese superoxide dismutase. Food Drug, 2007, 9(7):1-5. (in Chinese)
程贻, 陈车生, 吴乾一, 等. 重组人锰超氧化物歧化酶纯化条件研究. 食品与药品, 2007, 9(7):1-5.
[33] Chen FD. Construction, expression, renaturation of FeSOD-ScFv and the effect of combined administration of FeSOD-ScFv and retinoic acid on the activity of lung adenocarcinoma cells. Hangzhou: Zhejiang University, 2010. (in Chinese)
陈福鼎. FeSOD-ScFv 的构建、表达、复性及其与视黄酸联合给药对肺腺癌细胞活性的影响. 杭州: 浙江大学, 2010.
[34] Chi CP, Chen ZY, Xu J, et al. Study on a process for production of rhCu,Zn-SOD in Pichia pastoris. Chin J Vet Sci, 2012, 32(2):267-271. (in Chinese)
迟春萍, 陈子杨, 徐军, 等. 毕赤酵母表达铜锌超氧化物歧化酶中试工艺研究. 中国兽医学报, 2012, 32(2):267-271.
[35] Takeshima Y, Takatsugu N, Sugiura M, et al. High-level expression of human superoxide dismutase in the cyanobacterium Anacystis nidulans 6301. Proc Natl Acad Sci U S A, 1994, 91(21):9685-9689.
[36] Zhou ZH, Zhang HY, Liu RH, et al. Sited-directed mutagenesis of hCu,Zn-SOD gene and its expression in Synechococcus sp. PCC7942. Acta Microbiol Sinica, 2006, 46(1):147-149. (in Chinese)
周赞虎, 张海艳, 刘仁海, 等. 人铜锌超氧化物歧化酶基因改良及在聚球藻中表达. 微生物学报, 2006, 46(1):147-149.
[37] Zhang K, Zhang YJ, Wang Y, et al. Construction, expression and purification of a thermostable, high yield recombined hCu, Zn-SOD mutant. J Northwest Univ (Nat Sci Ed), 2010, 40(5):837-842. (in Chinese)
张琨, 张月娟, 王琰, 等. 耐热, 高产重组人Cu,Zn-SOD改构体的构建及纯化方法的研究. 西北大学学报(自然科学版), 2010, 40(5): 837-842.
[38] Gao SB. High expression and activity of human CuZn-SOD mutant gene in Chlorococcus. Xiamen: Xiamen University, 2007. (in Chinese)
高淑彬. 人CuZn-SOD突变基因在聚球藻中的高效表达及活性研究. 厦门: 厦门大学, 2007.
[39] Zhang K, Zhang Y, Zi J, et al. Production of human Cu,Zn SOD with higher activity and lower toxicity in E. coli via mutation of free cysteine residues. Biomed Res Int, 2017, 2017:4817376.
[40] Zhang Y, Qu XM, Yang SL. Applications of genetic engineered fusion proteins. Prog Biotechnol, 2000, 20(3):13-17, 12. (in Chinese)
张毅, 屈贤铭, 杨胜利. 融合蛋白基因工程应用及研究. 生物工程进展, 2000, 20(3):13-17, 12.
[41] Wang FP, Gui XD, Song LH. Expression and trans-membrane activity of human Cu, Zn-SOD-TAT PTD. Pharm Biotechnol, 2004, 11(1):11- 15. (in Chinese)
汪飞鹏, 桂向东, 宋礼华. hCu,Zn-SOD-TAT PTD的融合表达及其跨膜转运性质的初步研究. 药物生物技术, 2004, 11(1):11-15.
[42] Li PZ. Expression and purification of fusion protein CTP-SOD in Pichia pastoris and antioxidant capacity analysis. Chin J Biotechnol, 2010, 26(3):324-329. (in Chinese)
李沛志. 融合蛋白CTP-SOD在毕赤酵母中的表达、纯化及抗氧化能力. 生物工程学报, 2010, 26(3):324-329.
[43] Wang Y, Li Q, Zeng WJ, et al. Effects of Cu/Zn SOD mediated by cell penetrating peptide 4 on hypoxia/reoxygenation injury in myocardial cell. Chongqing Med, 2017, 46(21):2881-2883, 2888. (in Chinese)
王宇, 李清, 曾文静, 等. 细胞穿透肽4介导的Cu/Zn SOD对缺氧复氧损伤心肌细胞的影响. 重庆医学, 2017, 46(21):2881-2883, 2888.
[44] Yao W, Zhao H, Shi R, et al. Recombinant protein transduction domain-Cu/Zn superoxide dismutase alleviates bone cancer pain via peroxiredoxin 4 modulation and antioxidation. Biochem Biophys Res Commun, 2017, 486(4):1143-1148.
[45] Zhang S, Cao Y, Xie L, et al. Effect of superoxide dismutase- entrapped liposomes and protein transduction domain-superoxide dismutase on human umbilical vein endothelial cells. Mol Med Rep, 2014, 9(4):1427-1433.
[46] Meng LH, Xue RL. Progress of protein transduction domain- superoxide dismutase fusion protein in cerebral ischemia/reperfusion injury. Int J Anesth Resuscitation, 2014, 35(2):188-192. (in Chinese)
孟丽华, 薛荣亮. 蛋白质转导超氧物歧化酶融合蛋白在脑缺血/缺氧损伤中的研究进展. 国际麻醉学与复苏杂志, 2014, 35(2):188- 192.
[47] Wang Y, Liu JY, Zeng WJ, et al. Effects of Cu/Zn SOD mediated by cell penetrating peptide PTD4 on hypoxia/reoxygenation injury in myocardial cells of rats. Mod Med J, 2017, 45(10):1396-1399. (in Chinese)
王宇, 刘菊英, 曾文静, 等. PTD4-Cu/Zn-SOD融合蛋白对大鼠心肌细胞缺氧复氧损伤的影响. 现代医学, 2017, 45(10):1396-1399.
[48] Liu M, Li S, Zhang Q, et al. Oral engineered Bifidobacterium longum expressing rhMnSOD to suppress experimental colitis. Int Immunopharmacol, 2018, 57:25-32.
[49] Jia J, Chen F, Wu Y. Recombinant PEP-1-SOD1 improves functional recovery after neural stem cell transplantation in rats with traumatic brain injury. Exp Ther Med, 2018, 15(3):2929-2935.
[50] Yoo DY, Kim DW, Chung JY, et al. Cu, Zn-Superoxide dismutase increases the therapeutic potential of adipose-derived mesenchymal stem cells by maintaining antioxidant enzyme levels. Neurochem Res, 2016, 41(12):3300-3307.
[51] Jia JM, Pu XK. PEP-1-SOD1 fusion protein:preparation, expression and purification. Acta Acad Med Xuzhou, 2015, 35(2):105-108. (in Chinese)
贾进明, 濮翔科. PEP-1-SODl融合蛋白的制备、表达及纯化. 徐州医学院学报, 2015, 35(2):105-108.
[52] Sheng MM, Lv YH, Li RK, et al. Construction of superoxide dismutase-catalase fusion gene and its expression in Escherichia coli. J Fuzhou Univ (Nat Sci Ed), 2012, 40(1):119-125, 131. (in Chinese)
盛明明, 吕元辉, 李仁宽, 等. 人超氧化物歧化酶-过氧化氢酶融合基因的构建、表达及其产物的初步纯化和性质研究. 福州大学学报(自然科学版), 2012, 40(1):119-125, 131.
[53] Pan JR, Wu LQ, He HC, et al. Expression, purification, stability and transduction efficiency of GST-SOD1-R9 fusion protein. Chin J Biotechnol, 2017, 33(5):828-837. (in Chinese)
潘剑茹, 吴伦巧, 何火聪, 等. GST-SOD1-R9融合蛋白的表达、纯化、稳定性与跨膜效应. 生物工程学报, 2017, 33(5):828-837.
[54] Pan J, Li L, Liang L, et al. Cytoprotective effects of cell-permeable bifunctional antioxidant enzyme, GST-TAT-SOD, against cisplatin- induced cell damage. Oxid Med Cell Longev, 2017, 2017:9530791.
[55] Pan J, He H, Su Y, et al. In vivo radioprotective activity of cell-permeable bifunctional antioxidant enzyme GST-TAT-SOD against whole-body ionizing irradiation in mice. Oxid Med Cell Longev, 2017, 2017:2689051.
[56] Luangwattananun P, Eiamphungporn W, Songtawee N, et al. Improving enzymatic activities and thermostability of a tri-functional enzyme with SOD, catalase and cell-permeable activities. J Biotechnol, 2017, 247:50-59.
[57] Iannitti T, Scarrott JM, Likhite S, et al. Translating SOD1 gene silencing toward the clinic: a highly efficacious, off-target-free, and biomarker-supported strategy for fALS. Mol Ther Nucleic Acids, 2018, 12:75-88.
[58] Farias ICC, Mendonça-Belmont TF, da Silva AS, et al. Association of the SOD2 polymorphism (Val16Ala) and SOD activity with vaso-occlusive crisis and acute splenic sequestration in children with sickle cell anemia. Mediterr J Hematol Infect Dis, 2018, 10(1): e2018012.
[59] Kogawa K, Muramatsu H, Tanaka M, et al. Enhanced inhibition of experimental metastasis by the combination chemotherapy of Cu-Zn SOD and adriamycin. Clin Exp Metastasis, 1999, 17(3):239-244.
[60] Yasui K, Baba A. Therapeutic potential of superoxide dismutase (SOD) for resolution of inflammation. Inflamm Res, 2006, 55(9):359-363.
杨金玲,Email:yangjl@imm.ac.cn,朱平,Email:zhuping@ imm.ac.cn
2019-04-22
10.3969/j.issn.1673-713X.2019.04.011

