雷替曲塞对人胃癌细胞MGC-803裸鼠移植瘤的抑制作用
薛 松,陈映霞,秦叔逵,蒋宗惠,董祥宁
胃癌是我国常见的恶性肿瘤,对患者的生命健康造成了极大的危害。尽管近几年死亡率略有下降,但仍高居恶性肿瘤死亡率前三位[1]。早期胃癌无特殊临床表现,大多数胃癌患者确诊时已是中晚期。针对进展期胃癌患者,主要的治疗手段是化疗。雷替曲塞是一种胸腺酸合成酶(thymidylate synthase,TS)抑制药,目前广泛应用于不适合氟尿嘧啶的晚期直肠结肠癌患者[2]。本研究的前期实验已证实,雷替曲塞能促进体外培养的人胃癌SGC-7901细胞凋亡,从而发挥抗肿瘤作用[3]。但雷替曲塞在体内是否可诱发胃癌细胞凋亡及其机制尚未明确。本研究通过观察雷替曲塞对高度侵袭型胃癌裸鼠移植瘤生长的影响,探讨其对胃癌细胞可能的凋亡机制,为雷替曲塞临床治疗胃癌提供理论支持。
1 材料与方法
1.1 试剂和仪器 雷替曲塞购自南京正大天晴公司;鼠抗人Ki67、PCNA单克隆抗体购自北京中杉金桥公司;兔抗人Caspase-3单克隆抗体、Bax单克隆抗体购自美国Cell Signaling公司;ECL Kit、PVDF膜购自南京凯基公司。
1.2 实验动物和细胞株 BALB/C nu/nu雄性裸鼠24只,购自上海西普尔-必凯实验动物有限公司,实验动物质量合格证编号为SCXK(沪)2013-0016。鼠龄4周,体重15 g,SPF条件下饲养。所有操作均按照安徽医科大学动物伦理学规定进行。将人胃癌细胞株MGC-803置于含10%胎牛血清的RPMI-1640培养液中,在37 ℃、5% CO2恒温孵育箱中培养,待其贴壁生长至70%~80% 汇合时,用0.05%胰酶消化传代培养。
1.3 实验方法
1.3.1 裸鼠人胃癌模型的建立 先将实验裸鼠适应性饲养1周,收集胰酶消化的对数生长期的人胃癌MGC-803细胞,800 r/min离心4 min弃上清液。将其配制成为2×107个/ml浓度的单细胞悬液。在无菌环境中,按照0.2 ml/只接种于裸鼠腋下,放回笼中继续饲养,观察裸鼠的状态。1周后24只裸鼠皮下均出现5 mm左右结节,表明人胃癌模型建立成功。将荷瘤裸鼠随机分为以下3组:对照组(生理盐水),低剂量组(雷替曲塞5 mg/kg),高剂量组(雷替曲塞12 mg/kg),每组8只。每周给药2次,持续2周。
1.3.2 雷替曲塞抑瘤作用观察 给药期间密切观察各组裸鼠的一般生长状况,如精神、饮食、活动等情况,每3天称重一次。给药结束次日将各组裸鼠处死,解剖,在无菌条件下剥离瘤体。对裸鼠重量和剥出的瘤体称重测量,并对抑瘤率进行统计。计算抑瘤率=(对照组平均瘤重-实验组平均瘤重)/对照组平均瘤质量×100%。将取下的部分瘤块组织浸泡于4%多聚甲醛溶液中,固定制备成组织石蜡块,余下部分置于液氮保存。
1.3.3 免疫组化法检测 采用免疫组化EnVision染色方法。高倍显微镜下,由2名病理科医师对切片进行盲式阅片,根据阳性细胞所占比例进行判定,不考虑染色强度,对每张切片选取5张无重复视野的图像。
1.3.4 Western blotting检测 配制含有PMSF的RIPA蛋白裂解液,将肿瘤组织冰上充分裂解后4 ℃离心(12 000g,4 min)。取等量上清液,采用BCA定量法测量蛋白样品浓度。灌制10% SDS-PAGE凝胶,每孔加入蛋白样品进行电泳。将蛋白从凝胶转至PVDF膜,转移用稀释的脱脂奶粉封闭。稀释抗及β-actin后4 ℃孵育过夜。次日用TBST冲洗PVDF膜4次,加入二抗,室温孵育1 h后再次用TBST冲洗。最后将ECL发光液滴加至PVDF膜上,应用凝胶成像仪曝光并显色,记录各目的条带与内参条带灰度值。
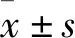
2 结 果
2.1 一般状况 给药期间各组裸鼠未出现死亡情况。给药2周后,与采用雷替曲塞治疗的两组比较,对照组裸鼠出现腹水,进水、饮食量明显减少,裸鼠体重增加考虑移植瘤增大及腹水导致。雷替曲塞低剂量组裸鼠一般情况良好,饮食量略有减少,进水正常,但高剂量组裸鼠后期进水、饮食量显著减少,过度消瘦,考虑系药物毒性所致。治疗期间各组裸鼠的体重变化情况见图1。
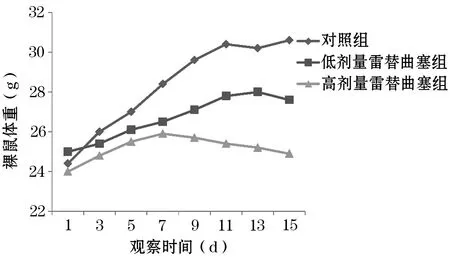
图1 3组荷瘤裸鼠给药期间体重变化
2.2 移植瘤瘤重及抑瘤率比较 雷替曲塞低剂量组平均瘤体质量为(1.00±0.07) g,高剂量组为(0.77±0.09)g,对照组为(1.38±0.09)g,使用雷替曲塞治疗的两组裸鼠瘤重与对照组相比明显降低(F=107.839,P<0.05)。低剂量组、高剂量组的抑瘤率分别为27.54%、44.20%,差异有统计学意义(P<0.05)。
2.3 肿瘤组织Ki67、PCNA表达水平 Ki67和PCNA阳性染色主要定位于细胞核,呈棕黄色或棕褐色颗粒状染色。雷替曲塞两组裸鼠肿瘤组织中Ki67表达水平明显低于对照组(F=28.634,P<0.05),且低剂量组与高剂量组间的差异具有统计学意义(P<0.05);雷替曲塞两组裸鼠肿瘤组织中PCNA表达水平明显低于对照组(F=15.373,P< 0.05),且低剂量组与高剂量组间的差异具有统计学意义(P< 0.05,图2、表1)。
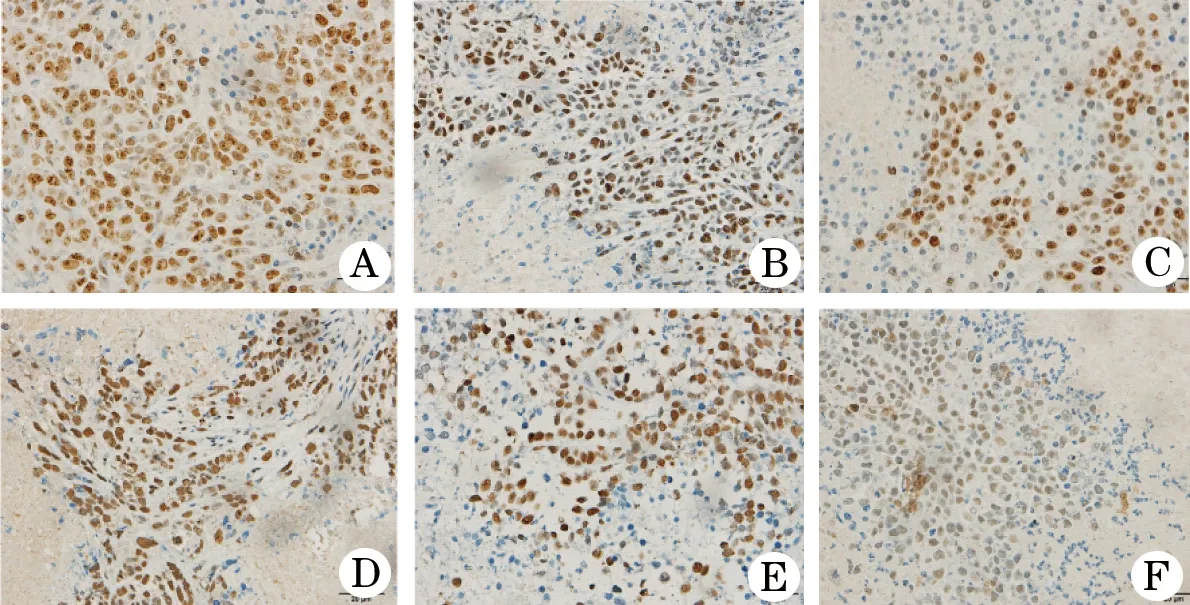
图2 给药后裸鼠移植瘤Ki67、PCNA蛋白的表达
A.Ki67对照组; B.Ki67低剂量组;C.Ki67高剂量组;D.PCNA对照组;E.PCNA低剂量组;F.PCNA高剂量组
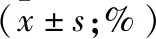

组别数量Ki67PCNA低剂量组858.95±5.49①51.36±8.17①高剂量组842.16±6.80①②37.27±5.99①②对照组870.77±5.6562.00±6.90
注:与对照组比较,①P<0.05;与低剂量组比较,②P<0.05
2.4 肿瘤组织Caspase-3、Bax表达水平 Caspase-3和Bax蛋白是诱导细胞凋亡的关键效应酶。给药后,雷替曲塞两组裸鼠肿瘤组织中Caspase-3和Bax蛋白表达量均较对照组明显升高(P<0.05),且低剂量组与高剂量组间的差异具有统计学意义(P< 0.05,图3、4)。

图3 给药后裸鼠移植瘤3组的蛋白表达
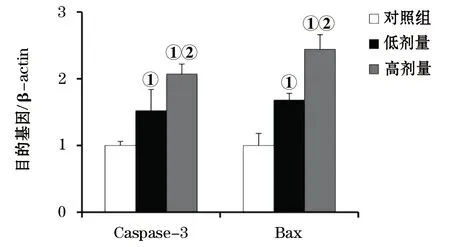
图4 给药后裸鼠移植瘤Caspase-3、Bax蛋白的表达
3 讨 论
胃癌是全世界范围内最常见的恶性肿瘤之一,它的发生发展与许多因素有关。早期胃癌可以选择内镜治疗,对于不适合内镜治疗的患者可选择开腹手术或腹腔镜手术。然而很多患者错过了最佳治疗时机,诊断胃癌时已是晚期,失去了手术机会。对于这部分胃癌患者,目前通常采取以化疗为主的综合治疗,这已经有了充分的循证学证据[4]。晚期转移性胃癌治疗棘手,特别是多线治疗时的药物选择有限,疗效欠佳。因此,积极寻找安全有效的化疗药物迫在眉睫。
雷替曲塞是TS特异性选择性抑制药,属于抗代谢类叶酸类似物,国内批准应用于晚期结直肠癌患者。雷替曲塞进入细胞后通过一系列的反应产生多聚谷氨酸类化合物,该化合物能抑制TS活性,最终达到抑制DNA合成的目的[5]。虽然雷替曲塞与氟尿嘧啶作用的靶酶相同,均为TS抑制药,但它们的作用机制不完全相同,不完全交叉耐药。此外,雷替曲塞较氟尿嘧啶有着较高的安全性,尤其对于有心脏病史的患者,雷替曲塞不会导致氟尿嘧啶类相关代谢产物蓄积,可以避免氟尿嘧啶类药物心脏毒性的发生[6]。ESMO结直肠指南推荐雷替曲塞作为因心脏病风险而不适合氟尿嘧啶类药物的最佳替代选择。国内外大样本的临床试验已经证实了雷替曲塞是晚期结直肠癌有效的姑息治疗方案,有效率高,毒副反应可耐受。
除了结直肠癌领域,回顾性临床研究显示雷替曲塞能使部分晚期胃癌患者从治疗中获益且耐受性良好,具有潜在的意义和价值[7]。深入探讨其抗肿瘤机制将有助于为临床实践提供理论依据,目前已有雷替曲塞作用于胃癌细胞的相关实验报告。师鲁静等[8]研究表明雷替曲塞可能通过抑制Livin基因的表达抑制胃癌细胞株的生长。徐瀚峰等[9]发现雷替曲塞联合奥曲肽对胃癌细胞抑制具有协同作用,两药联合可以明显降低VEGF-C的表达。洪雷等[10]通过荷瘤裸鼠模型发现,雷替曲塞有明显抑制胃癌移植瘤生长的作用,与氟尿嘧啶相比抑瘤效果相似,并指出其机制可能与诱导细胞凋亡及细胞周期阻滞有关,并通过上调p53表达来发挥抑瘤作用。马世华等[11]研究表明雷替曲塞可将人胃癌细胞株细胞S期的比例上升,从而将细胞进程阻滞在G0/G1期。上述实验证实了雷替曲塞对人胃癌细胞同样具有增殖抑制作用,并推测其可能通过细胞凋亡来发挥抑瘤作用。凋亡的基因调控非常复杂,Caspase的级联反应是凋亡的基本过程,由Bcl-2蛋白家族所构成的复杂蛋白间相互作用既能促进也能抑制凋亡的发生,这取决于其中各种不同蛋白的激活状态。但以上实验均未能详细阐述雷替曲塞诱导胃癌细胞凋亡的分子机制。
在前期实验中,笔者体外观察到了雷替曲塞可诱导人胃癌SGC-7901细胞发生凋亡,且呈剂量和时间依赖性,其诱导凋亡的机制可能与Caspase-3、Bax、细胞色素C表达上调,Bcl-2表达下降有关[3]。在以上实验的基础上,为了明确雷替曲塞在体内是否可诱导胃癌细胞凋亡,本研究建立了人胃癌MGC-803裸鼠移植瘤模型,并初步探讨雷替曲塞对胃癌细胞凋亡的相关作用机制。结果显示,雷替曲塞在裸鼠体内对人胃癌移植瘤生长具有明显的抑制作用,呈剂量依赖关系,差异有统计学意义。但也应该看到,治疗组裸鼠体重与对照组对比普遍偏低,尤其是高剂量组,这表明随着雷替曲塞剂量的增大,相关毒性作用也越大。本实验显示,胃癌裸鼠移植瘤对照组中的Ki67、PCNA呈高表达,但在雷替曲塞干预下,治疗组的Ki67和PCNA表达水平显著下降,凋亡蛋白Caspase-3和Bax表达水平显著升高,实验说明雷替曲塞在裸鼠体内可通过诱导细胞凋亡来抑制肿瘤的增长。
细胞凋亡不同于细胞衰老,是机体细胞发生的程序性的细胞死亡过程,受到严格的基因调控。能够触发细胞凋亡的途径有多种,研究比较多的是死亡受体途径和线粒体途径[12]。线粒体是细胞内ATP产生的主要地方,除了为细胞供能外,线粒体还是细胞凋亡的调控中心。线粒体通过释放细胞色素C、Apaf-1等凋亡诱导因子,激活Caspase的级联反应,从而导致细胞凋亡[13]。Caspase家族成员均为特异切割天冬氨酸位点的蛋白水解酶,迄今为止至少已发现14种,在细胞凋亡过程中起关键作用[14]。Caspase-2、8、9和10是凋亡途径上游的Caspase,为凋亡启动型Caspase,负责激活下游Caspase;Caspase-3处于凋亡级联反应的下游,负责水解凋亡效应分子,一旦活化凋亡不可逆转[15]。活化的Caspase通过灭活凋亡抑制因子、水解激活促凋亡因子Bid、直接降解细胞骨架相关蛋白等途径引起凋亡[16]。Bcl-2家族是调节细胞凋亡的线粒体相关蛋白,可分为两大类[17]:抗凋亡蛋白(主要包括Bcl-2、Bcl-xl、Bcl-w等)和促凋亡蛋白(Bax、Bak1、Bok等)。Bax是Bcl-2家族中主要的凋亡促进蛋白,活化的Bax转位到线粒体,导致线粒体膜通透性增大,释放促凋亡因子,最终引起细胞凋亡[18]。
综上所述,本研究证实,雷替曲塞可以抑制胃癌裸鼠移植瘤的生长,并激活促凋亡蛋白Caspase-3和Bax,推测雷替曲塞可能通过Caspase依赖的线粒体途径诱导MGC-803细胞凋亡。本研究可为雷替曲塞在胃癌治疗领域提供实验依据,但仍需进一步深入的研究。

