不同产地葡萄藤茎中白藜芦醇和ε-葡萄素的含量测定
宋 菲,贺凌霜,孙华庚,赵艳敏,,刘 丹,付 山,刘岱琳
白藜芦醇,化学名为3,4′,5- 三羟基二苯乙烯,广泛存在于葡萄、花生、虎杖等多种植物中,目前已发现至少在34个科、69个属、100种植物中含有该成分[1]。白藜芦醇是植物受到环境中的外界刺激或真菌、细菌感染等病理性因素攻击时产生的一种植物抗毒素。近年来,学者发现它不仅分布在葡萄果实中,而且在葡萄植株的叶片、藤茎中均有分布[2,3]。随着对白藜芦醇关注度的增加,学者陆续又从葡萄属植物的藤茎中发现了白藜芦醇的二聚体ε-葡萄素和δ-葡萄素、三聚体α-葡萄素等具有一定聚合度的葡萄素类成分[4-6]。ε-葡萄素在保护心血管、抗氧化、抗炎作用等方面都优于白藜芦醇[10],也是一个非常有潜力的多酚类代表性化合物。目前,尚没有关于葡萄藤茎中白藜芦醇和葡萄素类成分含量分布与产地关系的相关研究,本文利用HPLC建立葡萄藤茎中白藜芦醇和ε-葡萄素的含量测定方法,并对来自不同地区的六种玫瑰香葡萄藤茎中白藜芦醇和ε-葡萄素的含量进行测定分析,以期为后续以葡萄藤茎为原料提取开发白藜芦醇和ε-葡萄素提供科学依据。
1 材料与方法
1.1 主要材料和仪器 来自天津、秦皇岛和新疆三个产地的10个玫瑰香葡萄藤茎样品购自天津市尖峰天然产物研究开发有限公司。白藜芦醇和ε-葡萄素购自天津市科曼思特医药科技发展有限公司(含量95%)。甲醇购自天津市康科德科技有限公司,冰乙酸购自天津市化学试剂五厂。纯净水使用娃哈哈牌纯净水。
KQ-500型超声波清洗器(江苏昆山市超声仪器有限公司);高效液相色谱仪[(泵:LC-20AT型,检测器:SPD-M20A,柱温箱:CTO-20A,控制器:CBM-20A)日本岛津公司];AL204电子天平[梅特勒-托利多仪器(上海)有限公司];DGG-9140型电热恒温鼓风干燥箱(上海森信实验仪器有限公司)。
1.2 实验准备 准备来自天津市茶淀葡萄园、河北省秦皇岛地区葡萄园、新疆地区葡萄园获得的不同产地的玫瑰香葡萄藤茎10个样品,所有品种的葡萄植株进行分类、晾干,放入烘箱中,在40 ℃恒温下烘干4 h,然后将温度升至60 ℃继续烘干2 h后,取出粉碎,过60 目筛,密封贮于干燥器中备用。精密称取白藜芦醇标准品17.61 mg置于10 ml容量瓶中,甲醇充分溶解并定容至刻度,配成浓度为1.761 mg/ml的白藜芦醇标准品贮备液。精密称取ε-葡萄素标准品27.54 mg置于10 ml容量瓶中,甲醇充分溶解并定容至刻度,配成浓度为0.2754 mg/ml的ε-葡萄素标准品贮备液。
分别精密称取不同产地的葡萄藤原料2 g,置于100 ml棕色容量瓶中,加入60 ml甲醇回流提取2 h,取出放凉至室温,加入甲醇定容,得到样品溶液。测试前,过0.45 m微孔滤膜,吸取续滤液测定。
1.3 色谱分析条件 COSMOSIL 5C18-MS-Ⅱ色谱柱(250 mm×4.6 mm),柱温30 ℃ ,检测波长为254 nm和310 nm,进样量为20 μl。洗脱流动相:A相为1%醋酸水溶液,B相为1%醋酸甲醇溶液。洗脱梯度为:0~5 min,20%~30%B;5~15 min,30%B;15~18 min,30%~37%B;18~30 min,37%B;30~35 min,37%~50% B;35~55 min,50%B;55~58 min,50%~100%B;58~60 min,100%B;60~61 min, 100%~20%B;61~65 min, 20%B。
1.4 实验方法
1.4.1 标准曲线的制作 分别精密吸取白藜芦醇和ε-葡萄素标准品溶液1 ml,用甲醇稀释成五个不同浓度进样分析,在310 nm 波长下查看白藜芦醇标准品的峰面积,在254 nm波长下查看ε-葡萄素标准品的峰面积。分别以白藜芦醇和ε-葡萄素的质量X(μg)和峰面积Y(mAU)为纵坐标,建立线性回归方程。
1.4.2 精密度实验 分别对同一浓度的白藜芦醇标准品和ε-葡萄素标准品各重复进样6次,测定白藜芦醇和ε-葡萄素标准品的峰面积和保留时间,计算RSD值。
1.4.3 稳定性实验 取同一批的葡萄藤茎样品2 g,制备供试品溶液,按照相同色谱分析条件分别于0、2、4、6、8、10 h测定白藜芦醇和ε-葡萄素两种成分的峰面积值,计算RSD值,从而考察样品测定条件的稳定性。
1.4.4 重复性试验 取同一批的葡萄藤茎样品2 g,制备供试品溶液6份,按照相同色谱条件测定白藜芦醇和ε-葡萄素的含量,并计算RSD值,从而考察试验条件的重现性。
1.4.5 回收率实验 精密称取已知白藜芦醇和ε-葡萄素含量的葡萄藤茎样品2 g,分别加入相当于样品中白藜芦醇和ε-葡萄素含量的80%、100%、120%的对照品,配置待测溶液,按照相同色谱条件测定样品中白藜芦醇和ε-葡萄素的含量,并计算加样回收率。每组实验平行进行3次。
2 结 果
2.1 标准曲线的绘制 结果显示,白藜芦醇在1.76~17.6 μg质量范围内与峰面积呈现良好的线性关系,回归方程为Y=7.73×107X-272530,R2=0.9999。ε-葡萄素在2.75~27.54 μg范围内与峰面积呈现良好的线性关系,回归方程为Y=1.12×105X-16088,R2=0.9999。样品和标准品色谱图见图1。
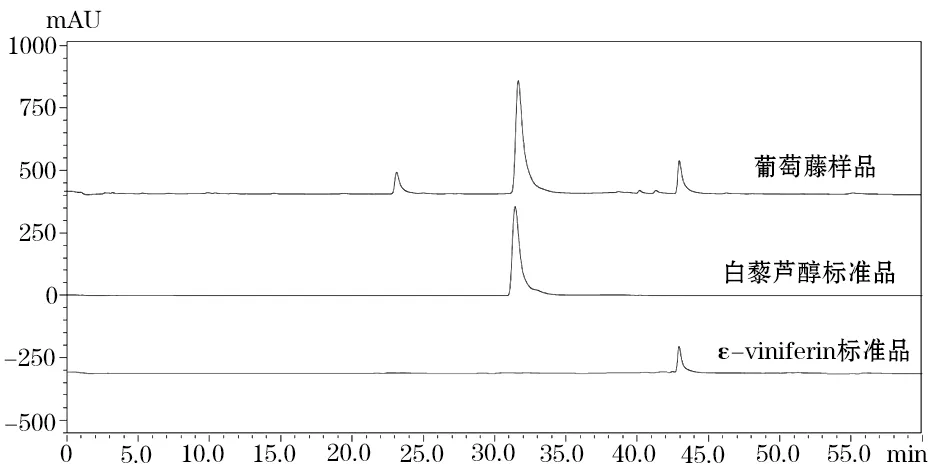
图1 葡萄藤样品和白藜芦醇、ε-葡萄素标准品的HPLC色谱图
精密度试验结果显示6次测量值的白藜芦醇的RSD=0.57%,ε-葡萄素的RSD=0.41%,表明在该条件下仪器精密度良好。稳定性试验测定结果显示葡萄藤茎样品溶液中的白藜芦醇和ε-葡萄素两种成分在10 h内稳定,其RSD值分别为1.21%和1.85%。重复性试验测定结果显示该方法重现性良好,其RSD值分别为2.11%和2.72%,符合方法学的要求。
2.2 加样回收率实验 产自新疆的玫瑰香葡萄藤茎样品的测定结果及加标回收率试验如表1所示,结果显示白藜芦醇含量为5.96 μg/g,平均回收率为102.7%,RSD为2.32%;ε-葡萄素的含量为14.62 μg/g,平均回收率为101.2%,RSD为3.54%,测试结果显示样品处理方法可以满足葡萄中白藜芦醇ε-葡萄素的测定分析。
2.3 不同产地葡萄藤茎中白藜芦醇和ε-葡萄素的含量 不同产地的葡萄藤茎中白藜芦醇和ε-葡萄素的含量测定结果见表2。
通过三个地区的10个玫瑰香葡萄藤茎的品种中白藜芦醇和ε-葡萄素的含量测定,白藜芦醇的含量范围在1.94~5.96 μg/g,平均含量为3.32 μg/g,含量的变异系数为40.64%。ε-葡萄素的含量范围在8.74~15.41 μg/g,平均含量为12.51 μg/g,含量的变异系数为17.67%。同为玫瑰香葡萄植物的藤茎,其生长环境的不同,在不同产地,其有效成分白藜芦醇和ε-葡萄素的含量差异还是较大的。
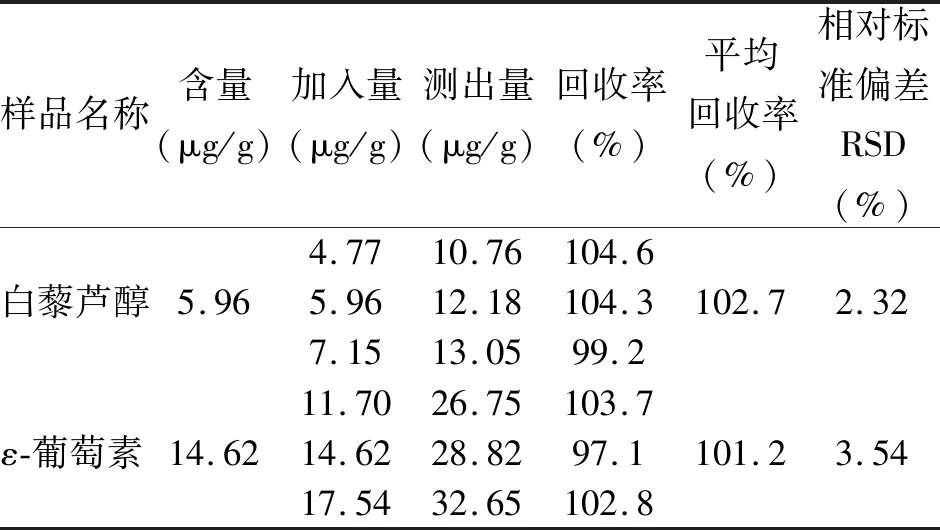
表1 白藜芦醇和ε-葡萄素加样回收率实验结果
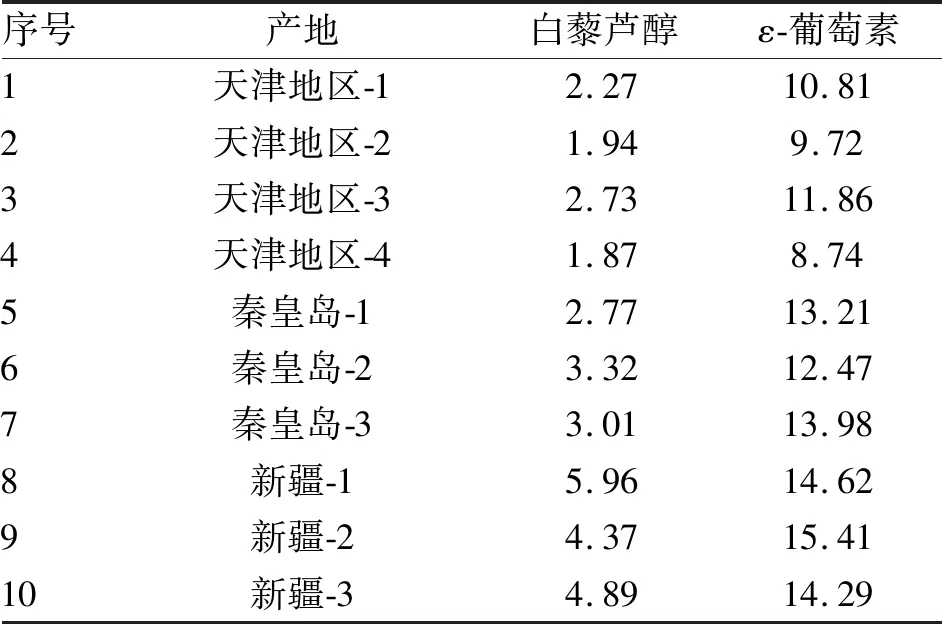
表2 不同产地的葡萄藤茎中白藜芦醇和ε-葡萄素的含量 (μg/g)
3 讨 论
试验过程中发现,葡萄藤茎样品在提取过程中采用95%乙醇和甲醇分别作为溶剂进行提取,通过比较发现甲醇的提取效率更高,因此在样品的前处理过程中选取甲醇作为提取溶剂。
葡萄果实品种不同,其白藜芦醇的含量差异也较大。周晓明等[8]测定了40余种葡萄果实中白藜芦醇的含量,品种间含量的变异系数可以达到32.5%,含量最高的是京紫晶葡萄,白藜芦醇可以达到9.041 μg/g。葡萄不同品种和组织间白藜芦醇含量差异显著,陈梦微等[9]调查了6个品种葡萄各组织中含量,发现果梗>果皮>种籽,其中金田0608和夏黑果梗白藜芦醇含量较高(22.4~22.6) μg/g,阳光玫瑰和白罗莎里奥果梗藜芦醇含量很低(1.2~1.8)μg/g,之前还有陈雷等[10]报道了米勒葡萄果皮中白藜芦醇含量很高,可以达到43.56 μg/g。这些研究多集中于葡萄果梗、果皮和种子,但是葡萄藤茎的研究相对较少,吴艳丽等[11]使用HPLC测定了药厂提供的四批山葡萄藤样品中白藜芦醇的含量,白藜芦醇的含量差异0.0641%到0.2901%,含量差异很大。杨荣艳等[12]报道了10批山葡萄藤中白藜芦醇平均含量为0.48%,但是却没有报道其中ε-葡萄素的含量。谢红旗等[13]考察了不同前处理方法对葡萄藤茎中白藜芦醇等芪类化合物的含量影响,不同的处理方法可以影响到植物中白藜芦醇等芪类化合物的含量变化。本文则首次考察了来自不同产地的10个玫瑰香葡萄的藤茎样品中白藜芦醇及其二聚体ε-葡萄素的含量,研究结果发现新疆地区产的玫瑰香葡萄的藤茎中白藜芦醇和ε-葡萄素的含量相对较高,最高值可以达到白藜芦醇5.96 μg/g,ε-葡萄素可以达到15.41 μg/g,可以作为天然白藜芦醇和ε-葡萄素开发利用的植物资源。
已有实验表明,白藜芦醇在抗肝癌、乳腺癌、结肠癌等方面具有促使癌细胞凋亡的药理作用[14-16],被喻为继“紫杉醇”之后的又一新的绿色抗癌物质[17]。徐峰等通过实验证明白藜芦醇能够降低高糖环境下原代大鼠系膜细胞的炎性反应和细胞增殖,有效减轻糖尿病肾炎,同时,在治疗慢性肾功能衰竭常用注射剂肾炎康[18]中也提取到了有效成分白藜芦醇-4′-O-葡萄糖苷。综上所述,白藜芦醇作为一种天然的多酚类化合物具有抗氧化、抗菌、抗癌、降血脂、保护心血管、延缓衰老、提高机体免疫力等多种功效[19,20],其在医药、保健食品领域具有很广阔的开发前景。本研究结果为葡萄藤茎提取白藜芦醇的开发利用提供了实验依据。

