小窝蛋白-1重组慢病毒载体的构建及鉴定
董雷 马春芳 蔡宛如
小窝蛋白-1(caveolin-1,Cav-1)是细胞膜上膜内陷型胞膜囊泡-小窝的结构和功能性标志蛋白,在细胞信号转导、胆固醇转运、细胞内吞等方面发挥重要作用[1]。Cav-1广泛存在于肺泡Ⅰ型上皮细胞膜上。近年研究发现Cav-1在急性肺损伤肺水肿发病始动机制中起重要作用,与肺泡上皮细胞通透性、钠水转运有关[2]。本课题组前期研究结果也表明Cav-1在小鼠急性肺损伤时的表达水平明显高于正常小鼠[3],这提示Cav-1在急性肺损伤发病中起重要作用。本研究试图构建Cav-1重组慢病毒,并验证其在293T细胞中的表达,以期为构建Cav-1高表达的急性肺损伤动物模型提供实验材料。
1 材料和方法
1.1 材料
1.1.1 细胞和质粒 293T细胞购于上海ATCC细胞库,大肠杆菌DH5α、GV287慢病毒载体购自上海吉凯基因公司。
1.1.2 实验动物 清洁级雄性C57BL6小鼠24只购于上海斯莱克公司。
1.2 主要试剂和仪器 1kp DNA ladder Marker(批号:#SM0311)购于加拿大Fermentas公司,250bp DNA ladder Marker(批号:DL250+,100T)购于上海捷瑞公司,琼脂糖(批号:GA4-100)购于上海赛百盛基因技术有限公司,Taq酶、dNTP、内切酶等购于大连TAKARA公司,In-FusionTMPCR Cloning Kit(批号:63962)购于美国Clontech公司,质粒抽提试剂盒(批号:A1460)购于美国Promega公司,FBS、DMEM细胞培养试剂购于美国Gibco公司,invitrogen lipofectamine 2000转染试剂购于美国 invitrogen公司,Cav-1(D46G3)X 兔单抗和 β-actin抗体购于美国CST公司。PCR仪(型号:2720 thermal cycler)购于美国Applied Biosystems公司,稳压DNA电泳仪购于美国Bio-Rad公司,凝胶成像仪购于上海天能科技有限公司,细菌摇床(型号:HI-9211K)购于华利达实验设备公司。
1.3 方法
1.3.1 Cav-1重组慢病毒质粒的构建和检验 慢病毒载体GV287原件顺序为Ubi-MCS-3FLAG-SV40-EGFP,克隆位点为BamHI/BamHI。根据目的基因Cav-1(NM_007616)设计 PCR 引物,上游引物:5′-GGAGGTAGTGGAATGGATCCCGCCACCATGTCTGGGGGCAAATACGTAG-3′,下游引物:5′-TCACCATGGTGGCGGGATCTATCTCTTTCTGCGTGCTGATGC-3′。该引物已含交换配对碱基、酶切位点,并含有目的基因5′端部分序列用于PCR钓取目的基因。采用PCR法获取Cav-1基因。慢病毒质粒经酶切后琼脂糖电泳回收,PCR产物Cav-1基因交换入线性GV287慢病毒质粒,克隆成Cav-1重组慢病毒质粒。经过PCR鉴定,鉴定引物为Globin-F 上游引物:5′-ATTCTGAGTCCAAGCTAGGC-3′,pEGFP-N-3 下游引物:5′-CGTCGCCGTCCAGCTCGACCAG-3′,筛选出阳性克隆。用氯化钙制备新鲜大肠杆菌DH5α感受态细胞,对阳性克隆进行测序鉴定。
1.3.2 Cav-1重组慢病毒的包装 将处于对数生长期的293T细胞接种于24孔板中,每孔细胞数约为2×104/ml,37℃、5%CO2培养箱培养至细胞融合度达到约80%。按照invitrogen lipofectamine 2000转染试剂使用说明转染293T细胞,转染6h后更换新鲜的完全培养基。1.3.3 Cav-1重组慢病毒的功能测定 转染293T细胞24h后,观察质粒上荧光标记基因的表达情况,若荧光率>80%,拍完荧光后补加500μl正常培养基,待长满后收集细胞用于RNA提取或蛋白质检测。
1.3.4 293T细胞中Cav-1蛋白表达水平检测 采用Western blot法收集转染后24h的293T细胞,在冰浴条件下用细胞裂解液裂解细胞,13 000r/min低温离心,收集上清液煮沸备用。取20μg上样量用10%SDS-PAGE电泳分离,400mA 1.5h转至PVDF膜,用5%BSA封闭2h,Cav-1(1∶1 000)4℃孵育过夜,次日 TBST 洗涤后,用标记二抗(1∶1 000)孵育 2h 后显影。
1.3.5 Cav-1重组慢病毒质粒的收集、浓缩及滴度测定收集富含病毒的细胞上清液,密度梯度离心和超滤去除绝大部分细胞蛋白,浓缩后得到高浓度重组慢病毒,分装保存于-80℃。取少量采用实时定量PCR法测定病毒滴度,用质粒作为标准品设立标准曲线,待测样品与标准曲线比较后,得到Cav-1重组慢病毒的滴度。
1.3.6 Cav-1重组慢病毒质粒转染小鼠 将24只C57BL6 小鼠分为阴性对照组、1×108pfu/鼠组、5×108pfu/鼠组和10×108pfu/鼠组4组,每组6只。所有小鼠均采用乙醚麻醉,固定头部使鼻腔垂直向上。阴性对照组用1×108pfu/鼠浓度的Cav-1空载体病毒经鼻腔滴注至肺内,对肺组织中的支气管平滑肌细胞、肺泡上皮细胞和血管内皮细胞进行转染;1×108pfu/鼠组、5×108pfu/鼠组和 10×108pfu/鼠组分别采用 1×108pfu/鼠、5×108pfu/鼠、10×108pfu/鼠3个梯度的重组慢病毒Cav-1经鼻腔滴注至肺内进行转染,3d后采用免疫组化法检测肺组织中Cav-1的表达情况。
2 结果
2.1 目的载体酶切结果以及目的基因获取 慢病毒载体经BamHI酶切电泳后,为6kb左右的载体片段(图1)。目的基因 Cav-1(NM_007616)经 PCR扩增后获得580bp的片段(图2)。
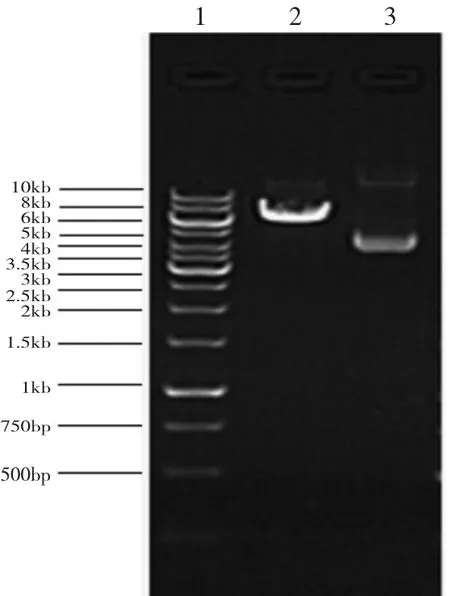
图1 目的载体酶切电泳图(1:10kb Marker;2:载体酶切电泳;3:未酶切载体电泳)
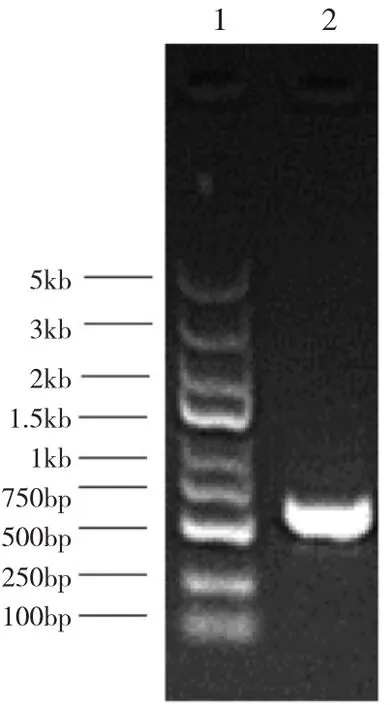
图2 目的基因Cav-1 PCR产物电泳图(1:Marker;2:Cav-1 产物)
2.2 Cav-1重组慢病毒构建及PCR扩增鉴定测序 PCR产物交换入线性化表达载体,PCR鉴定的阳性转化子为805bp(图3),经过测序鉴定,序列正确。
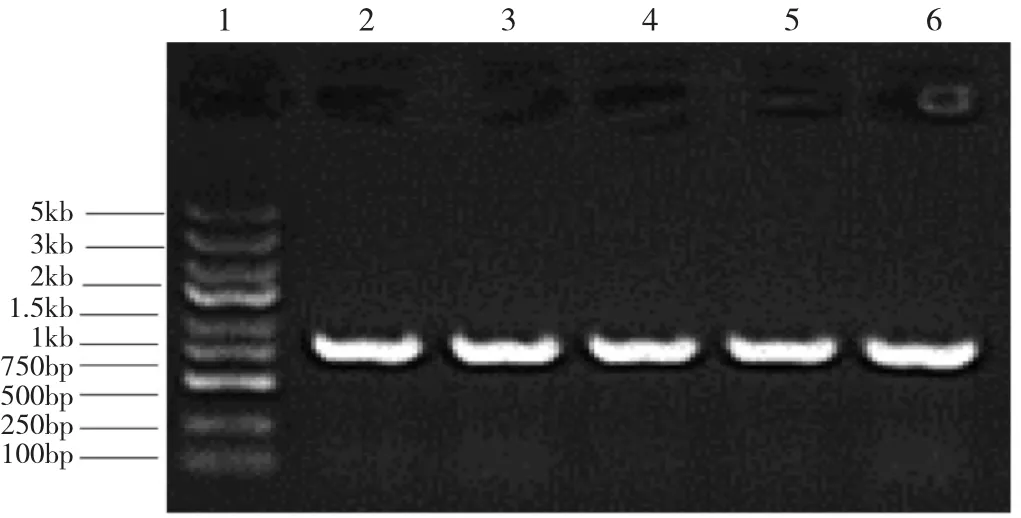
图 3 PCR 扩增鉴定结果(1:Marker;2~6:阳性转化子)
2.3 Cav-1重组慢病毒转染293T细胞及鉴定 Cav-1重组慢病毒转染293T细胞后进行荧光检测,细胞内可观察到明显的荧光(图4),说明目的质粒转染正常、目的质粒荧光标记基因表达正常。Western blot法检测293T细胞Cav-1蛋白表达,目的基因融合蛋白大小为48kd,结果可见48kd附近有特征条带,与目的基因融合蛋白相吻合(图5)。
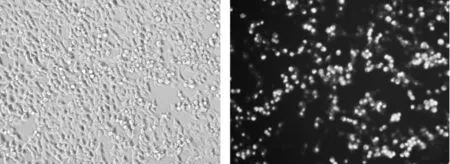
图4 Cav-1重组慢病毒转染293T细胞的荧光检测(a:明场;b:暗场;荧光显微镜下,×200)

图 5 Western blot法检测 Cav-1蛋白表达(M:蛋白 Marker;1:SURVIVIN-3FLAG-GFP阳性对照;2:未转染293T细胞样品;3:Cav-1重组慢病毒转染293T后样品)
2.4 Cav-1重组慢病毒滴度测定 实时定量PCR法检测重组慢病毒滴度,结果得出Cav-1重组慢病毒滴度为1.3×1012copies/ml。
2.5 Cav-1重组慢病毒在动物体内的验证 Cav-1重组慢病毒转染3d后,免疫荧光显示,小鼠肺组织结构正常,Cav-1在平滑肌细胞、肺泡上皮细胞和血管内皮细胞呈现表达,其中阴性对照组Cav-1表达稍微弱,随着Cav-1重组慢病毒在小鼠体内的浓度升高,其肺组织中Cav-1 表达也逐渐增高,其中 5×108pfu/鼠组、10×108pfu/鼠组转染后肺组织Cav-1表达水平均明显高于1×108pfu/鼠组和阴性对照组(图6)。
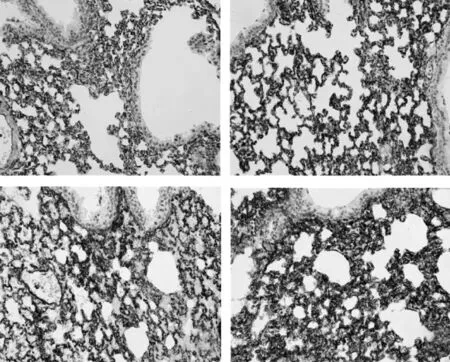
图6 慢病毒转染小鼠体内肺组织中Cav-1的表达情况(a:阴性对照组;b:1×108pfu/鼠组;c:5×108pfu/鼠组;d:10×108pfu/鼠组;免疫组化法,×400)
3 讨论
急性肺损伤/急性呼吸窘迫综合征的发病过程极其复杂,其机制尚未完全明了,但目前认为肺泡上皮屏障的破坏是其重要的发病机制之一,即肺泡上皮细胞的弥漫性损害,肺泡表面活性物质减少,基底膜通透性增加,导致肺脏实质细胞损伤和肺间质水肿[2]。Cav-1是肺泡上皮细胞膜上小窝的主要结构蛋白,处于细胞各路信息平台的中心位置,使得各路信号通路之间相互影响成为可能[4]。当肺泡上皮细胞受到外界有害物质(如脂多糖)侵袭后,首先激活的是位于细胞膜小窝内的磷脂酶A2(PLA2),水解肺泡上皮细胞膜磷脂,造成膜结构和功能破坏,导致渗透性肺水肿;其次PLA2启动炎症介质生成,促进炎症介质聚集和活化,并作用于其他细胞如肺泡巨噬细胞、肺血管内皮细胞、中性粒细胞等效应细胞,释放各类炎症介质如TNF-α、IL-6等[5-6]。这些炎症介质又可激活小窝内各类络氨酸膜类受体及下游分子、G蛋白偶联受体及下游分子、非受体类络氨酸激酶等。这其中Cav-1通过其“脚手架”结构域与各信号通路起到了调节信号传导互通的功能。因此Cav-1在急性肺损伤炎症反应中起重要作用。
本实验成功构建Cav-1重组慢病毒,为进一步建立过表达Cav-1的肺泡上皮细胞株及动物小鼠C57BL6的肺损伤模型,研究Cav-1在急性肺损伤中肺泡Ⅰ型上皮细胞炎症反应中的作用以及与各信号通路之间的作用和关系提供了实验依据。
——一道江苏高考题的奥秘解读和拓展

