川芎嗪对创伤性颅脑损伤大鼠的保护作用及机制研究
易润青 全向阳
【摘要】 目的:觀察川芎嗪对创伤性颅脑损伤的保护作用及其机制。方法:选取72只雄性SD大鼠,采用PCI3000建立创伤性颅脑损伤模型,造模成功后随机分为模型组(n=15)、川芎嗪低剂量(10 mg/kg)组(n=15)、川芎嗪中剂量(20 mg/kg)组(n=15)、川芎嗪高剂量(40 mg/kg)组(n=15),同时建立假手术组(n=12)作为对照。川芎嗪三个剂量组分别尾静脉注射给予相应剂量的盐酸川芎嗪注射液,1次/d,连续7 d,模型组和假手术组给予等体积的生理盐水。给药第2、4、6、8天分别进行转棒试验和纸条粘附试验,第8天大鼠安乐死后取材进行NeuN神经元免疫组化染色和凋亡相关蛋白检测。结果:川芎嗪中、高剂量组大鼠转棒时间和纸条撕掉时间均短于模型组,差异均有统计学意义(P<0.05);川芎嗪中、高剂量组脑梗死体积分别为(16.50±2.59)、(14.10±2.29)mm3,与模型组比较,差异均有统计学意义(P<0.05)。免疫组化染色发现川芎嗪高剂量组和模型组TBI大鼠损伤区周围皮层神经元细胞存活数目分别为(290.70±41.19)和(225.00±59.44)个,两组比较差异有统计学意义(P<0.05);Westernblot研究可见,与模型组相比,川芎嗪高剂量组Bax蛋白表达降低、Bcl-2蛋白表达升高、Bcl-2/Bax比例升高,差异均有统计学意义(P<0.05)。结论:川芎嗪对创伤性颅脑损伤大鼠具有很好的保护作用,其机制可能与其抑制神经细胞凋亡保护神经细胞损伤有关。
【关键词】 川芎嗪; 创伤性颅脑损伤; 氧化应激; 细胞凋亡
【Abstract】 Objective:To observe the protective effect and mechanism of tetramethylpyrazine on traumatic craniocerebral injury.Method:72 male SD rats were selected and PCI3000 was used to establish the traumatic craniocerebral injury model,after successful modeling,they were randomly divided into the model group(n=15),the low dose(10 mg/kg)group(n=15),the medium dose(20 mg/kg)group(n=15),and the high dose(40 mg/kg)group(n=15),meanwhile,the sham operation group(n=12)was established as the control.Tetramethylpyrazine Hydrochloride Injection was injected into the tail vein of three dose groups,1 time/day for 7 days.The model group and the sham group were given equal volume saline.Rod transfer test and strip adhesion test were performed on days 2,4,6 and 8 after administration,after the rats were euthanized on day 8,NeuN neuron immunohistochemical staining and apoptosis-related protein detection were performed.Result:The rotarod test time and adhesive paper removal time in the tetramethylpyrazine medium group and the high dose group were significantly shorter than those in TBI model group,the differences were statistically significant(P<0.05).Brain infarction volume was(16.50±2.59)mm3 and(14.10±2.29)mm3 in the tetramethylpyrazine medium dose group and high dose group,which were significantly decreased compared with model group(P<0.05).Immunohistochemistry study showed that the NeuN+ neurons in the periphery area of TBI injury were(290.70±41.19)and(225.00±59.44)in the tetramethylpyrazine high dose group and model group,the difference between the two groups was statistically significant(P<0.05).Western blot results displayed that,in tetramethylpyrazine high dose group,the Bax protein expression markedly decreased,Bcl-2 protein expression and the ratio of Bcl-2/Bax also obviously increased compared with than those of the model group(P<0.05).Conclusion:Tetramethylpyrazine has a good protective effect on rats with traumatic brain injury and its mechanism may be related to the inhibition of apoptosis and the protection of nerve cell injury,Tetramethylpyrazine has a protective effect on rats with traumatic brain injury,which may be related to its inhibition of apoptosis.
【Key words】 Tetramethylpyrazine; Traumatic brain injury; Oxidative stress; Apoptosis
First-authors address:Guangzhou Medical Vocationl School,Guangzhou 510430,China
doi:10.3969/j.issn.1674-4985.2019.17.007
創伤性颅脑损伤(traumatic brain injury,TBI)是神经外科常见疾病。全球患病人数约为3 000多万,每年死亡人数高于100万。在中国,每年约有100万TBI患者,死亡人数近十万余人。TBI治疗除了手术和常规对症治疗外,尚无有效的治疗手段。TBI发病机制主要为直接创伤性颅脑损伤和继发的氧化应激损伤、细胞钙超载、血管应激性痉挛、氨基酸兴奋性毒性等[1],导致神经细胞死亡、神经传递功能障碍并最终引起神经功能的缺损。由于TBI发病机制复杂,单一靶点药物药效有限,而多个靶点的药物可能对TBI治疗具有很好的作用。川芎嗪(tetramethylpyrazine,TMP)是中药川芎的有效成分,其作用机制主要包括抑制钙超载、清除自由基、舒张血管、抑制细胞凋亡、改善线粒体功能、抑制细胞炎性反应等多种作用,临床上主要用于缺血性脑卒中的治疗[2]。近年来研究还发现川芎嗪还可以缓解蛛网膜下腔出血血管痉挛[3],提示川芎嗪有可能对TBI具有很好的治疗作用。然而目前尚未见川芎嗪对创伤性颅脑损伤的治疗作用的研究报道,本研究旨在探讨川芎嗪治疗TBI的作用及其机制,为临床应用提供实验依据。现将研究结果报道如下。
1 材料与方法
1.1 实验药物与主要试剂 盐酸川芎嗪注射液(生产厂家:郑州卓峰制药有限公司,批准文号:国药准字H20055479,规格:2 mL︰40 mg);0.9%氯化钠注射液(生产厂家:山东齐都药业有限公司);Neu一抗购于Millipore公司;GFAP一抗、Bcl-2一抗、Bax一抗、Caspase-3一抗购于CST公司、GTVisionTM免疫组化检测试剂盒购于上海基因科技有限公司。
1.2 仪器设备 PCI-3000颅脑损伤仪(Hatteras);异氟烷麻醉系统(深圳市瑞沃德生命科技有限公司);PL3001天平(梅特勒-特利多);大鼠转棒仪(淮北正华生物仪器设备有限公司);164-5050电泳仪(Bio-Rad);IS4000MM蛋白凝胶成像系统(Carestream)。
1.3 实验动物 雄性SD大鼠72只,体重300~350 g,购于广东省医学实验动物中心,生产许可证号:SCXK(粤)2013-0002。大鼠饲养于SPF级实验动物中心,正常饲养。
1.4 实验方法
1.4.1 TBI模型建立 SD大鼠造模前禁食不禁水至少10 h,采用异氟烷麻醉后规定到大鼠立体定位仪上,以大鼠前囟后右侧旁开2 mm为起点,在前囟与后囟之间开约25 mm2骨窗。采用PCI3000颅脑损伤仪造模,选择直径为5 mm撞针,撞击参数按照文献[4]设定为速度1.5 m/s、深度5 mm、停留时间120 ms。假手术组仅开颅不采用颅脑损伤仪造模。术后缝合切口、碘伏消毒后放回SPF动物中心继续正常饲养。
1.4.2 大鼠分组与给药 大鼠TBI造模后随机分为4组,模型组、川芎嗪低剂量(10 mg/kg)组、中剂量(20 mg/kg)组、高剂量(40 mg/kg)组,同时采用假手术大鼠作为对照(给予0.9%氯化钠注射液),其中假手术组12只大鼠,其余每组15只大鼠。大鼠按照每组平均体重计算给药量,每组大鼠按照川芎嗪低剂量组给药体积调整每组的给药体积,保证每只大鼠给药体积相当。TBI大鼠造模后当日立即尾静脉注射给药1次,之后每日早上给药一次,连续给药7 d。
1.4.3 大鼠转棒实验行为学评价 大鼠在动物房饲养3 d后,参照文献[5-6]连续3 d进行大鼠转棒实验训练,排除不合格大鼠后造模,并记录训练第3天合格大鼠的转棒时间。造模后2 h和给药第2、4、6、8天分别进行测试,评价大鼠综合运动能力。
1.4.4 大鼠纸条粘附实验评价 参照文献[7]制作1 cm宽,4 cm长的80 g打印纸纸条,纸条末端采用双面胶环形固定到左前肢上,记录大鼠撕去纸条时间。实验记录大鼠造模前、造模后2 h和给药第2、4、6、8天纸条撕去时间,评估大鼠感觉和协调运动能力。
1.4.5 取材 实验第8天行为学评价后,大鼠采用吸入过量异氟烷安乐死,6只大鼠取右侧前囟前-1 mm位置到前囟后6 mm的脑组织进行OCT包埋;剩余大鼠取右侧前囟前-2 mm位置到前囟后7 mm的脑组织放于-80 ℃保存,用于Western blot实验。
1.4.6 焦油紫染色 OCT包埋脑组织进行冰冻切片,切片厚度20 ?m,每隔200 ?m保留一张切片,然后所有冰冻切片进行焦油紫染色。切片室温干燥后进行扫描,应用Image J软件计算TBI损伤体积[8]。
1.4.7 免疫组化染色 在准备焦油紫切片的时候,在大鼠前囟后2 mm位置进行脑组织冰冻切片,切片厚度10 ?m,4 ℃预冷的多聚甲醛固定15 min后进行免疫组化染色。Triton通透后进行BSA封闭,然后孵育NeuN(1︰500)和GFAP(1︰400)一抗和按照试剂盒滴加辣根过氧化物酶标记的二抗,DAB显色后用荧光显微镜拍照,计数大鼠皮层NeuN和GFAP阳性细胞数目[9]。
1.4.8 凋亡蛋白检测 提取脑组织蛋白,BCA定量后进行凝胶电泳,分别过夜孵育Bcl-2(1︰1 000)、Bax(1︰1 000)、Caspase-3(1︰500)、β-actin(1︰1 000)一抗,洗膜后孵育二抗(1︰2 000),ECL发光液显影,应用Carestream MI系统进行图像分析[10]。
1.5 统计学处理 采用SPSS 20.0软件对所得数据进行统计分析,计量资料用(x±s)表示,大鼠转棒时间、纸条粘附试验行为学评分采用重复测量(general linear model-repeated measures)进行统计分析,大鼠体重、细胞计数和分子生物学数据采用One-ANOVA Dunnett进行检验,P<0.05表示差异有统计学意义。
2 结果
2.1 各组一般资料比较 造模前,假手术组、模型组和川芎嗪低、中、高剂量组大鼠体重分别为(322.8±14.8)、(324.5±16.3)、(326.7±18.1)、(325.4±14.4)、(327.5±15.9)g,各组大鼠体重比较,差异无统计学意义(P>0.05)。
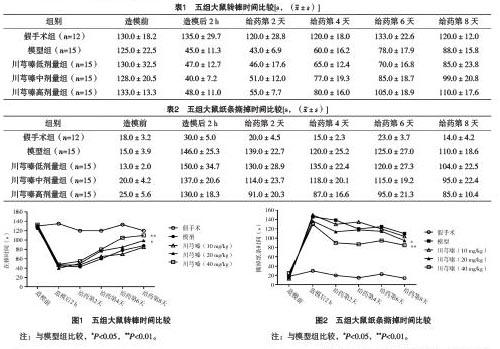
2.2 五组大鼠转棒时间比较 造模后2 h,模型组和川芎嗪低、中、高剂量组大鼠的转棒时间与假手术组比较均下降,差异均有统计学意义(P<0.05)。随后连续给药一周进行行为学重复测量,川芎嗪高剂量组与模型组相比,差异有统计学意义(P<0.01),川芎嗪中剂量组与模型组转棒时间比较,差异有统计学意义(P<0.05),但是川芎嗪低剂量组与模型组转棒时间比较,差异无统计学意义(P>0.05)。见表1和图1。
2.3 TBI大鼠纸条粘附试验撕掉纸条时间比较 大鼠TBI造模后2 h,模型组大鼠和川芎嗪低、中、高剂量组大鼠纸条撕掉时间与造模前相比均显著延长,差异均有统计学意义(P<0.001)。连续给药1周,川芎嗪中、高剂量组的纸条撕掉时间均较其造模后2 h缩短,且与模型组比较,差异均有统计学意义(P<0.05)。见表2和图2。
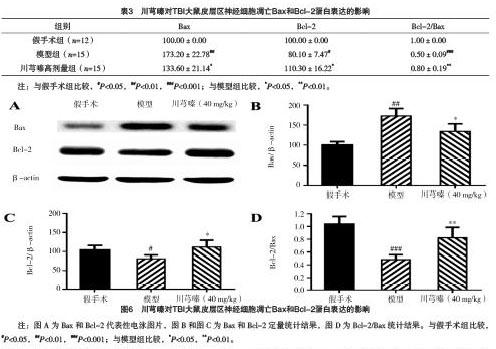
2.4 五组TBI大鼠脑损伤体积比较 模型组TBI大鼠脑损伤体积为(24.0±8.2)mm3,川芎嗪低、中、高剂量组TBI大鼠脑损伤体积分别为(23.20±5.81)、(16.50±2.59)、(14.10±2.29)mm3,川芎嗪高、中剂量组TBI大鼠的脑损伤体积与模型组比较,差异均有统计学意义(P=0.028、0.005),见图3。
2.5 三组大鼠皮层梗死区周围神经元数目比较 采用免疫组化观察TBI大鼠损伤区周围2 mm区域的NeuN阳性细胞数目,模型组神经元数目为(225.00±59.44)个,假手术组的神经元数目(337.00±57.05)个,两组比较差异有统计学意义(P=0.007),川芎嗪高剂量组的神经元数目为(290.70±41.19)个,与模型组比较,差异有统计学意义(P=0.047)。川芎嗪高剂量组神经元数目与假手术组比较,差异无统计学意义(P>0.05)。见图4、5。
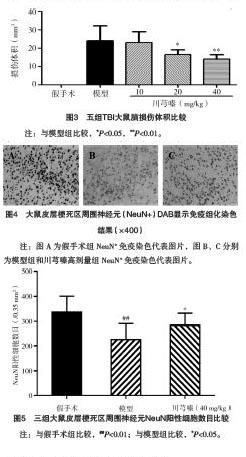
2.6 川芎嗪对TBI大鼠皮层区神经细胞凋亡Bax和Bcl-2蛋白表达的影响 模型组促凋亡蛋白Bax表达高于假手术组,川芎嗪高剂量组的Bax蛋白表达较模型组显著降低,差异均有统计学意义(P<0.05);模型组抑制细胞凋亡蛋白Bcl-2表达低于假手术组,川芎嗪高剂量组Bcl-2蛋白表达高于模型组,差异均有统计学意义(P<0.05)。模型组Bcl-2/Bax表达比例较假手术组显著降低(P<0.05),模型组存在严重的神经细胞凋亡;川芎嗪高剂量组的Bcl-2/Bax蛋白表达显著高于模型组(P<0.05)。见表3和图6。
3 讨论
创伤性颅脑损伤(TBI)是发达国家青年和儿童死亡的首要病因,但缺乏有效的治疗措施[11]。病理生理研究发现TBI损伤包括原发性颅脑损伤和继发性损伤。原发性颅脑损伤机制为局部脑组织因外力直接导致位移引起局部微循环障碍和神经细胞损伤;继发性颅脑损伤是由于脑组织因密度不同不对等移动,引起神经组织损伤局部脑组织微撕裂血液供应障碍等。无论哪种形式的损伤,神经细胞均会伴随着钙超载、氧化应激、细胞凋亡、炎性反应等分子水平的改变,最终导致神经细胞损伤或死亡,引起机体相应的神经功能障碍[1,12]。由于TBI细胞损伤机制复杂,单一靶点药物很难改善其症状,因此寻求多靶点药物可能为TBI治疗带来希望[13]。
川芎作为传统中药在我国临床应用有两千多年历史,具有活血行气、消散瘀血、祛风止痛之功效。川芎嗪是中药川芎的有效成分之一,临床用于缺血性脑血管疾病、心血管疾病和缺血再灌注损伤等疾病[14]。川芎嗪药理活性包括抑制L-钙通道、清除自由基降低氧化應激、抑制细胞凋亡、降低炎性反应、抑制血小板聚集等多种作用机制[2],更重要的是药代研究发现川芎嗪具有非常好的血脑屏障通透率[15-16],在临床得到广泛应用。因此,川芎嗪可能对创伤性颅脑损伤具有很好的保护作用。
Liao等[5]在缺血性脑卒中模型中探索了川芎嗪的治疗剂量,川芎嗪在10、20、40 mg/kg剂量下对缺血脑卒中大鼠具有剂量依赖性的保护作用,因此本实验选择这三个剂量用于其保护TBI药理活性研究。实验结果可见,川芎嗪在20、40 mg/kg剂量下可以非常显著的缩短纸条撕掉时间,说明川芎嗪可以显著改善TBI大鼠神经功能缺损症状,降低TBI大鼠脑损伤体积,但是其低剂量10 mg/kg未见保护作用,可能与TBI发病机制较脑卒中更复杂有关。由于40 mg/kg川芎嗪展示出更好的神经保护作用,笔者对40 mg/kg组的TBI大鼠进行进一步机制研究。采用NeuN神经元细胞特异性的免疫组化,观察TBI大鼠损伤区外2 mm位置的神经元细胞损伤情况,可见模型组缺损周边神经细胞数目较假手术组显著降低,说明创伤性颅脑损伤除了原发性的外力直接导致损伤外,其他继发性损伤机制同样参与了神经细胞的损伤。而给予川芎嗪后,存活的神经细胞数目显著增加,川芎嗪改善TBI大鼠神经功能缺损症状可能与其神经细胞保护作用有关。细胞凋亡是TBI神经细胞损伤主要的下游信号调控通路之一,并且有研究表明川芎嗪可以通过抑制细胞凋亡保护神经细胞损伤[17],本实验针对凋亡关键蛋白抑制凋亡蛋白Bcl-2和促凋亡蛋白Bax进行WB检测,川芎嗪可以显著的降低TBI大鼠Bax蛋白表达和增加Bcl-2表达,逆转Bcl-2/Bax比例,可以显著抑制神经细胞凋亡,这可能是其保护神经细胞损伤改善其功能的其中一种机制。
川芎嗪由于具有一定的抑制血栓形成和抑制血小板聚集作用[18-19],因此臨床上对于出血风险的患者慎用或禁用。笔者综合分析川芎嗪抑制血小板聚集作用,其药理活性浓度范围为0.5~1.5 mM[18],而大鼠静脉注射给予40 mg/kg的川芎嗪,其最大血药浓度约为64 ?M[15],远低于川芎嗪抑制血小板聚集的最低药理活性浓度500 ?M。本实验发现川芎嗪在20、40 mg/kg均可以显著保护TBI大鼠脑损伤,而在该剂量下,川芎嗪没有抑制血小板聚集活性,具有很好的安全性。同时有研究报道,健康人口服给予200 mg的磷酸川芎嗪片最大血药浓度为9.4 ?M[20],同样也远低于其抑制血小板最低药物浓度。人体该给药剂量换算为大鼠给药等效剂量约为20 mg/kg,在该剂量下川芎嗪具有很好的改善TBI神经缺损症状,说明川芎嗪在其有效的治疗范围内具有较高的安全性,值得临床进一步开发应用。
参考文献
[1] Corps K N,Roth T L,McGavern D B.Inflammation and neuroprotection in traumatic brain injury[J].JAMA Neurol,2015,72(3):355-362.
[2] Zhao Y,Liu Y,Chen K.Mechanisms and Clinical Application of Tetramethylpyrazine(an Interesting Natural Compound Isolated from Ligusticum Wallichii):Current Status and Perspective[J].Oxid Med Cell Longev,2016,2016:2124638.
[3]宫有文,吕延锋.颅内动脉瘤性蛛网膜下腔出血血管痉挛治疗的临床探讨[J].中国实用神经疾病杂志,2015,18(18):66-67.
[4] d'Avila J C,Lam T I,Bingham D,et al.Microglial activation induced by brain trauma is suppressed by post-injury treatment with a PARP inhibitor[J].J Neuroinflammation,2012,9:31.
[5] Liao S L,Kao T K,Chen W Y,et al.Tetramethylpyrazine reduces ischemic brain injury in rats[J].Neurosci Lett,2004,372(1-2):40-45.
[6] Hamm R J.Neurobehavioral assessment of outcome following traumatic brain injury in rats:an evaluation of selected measures[J].J Neurotrauma,2001,18(11):1207-1216.
[7] Thompson H J,Marklund N,LeBold D G,et al.Tissue sparing and functional recovery following experimental traumatic brain injury is provided by treatment with an anti-myelin-associated glycoprotein antibody[J].Eur J Neurosci,2006,24(11):3063-3072.
[8] Lu H,Wang Y,He X,et al.Netrin-1 hyperexpression in mouse brain promotes angiogenesis and long-term neurological recovery after transient focal ischemia[J].Stroke,2012,43(3):838-843.
[9] Tezer F I,Firat A,Tuzun E,et al.Immunopathology in drug resistant mesial temporal lobe epilepsy with different types of hippocampal sclerosis[J].Int J Neurosci,2018,128(5):421-428.
[10] Shao Z,Wu P,Wang X,et al.Tetramethylpyrazine Protects Against Early Brain Injury and Inhibits the PERK/Akt Pathway in a Rat Model of Subarachnoid Hemorrhage[J].Neurochem Res,2018,43(8):1650-1659.
[11] Davanzo J R,Sieg E P,Timmons S D.Management of Traumatic Brain Injury[J].Surg Clin North Am,2017,97(6):1237-1253.
[12] Oleary R A,Nichol A D.Pathophysiology of severe traumatic brain injury[J].J Neurosurg Sci,2018,62(5):542-548.
[13] Kaur P,Sharma S.Recent Advances in Pathophysiology of Traumatic Brain Injury[J].Curr Neuropharmacol,2018,16(8):1224-1238.

