常见菌草食(药)用菌真菌性病原菌鉴定及生物学特性*
刘欣怡,雷雅婷,李 晶,鲁国东,3,刘 斌,4,林占熺**
(1.福建农林大学生命科学学院,福建 福州 350002;2.国家菌草工程技术研究中心,福建 福州 350002;3.福建农林大学植物保护学院,福建 福州 350002;4.福建农林大学食品科学学院,福建 福州 350013)
我国是世界最大的食(药) 用菌生产和消费大国,然而传统的食(药)用菌栽培以阔叶树为主要原料。据不完全统计每年至少有超4×106m3木材作为食(药) 用菌栽培原料被消耗,造成了严重的“菌林矛盾”,严重制约菌业的可持续发展[1]。为了解决菌业发展中的瓶颈问题,福建农林大学林占熺团队开展利用芒萁、类芦、斑茅、五节芒等野生草本植物,替代阔叶树栽培香菇等食(药)用菌的研究,并于1986年获得成功。打破了“草腐菌”与“木腐菌”的界限,开创菌草研究新领域,开辟生态建设新途径,创建菌草技术新体系,推动新兴产业菌草业的发展,为菌草科学研究奠定了基础。菌草栽培食用菌技术经过30多年的推广应用,到目前已筛选出45种菌草栽培55种食(药) 用菌,缓解了“菌林矛盾”[2]。
菌草食(药)用菌是指通过三级筛选的多种菌草配伍作为培养基栽培的食(药)用菌。从感官评价和仪器质构分析,菌草食(药)用菌的适口性更强。聂国添等[3]利用质构分析仪,分析比较以五节芒为主料栽培和常规栽培的糙皮侧耳子实体的质构,结果以五节芒为主料栽培的糙皮侧耳子实体的菌盖咀嚼性、硬度和回复性以及菌柄回复性、硬度、内聚性和咀嚼性,比常规以棉籽壳培养料栽培的子实体相对较低。从营养成分来看,菌草食(药)用菌的营养成分均高于其他栽培料栽培的食(药)用菌。战琨友[4]分析菌草香菇的营养成分,结果发现粗蛋白含量是木屑香菇的1.9倍,有效多糖含量是木屑香菇的3.25倍,粗纤维素的含量比木屑香菇中的低,氨基酸总量和必需氨基酸比木屑香菇略高。蔡杨星等[5]分析菌草栽培猴头菇子实体的粗蛋白、灰分、氨基酸总量分别是传统木屑栽培的1.14倍、1.08倍、1.04倍,粗脂肪和总糖含量近似于传统木屑栽培。曹秀明[6]研究了菌草灰树花的粗蛋白、粗脂肪、氨基酸及灰分含量均高于木屑栽培的灰树花。从食(药)用菌含有的功能性物质方面来看,菌草食(药)用菌含有的多糖、多糖肽以及三萜类物质均高于其他栽培料。陈凌华等[7]研究比较了菌草灵芝功能物质的组分和结构,结果表明菌草灵芝多糖、多糖肽和三萜类物质等功能性成分的含量、溶出率均高于或类似于其他栽培料的灵芝。从已有的研究结果分析,菌草食(药)用菌的口感、营养成分以及含有的功能性物质等同于或优于其他方式栽培食(药)用菌。
随着菌草技术在国内外的大面积推广和应用,在其生产的各阶段过程中产生多种病害,从而出现食(药)用菌产量减产、品质不佳等现象。为了解菌草食(药)用菌栽培中常见真菌性病原菌的分类和特点,收集了在菌草食(药)用菌(平菇Pleurotus ostreatus、香菇Lentinus edodes、灵芝Ganoderma lucidum) 中常见的真菌性病原菌若干种。利用ITS序列(internal transcribed spacer)对其开展了分子生物学鉴定[8],以及温度、光照、pH、培养基等对菌丝生长速度的影响的生物学特性研究,旨在为真菌性病原菌的防治提供理论依据。
1 材料与方法
1.1 材料
采集到食(药) 用菌(平菇、香菇、灵芝) 真菌性病害菌株 LZ2、PG1、PG2、XG1、XG2、ZS2、ZS4,均保存于国家菌草工程技术研究中心。
SYM基础培养基(starch yeast medium):可溶性淀粉10 g、酵母提取物2 g、蔗糖3 g、琼脂粉16 g,定容至1 L;不同碳源基础培养基:KNO31 g、KH2PO40.5 g、MgSO4·7H2O 0.5 g、碳源 5 g、琼脂16 g,定容至1 L;不同氮源基础培养基:KH2PO40.5 g、MgSO4·7H2O 0.5 g、葡萄糖 5 g、氮源 1 g、琼脂16 g,定容至1 L;其他生化试剂均为国产分析纯。
1.2 方法
1.2.1 供试样品的DNA提取
收集新鲜培养的病原菌菌丝,采用CTAB法(cetyl trimethyl ammonium ammonium bromide) 提取gDNA[9],并利用Nanodrop 2000对其进行质量检测。
1.2.2 分子生物学鉴定及系统发育分析
对收集到的病害样本,采用真菌ITS通用引物ITS1 (5’-TCCGTAGGTGAACCTGCGC-3’) 和 ITS4(5’-TCCTCCGCTTATTGATATGC-3’) 对 ITS 序列进行PCR扩增[10],反应体系为25 μL,包括DNA模板1 μL、引物各 1 μL、Mixer 12.5 μL、ddH2O 9.5 μL,其反应条件为95℃预变性3 min;94℃变性2 min,55℃退火30 s,72℃延伸40 s,32个循环;最后72℃延伸10 min,4℃保存2 min。PCR产物经1%琼脂糖凝胶电泳检测并回收后,由铂尚生物技术(上海)有限公司进行测序,测序结果在NCBI中进行比对,并利用ClusterX和Mega 7.0进行系统发育树绘制。
1.2.3 温度对病原菌菌丝生长的影响
将上述经鉴定后的病原菌接种到SYM平板上,28℃培养5 d后,用内径为5 mm的打孔器进行打孔后,将菌块接种到SYM平板中间,于17℃、20℃、23℃、26℃、29℃、32℃和35℃条件下进行培养,每个处理5次重复,培养6 d后采用十字交叉法测量菌落直径,测定其生长速率。
1.2.4 pH值对病原菌菌丝生长的影响
按1.2.3的方法,将菌块接种到pH值分别为5、6、7、8、9和10的SYM培养基平板中间,于29℃下培养6 d,每个处理5次重复,培养6 d后采用十字交叉法测量菌落直径,测定其生长速率。
1.2.5 光照对病原菌菌丝生长和孢子萌发的影响
按1.2.3的方法,将菌块接种SYM培养基中间,于29℃分别置于全黑暗(24 h)、全光照(24 h)、半黑暗半光照(12 h更替)3种条件下培养6 d,每个处理5次重复,6 d后采用十字交叉法测量菌落直径,测定其生长速率[11]。
1.2.6 不同碳源对菌丝生长的影响
以SYM培养基为基础培养基,用等量的葡萄糖、蔗糖、麦芽糖、果糖、乳糖和甘露醇代替培养基中可溶性淀粉(10 g),以无碳源培养基为对照(CK),接种相同大小菌块,在29℃、pH 7和无光照条件下进行培养,每个处理5次重复,接种6 d后采用十字交叉法测量菌落直径,测定其生长速率。
1.2.7 不同氮源对菌丝生长的影响
以SYM培养基为基础培养基,用等量的牛肉膏、蛋白胨、脲、磷酸氢二胺、草酸铵和酵母膏代替不同氮源基础培养基中酵母提取物(2 g),以无氮源培养基为对照(CK),接种相同大小菌种块,置于29℃、pH 7和黑暗条件下进行培养,每个处理5次重复,接种6 d后采用十字交叉法测量菌落直径,测定其生长速率。
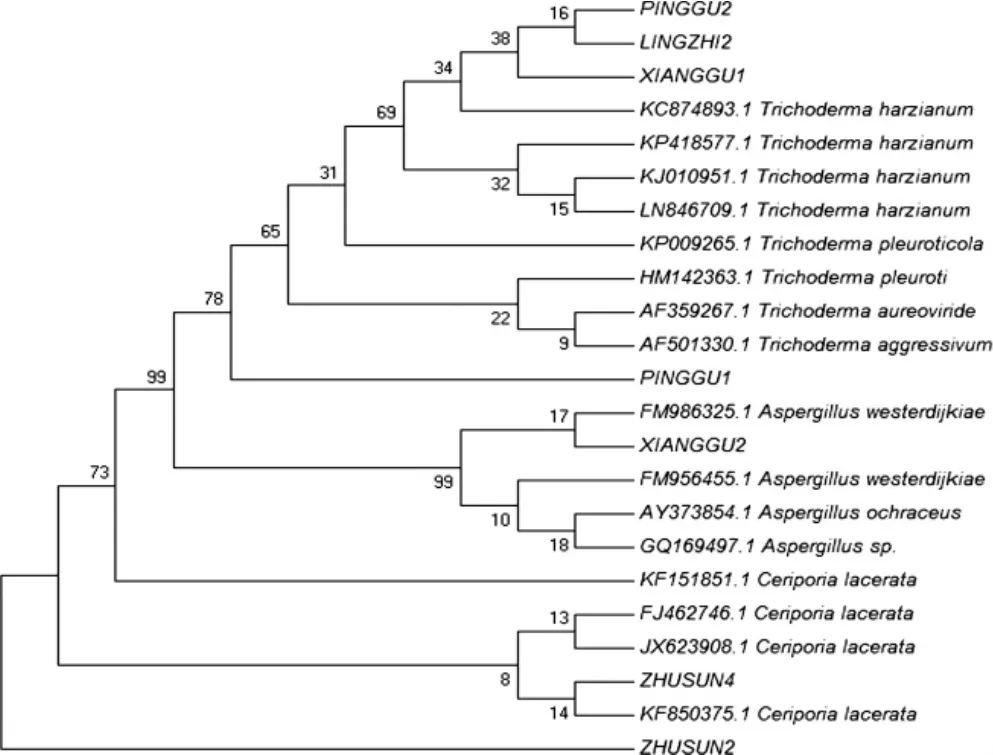
图1 供试病原菌菌株基于ITS碱基序列构建的系统发育树Fig.1 Phylogenetic tree of tested pathogens strain based on ITS base sequences
2 结果与分析
2.1 真菌性病原菌分子生物学鉴定
采用ITS1和ITS4对样品DNA进行扩增,均能获得500 bp~600 bp片段。对获得的全部片段在NCBI上进行BLAST分析,并利用ClusterX和Mega 7.0进行系统发育树绘制,见图1。
图1中LINGZHI2后简称为LZ2,PINGGU1为PG1,PINGGU2为PG2,XIANGGU1为 XG1,XIANGGU2为 XG2,ZHUSUN2为 ZS2,ZHUSUN4为ZS4。从图1看出,菌株LZ2、PG2和XG1与哈茨木霉Trichoderma harzianum的同源性高达99%(第一类),菌株 ZS2和 ZS4与蜡孔菌 Ceriporia lacerata的同源性高达99%(第二类),菌株XG2与赭曲霉Aspergillus ochraceus(第三类) 等同源性高达98%,而菌株PG1则是与侧耳木霉Trichoderma pleuroticola(第四类) 的同源性高达99%。同时,结合形态特征认为所收集的病原菌主要分为以上4类,并对鉴定分离后的病原菌菌株分别命名为TH-1、CL-1、AO-1 和 TP-1。
2.2 不同温度对4种病原菌菌株菌丝生长的影响
不同温度对4种病原菌菌株菌丝生长的影响见表1。
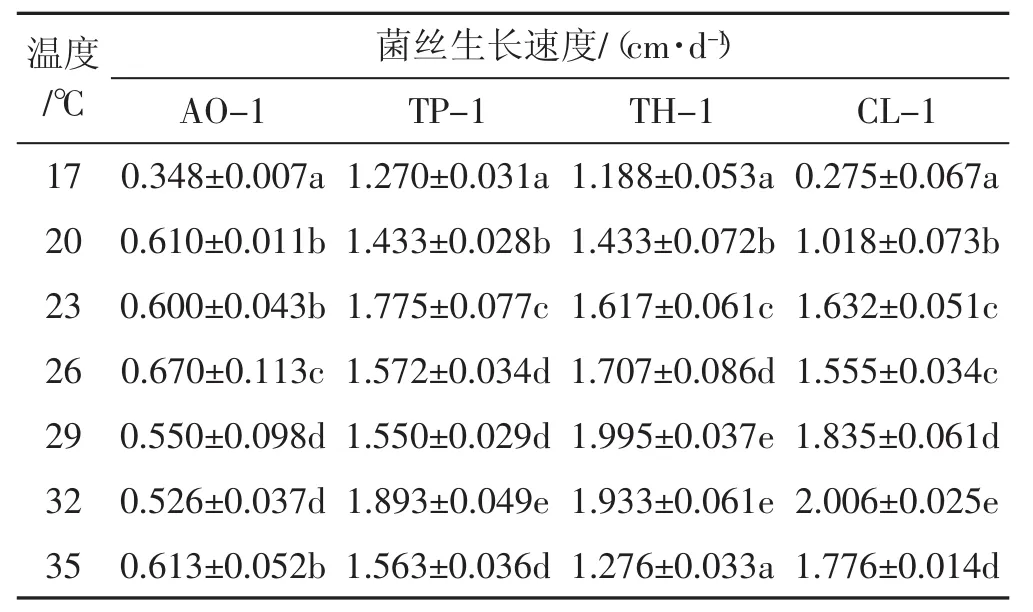
表1 温度对病原菌菌株菌丝生长的影响Tab.1 Effects of temperature on mycelia growth of pathogens strains
从表1可以看出,4种病原菌菌株在19℃~35℃温度范围和全黑暗条件下菌丝均能正常生长,其中菌丝生长的最适范围在 26℃~32℃,菌株AO-1、TP-1、TH-1和CL-1菌丝生长速率最高分别达到(0.670± 0.113) cm·d-1、 (1.893± 0.049) cm·d-1、(1.995± 0.037) cm·d-1和 (2.006± 0.025) cm·d-1,属于中高温型病原菌。
2.3 不同pH值对病原菌菌丝生长的影响
将4种病原菌接种到pH值为5~10的培养基上,在29℃全黑暗条件下培养,其菌丝能正常生长,具体见表2所示。
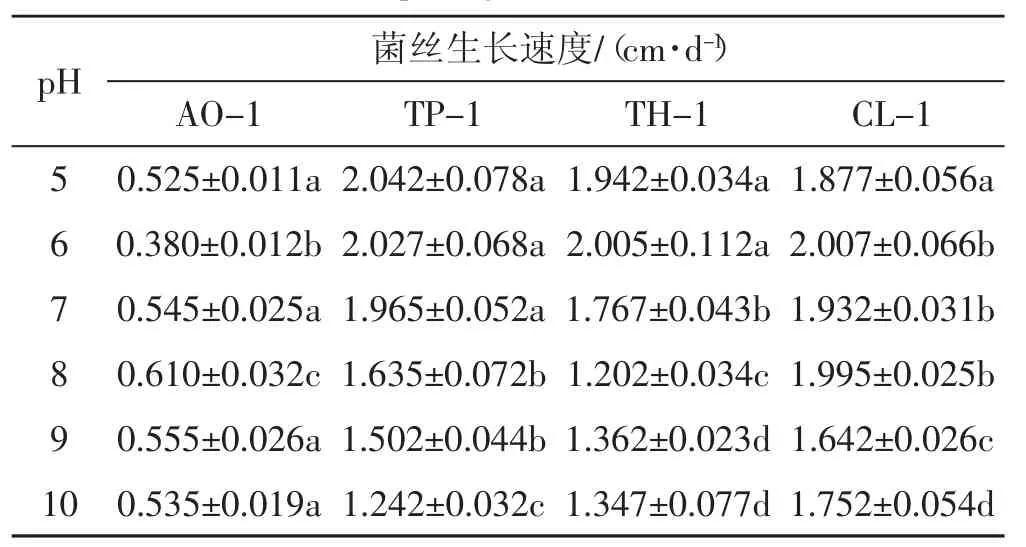
表2 pH值对4种病原菌菌株菌丝生长的影响Tab.2 Effects of pH value on mycelia growth of 4 kinds of pathogens strains
从表2可以看出,在pH值为6~8的条件下4种病原菌均可以生长且菌丝体速率达到最高,菌株AO-1、TP-1、TH-1和CL-1菌丝最大生长速率分别为 (0.610±0.032) cm·d-1、 (2.027±0.068)cm·d-1、 (2.005±0.112) cm·d-1和 (2.007± 0.066)cm·d-1,结果认为当培养基pH接近中性时为最适合菌丝生长。
2.4 光照对4种病原菌菌丝生长的影响
不同光照条件对4种病原菌菌株菌丝生长及孢子萌发的影响如表3所示。
从表3可以看出,4种病原菌菌株在光照或黑暗培养条件下均能够生长,且光照对产孢具有一定的促进作用,而黑暗对产孢作用具有显著的抑制作用;而在黑暗条件下菌丝体生长比其他条件下生长旺盛。
2.5 不同碳源对4种病原菌菌株菌丝生长的影响
不同碳源对4种病原菌菌株菌丝生长的影响,如图2所示,图2中*表示在0.05水平上差异显著。
图2结果发现,4种病原菌在多种碳源培养基上均能生长,其中在培养基中分别添加葡萄糖、蔗糖、麦芽糖、果糖和甘露糖可使菌株CL-1和TP-1菌丝正常生长;在培养基中分别添加葡萄糖、蔗糖、麦芽糖、果糖、乳糖和甘露糖的培养基上可使TH-1菌丝正常生长;在培养基中分别添加蔗糖、麦芽糖、果糖、乳糖和甘露糖的培养基上可使菌株AO-1菌丝正常生长。
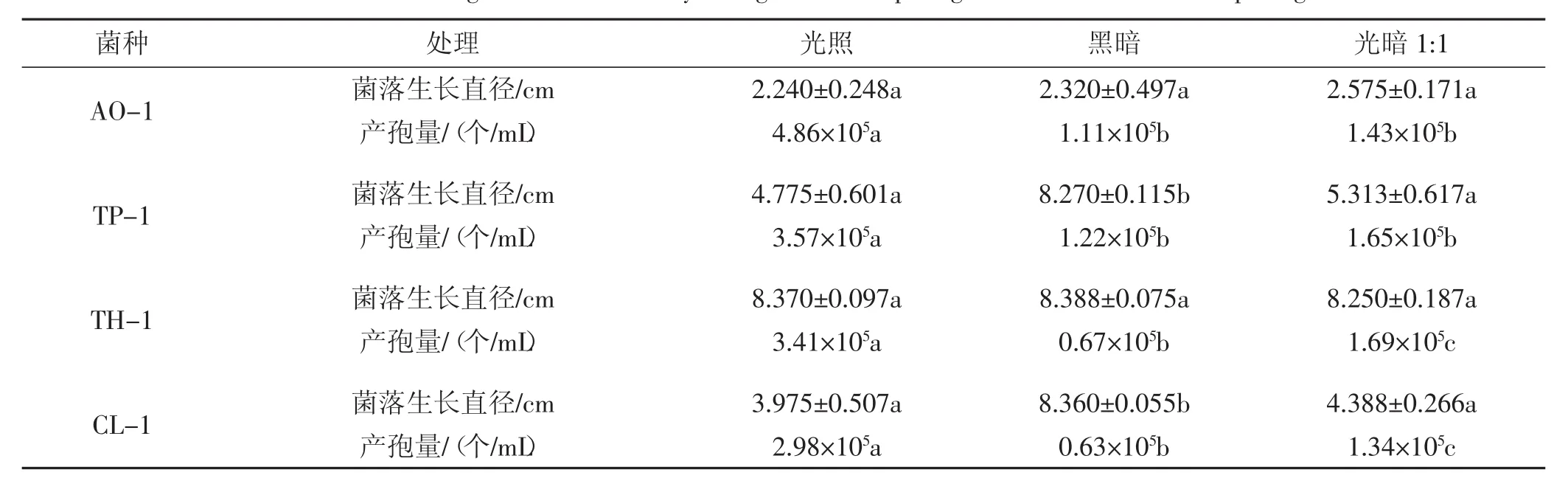
表3 不同光照条件对4种病原菌菌株菌丝生长及孢子萌发的影响Tab.3 Effects of different light conditions on mycelia growth and spore germination of 4 kinds of pathogens strains
2.6 不同氮源对菌丝生长的影响
不同氮源对4种病原菌菌株菌丝生长的影响如图3所示,图3中*表示在0.05水平上差异显著。
经比较6种氮源对4种病原菌菌株的菌丝生长直径的影响表明,4种病原菌菌株对有机氮的利用不佳,而在无机氮培养基上能较好的生长,对于菌株CL-1、TH-1、AO-1可以较好地利用牛肉膏、蛋白胨、草酸铵和酵母膏等无机氮,而菌株TP-1仅能较好地利用磷酸氢二胺。
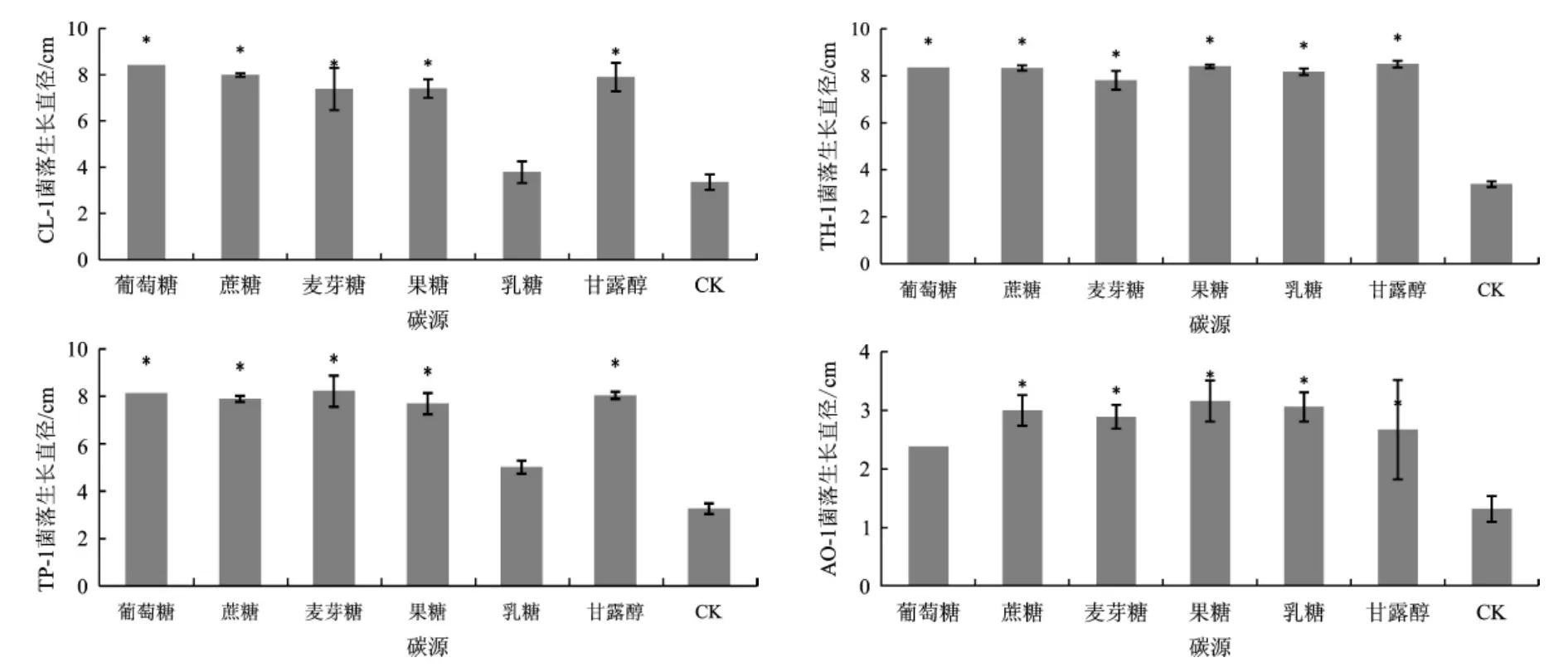
图2 不同碳源对4种病原菌菌株菌落生长的影响Fig.2 Effects of different carbon sources on the colony growth of 4 kinds of pathogens strains
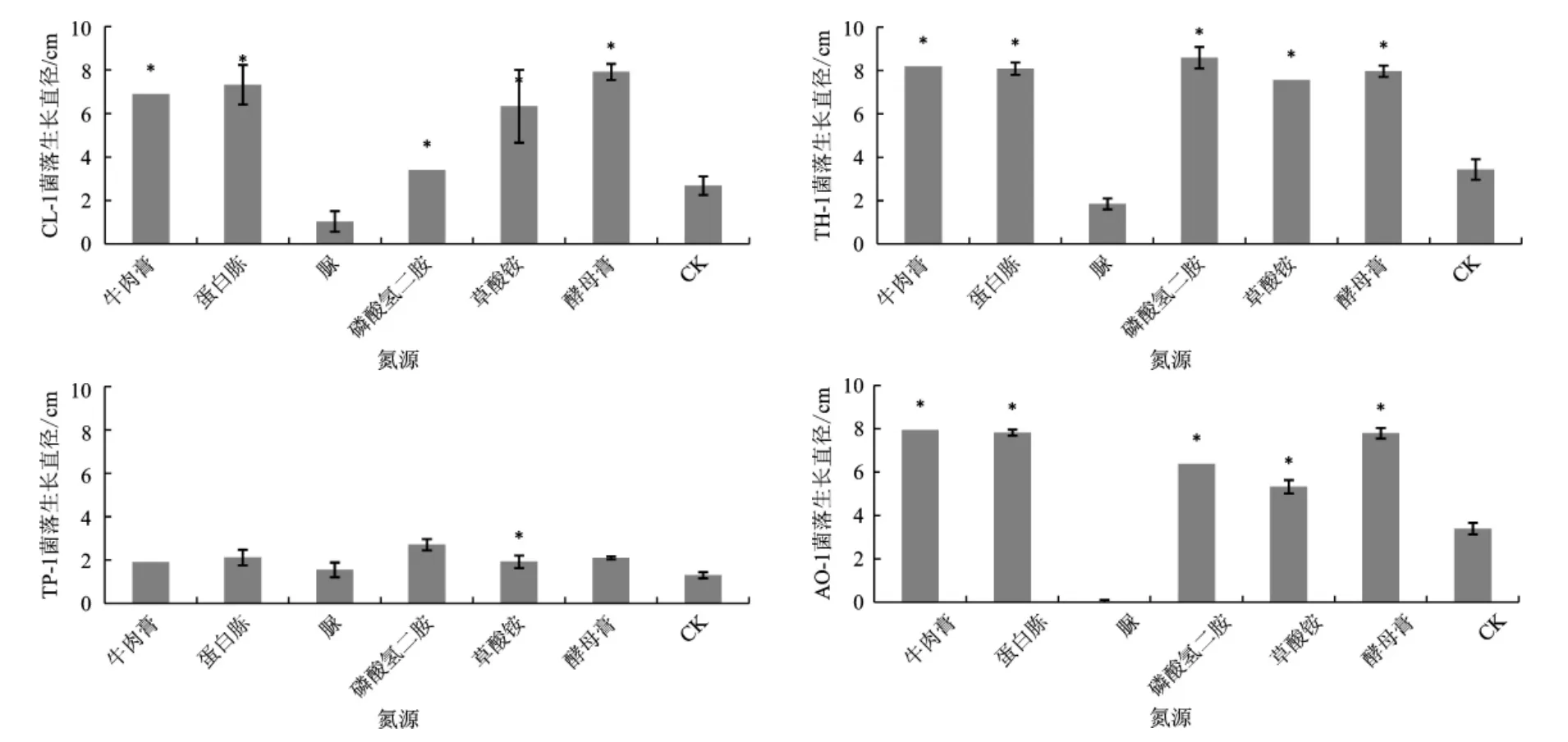
图3 不同氮源对4种病原菌菌株菌落生长的影响Fig.3 Effects of different nitrogen sources on the colony growth of 4 kinds of pathogens strains
3 讨论
本研究通过从常见食(药)用菌(平菇、香菇、灵芝)上分离得到7种病原菌,经ITS序列分析得到4种不同的病原菌菌株,分别为哈茨木霉(Trichoderma harzianum)、蜡孔菌 (Ceriporia lacerata)、赭曲霉(Aspergillus ochraceus) 和侧耳木霉(Trichoderma pleuroticola)。其中哈茨木霉(Trichoderma harzianum)在番茄、棉花、水稻、玉米等农作物上作为生防菌[12]得以广泛应用,能抑制番茄灰霉病、叶霉病、枯萎病及褐斑病等[13];与枯草芽孢杆菌一起对棉花枯黄萎病等具有拮抗作用[14];同时,哈茨木霉还广泛地应用于抑制水稻纹枯病、恶苗病菌等,具有显著的抑制作用[15-16]。赭曲霉广泛存在于水果、谷物等作物中并产生赭曲霉毒素A,能产生强肾毒性,具有致癌、致畸、致突变等作用,危害人畜健康、严重威胁生命安全[17],从葡萄中分离的赭曲霉经生物学特性研究发现其最适生长温度在30℃,利用枯草芽孢杆菌的发酵液和无菌体发酵液在琼脂板上均能显著抑制赭曲霉的生长。蜡孔菌在樱桃等水果中广泛存在并导致其根茎腐烂致死[18]。
然而类似的病原菌也曾在食(药)用菌的研究中被报道过,吴小平等[19-20]对食用菌栽培过程中出现的木霉菌种类进行调查分析,发现哈茨木霉和长枝木霉分别为食用菌栽培中出现频率最高的木霉菌,分别为59%和31%。曹现涛[21]和覃培升[22]分别从香菇菌筒和平菇培养料中分离除了侧耳木霉,并研究其最适温度为30℃~35℃,最适含水量为80%,最适pH值为7。哈慈木霉能抑制灵芝、香菇等食用菌菌丝体生长从而导致食用菌减产,给生产带来严重经济危害[23-24]。陈桂仙从真姬菇菌袋中分离出撕裂蜡孔菌(Ceriporia lacerata),得到其最适生长温度为15℃~35℃,最适pH为5~6,并在栽培料中加入适当生石灰用于防治该疾病[25];图力古尔对撕裂蜡孔菌的生物学特性研究也发现其最佳生长温度为30℃,pH为5[26]。赭曲霉作为毒素较强的一种真菌性病原菌在食用菌上的研究较少,而在本研究中发现其在食用菌上也大量存在,因此,有效地抑制和防治该真菌性病害在食用菌上的传播显得尤为重要。
本研究中利用ITS序列分析鉴定到的4种病原菌,均在食(药) 用菌(平菇、香菇、灵芝) 菌丝体生长阶段感染正常菌丝的生长,导致菌丝体无法正常生长或畸形,从而引起食(药)用菌减产或绝产,需在防治之前开展相关的生物学特性研究,然而本研究对于孢子的产生和萌发条件的研究还需要不断深入和补充。因此,对于食用菌上常见的病害研究还需要在工厂化栽培、分子诊断和毒力试验上继续开展。

