家蚕丝素蛋白阳离子化及其对羊毛性状的影响
包 红, 徐 水, 张小宁, 成国涛, 朱 勇
(1. 西南大学 家蚕基因组生物学国家重点实验室, 重庆 400715; 2. 西南大学 生物技术学院, 重庆 400715)
丝素蛋白是蚕丝的主要成分,富含18种氨基酸,因其具有良好的物理特性和生物降解性,被广泛应用于化妆品、食品、服装和生物医学领域[1]。羊毛纤维表面从根部向梢部附着有鳞片,使羊毛制品具有毡缩性。在潮湿环境下,羊毛纤维大量吸水,纤维表面鳞片层因吸水而打开,且在外力作用下鳞片层产生定向摩擦效应,并始终向根部移动。当这种机械作用消失,羊毛表面的鳞片则产生高低互补,使纤维相互交错,纠缠在一起,无法滑动,从而发生毡缩,即无法恢复到原有状态[2]。
羊毛织物由于其保暖性好、时尚感强而广受人们青睐;但羊毛表层的鳞片层结构使其制品有刺痒感、不易上色且难护理,为此,各种对羊毛表面鳞片层处理的方法应运而生。其中:化学降解法是通过化学处理的方法达到羊毛表面鳞片软化或者脱落的目的;传统方法为氯化-赫克塞特法,此方法在生产过程中会产生有机卤素(AOX),AOX不仅会对环境造成污染,而且会危害动植物的健康[3]。丝素蛋白整理剂由于其具有良好的舒适性、生物相容性、可降解且无毒[4],成为近年来兴起的一种生物整理剂。吴惠英等[5]利用不同浓度的丝素溶液对羊毛织物进行改性发现,经过丝素蛋白溶液整理的羊毛织物其吸湿性能得到改善且带有多种人体所需氨基酸,穿着舒适,尺寸稳定性好。李守振等[6]研究了丝素蛋白对羊毛织物透气性、折皱回复性等性能的影响,结果表明羊毛织物的纺毡缩性能得到优化。但均未对改性后羊毛纤维的性状进行表征。李静[7]将精胺运用到家蚕丝素蛋白的阳离子化中,成功制备了阳离子化家蚕丝素蛋白溶液,但由于在制备过程中用到了促酰胺化物质N-羟基琥珀酰亚胺(NHS)和吗啉乙磺酸(MES),使实验成本升高,且MES在实验过程中需避光,容易刺激眼睛呼吸系统和皮肤。
基于以上研究和不足,本文将精胺在不添加NHS的情况下,偶合于家蚕丝素蛋白的侧链上,制备阳离子化的家蚕丝素蛋白整理剂;再将阳离子化家蚕丝素蛋白整理剂作用于羊毛纤维,探讨阳离子化丝素蛋白整理剂对羊毛性状的影响,以期为阳离子化家蚕丝素蛋白在动物毛纤维上的应用提供理论参考。
1 实验部分
1.1 材料与仪器
羊毛,产自兰州;蚕茧,重庆市西南大学纤维材料研究室;碳化二亚胺(EDC,C7H14N2,相对分子质量为191.7)、精胺(C10H26N4,相对分子质量为191.7)、碳酸钠(Na2CO3,分析纯)、氯化钙(CaCl2,分析纯)、乙醇(CH3COOH,分析纯),以上试剂均购自成都市科龙化工试剂厂;酸性橙Ⅱ(C16H11N2NaO4S),天津市祥瑞染料有限公司。
JA2003 A型分析天平,上海精天电子仪器有限公司;HH-8型数显式水浴锅,江苏金坛市荣华仪器制造有限公司;Phs-3C+型数显式pH计,成都方舟科技开发公司;B13-3型恒温磁力搅拌器,上海司乐仪器有限公司;Sorvall ST 16 R型冷冻离心机,成都百乐科技有限公司;L-8800型全自动氨基酸分析仪,日本日立公司;YG0010型电子强力机,常州市第一纺织设备有限公司;JSM-6510LV型扫描电子显微镜,日本电子株式会社(JEOL);MAXima_X XRD-7000型X 射线衍射仪,日本岛津公司;HSC-1型差示扫描热量仪,北京恒久科学仪器厂;Varian 640 型傅里叶红外光谱仪,美国 Varian 公司;ZEV3600型Zeta电位分析仪,马尔文仪器有限公司;SBC-12型离子溅射仪,北京中科科仪股份有限公司;722型分光光度计,北京普析通用仪器有限责任公司。
1.2 材料的制备
1.2.1 丝素溶液的制备
根据课题组前期实验方法[8],选取干净茧壳,将其剪成螺旋状备用。按Na2CO3与蚕茧质量比为1∶40,将蚕茧在煮沸的碳酸钠溶液中煮0.5 h后用蒸馏水反复搓洗3遍以上,直至无滑腻感,重复以上步骤,得到脱胶丝素。
室温晾干后将脱胶丝素按浴水比为1∶10,置于80 ℃三元溶剂(CaCl2、CH3COOH、H2O的量比为1∶2∶8)中缓慢溶解。待溶解的丝素溶液降至室温时,将其倒于透析袋中,蒸馏水透析3 d。将透析后的丝素蛋白溶液于温度为25 ℃、转速为8 000 r/min的离心机中离心10 min后用纱布过滤,置于4 ℃冰箱保存。
1.2.2 丝素蛋白阳离子化
在50 mL再生丝素蛋白溶液中分别加入质量分数为0.1%、2.0%、5.0%、10%(占丝素蛋白的质量分数)的精胺溶液,精胺质量浓度为10 mg/mL,然后用HCl调节溶液pH值在7~8范围内,加入0.4 g EDC,磁力搅拌12 h后倒入透析袋中,置于搅拌器上蒸馏水透析3 d,得到阳离子化的家蚕丝素蛋白溶液。
1.2.3 羊毛的改性
用浸渍法将阳离子化丝素蛋白整理到羊毛上。羊毛和阳离子化丝素蛋白溶液浴比为1∶30,在60 ℃条件下浸渍60 min,然后于50 ℃烘焙1 h后得到改性羊毛,备用。
1.3 测试与表征
1.3.1 阳离子化丝素蛋白溶液测试
1.3.1.1Zeta电位测定 取适量阳离子化前后家蚕丝素蛋白溶液于Zeta电位分析仪中进行测定,温度为25 ℃,每个样品测试3次,结果取平均值。
1.3.1.2氨基酸测试 参照文献[9]方法对改性前后家蚕丝素蛋白溶液的氨基酸组成进行分析。准确量取丝素蛋白溶液2 mL倒入试管中,然后加入2 mL盐酸,振荡混匀后将试管口下方1/3处于酒精喷灯下拉细至4~6 mm,进行抽真空10 min处理后封管。将该试管置于110 ℃恒温烘箱中22 h使其沙浴水解后取出,待溶液冷却至室温后摇匀过滤,取1 mL滤液于60 ℃恒温水浴蒸干后加入盐酸稀释,最后用0.22 μm滤膜过滤后置于分析仪进行测试。
单个样品的测试时间为53 min,其中分离柱洗脱液的流速为0.4 mL/min,柱温为70 ℃,柱压为9.627 MPa;反应柱茚三酮及其缓冲液的流速为0.35 mL/min,柱温为135 ℃,柱压为1.078 MPa。
1.3.1.3化学结构分析 将阳离子化家蚕丝素蛋白溶液于-20 ℃冰箱中预冻6 h,然后置于-80 ℃下冷冻干燥48 h再研磨成粉末,采用KBr压片制样,测试范围为4 000~400 cm-1,扫描次数为32。
1.3.2 改性羊毛测试
1.3.2.1表面形貌观察 采用SBC-12型离子溅射仪对羊毛样品表面进行60 s喷金处理,然后置于扫描电镜样品舱中观察其表面形态,测试电压为10 kV。
1.3.2.2结晶结构测试 将羊毛剪碎后过筛,于37 ℃烘箱烘干后用X 射线衍射仪进行测试,测试管压、管流分别为40 kV、150 mA,扫描步长为0.013(°)/s,扫描速度为5(°)/min。
1.3.2.3化学结构测试 将羊毛剪碎后过筛,KBr压片制样,测试范围为4 000~400 cm-1,背景和样品均进行32次扫描。
1.3.2.4热性能测试 将羊毛剪碎后过筛,于37 ℃烘箱干燥3 d,然后放在HSC-1型差示扫描热量仪上,在10 mL/min 的氮气氛围下,在30~600 ℃范围内对羊毛的热行为进行测试,升降温速率均为10 ℃/min。
1.3.2.5力学性能测试 根据GB/T 3916—2013《纺织品 卷装纱 单根纱线断裂强力和断裂伸长率的测定》,将羊毛纤维于温度为20 ℃,相对湿度为65%的环境平衡24 h后用强力胶固定在测量模具上,然后置于单纤维强力仪上进行测定,预加张力为0.2 cN,上下夹距为10 mm,测试速度为10 mm/min,每个样品重复50次,结果求平均值。
1.3.3 改性羊毛的染色性能测试
将羊毛放入酸性橙II染料用量为2%(o.w.f)的染浴中,浴比为1∶30,以2 ℃/min的升温速率升温至80 ℃,染色50 min后降温至65 ℃,加入无水碳酸钠固色20 min,水洗后于50 ℃烘干得到染色羊毛。
采取有效措施,加强PPP投资型项目管理,不仅能有效约束和规范管理人员各项活动,还有利于实现对资金的科学合理利用,促进项目效益提升。因此,作为管理人员,应该充分认识加强PPP投资型项目管理的重要作用,根据存在的不足采取完善措施。提高管理人员综合技能,制定并严格落实各项管理制度。从而实现对资金科学合理利用,有效规范和约束PPP投资型项目运行,促进管理水平和PPP投资型项目效益提升。
按照1.3.2.1节方法观察改性羊毛染色后的形态变化。采用722型分光光度计测定染色前后染液的吸光度,按下式计算羊毛的上染率:
式中:A1为不同羊毛染色后染液的吸光度;A0为染色原液的吸光度。
2 结果与讨论
2.1 阳离子化丝素蛋白溶液性能分析
2.1.1 Zeta电位
Zeta电位用于表征胶体体系的稳定性,其绝对值大小代表微粒稳定性大小,正负代表粒子带何种电荷[10]。图1示出在相同pH值下,不同质量分数精胺改性处理后家蚕丝素蛋白溶液的Zeta电位测试结果。可知,未改性家蚕丝素蛋白溶液的Zeta电位值为-3.58 mV,随着精胺加入量的增加,Zeta电位由负值增加为5.41 mV,表明家蚕丝素蛋白与精胺发生了反应,丝素蛋白分子链上正电荷基团增多,且随着精胺质量分数的增加,体系稳定性增强。
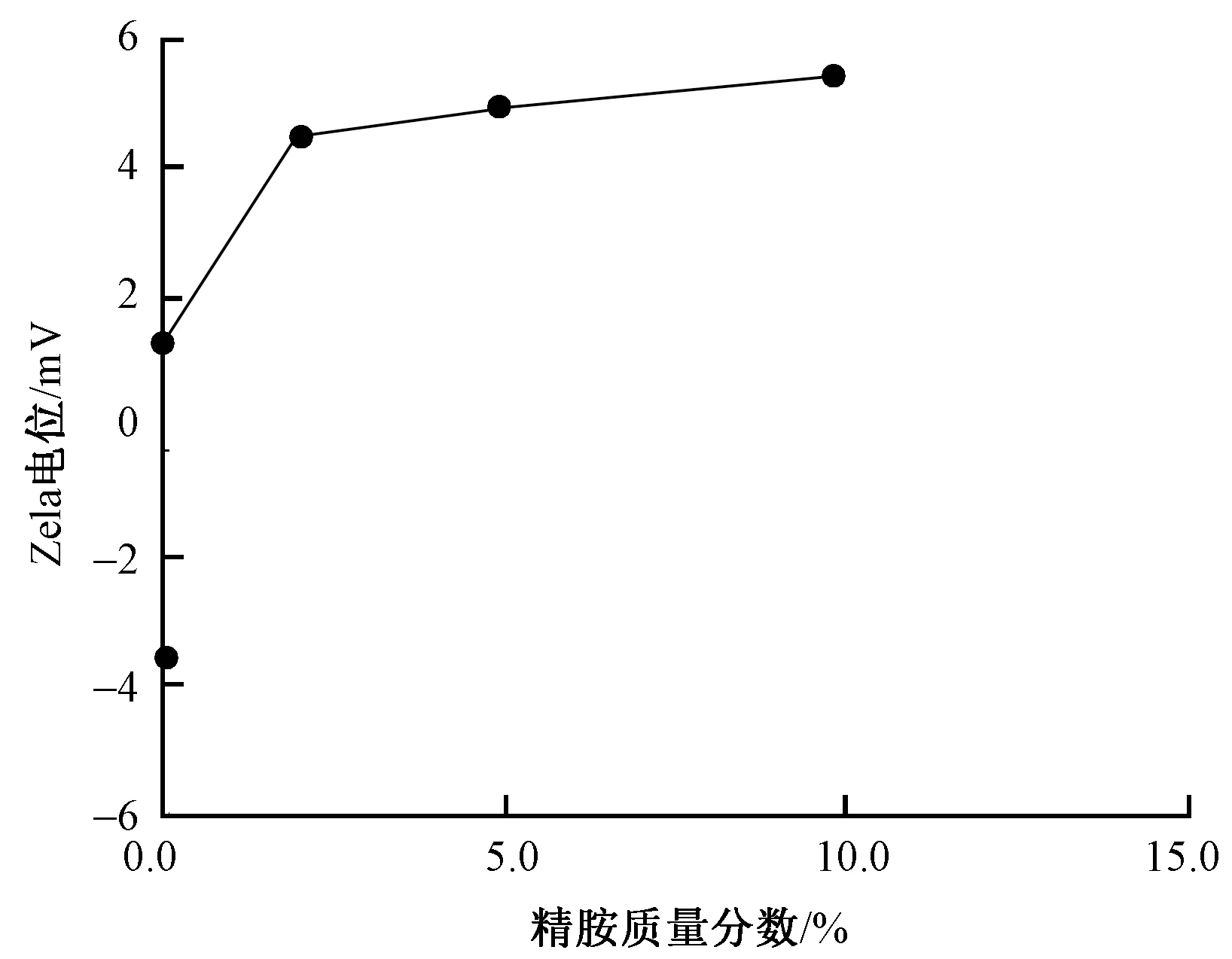
图1 不同精胺质量分数改性家蚕丝素 蛋白溶液的Zeta电位
Fig.1 Zeta potentials silk fibroin solutions modified with different mass fractions of spermine
精胺是一类多胺物质,含有2个—NH2和2个—NH。通过碳化二亚胺活化,丝素蛋白大分子链上的羧基与精胺的氨基发生反应生成酰胺键,精胺分子剩余1个自由的—NH2,家蚕丝素蛋白则相当于1个—COOH变成1个—NH2,从而侧链上正电荷基团相应增多,负电荷基团则相应减少。在中性条件下,丝素蛋白侧链上带有相对更多的正电荷,呈现阳离子特性。当精胺质量分数达到10.0%时,家蚕丝素蛋白溶液Zeta电位值接近稳定值。这是因为丝素溶液质量分数一定时,体系中—COOH含量是不变的,当精胺质量分数较低时,随着其加入量的增加,与丝素蛋白溶液发生反应的氨基越多,丝素蛋白的Zeta电位也就越高,当精胺质量分数增加到一定值时,体系中的—COOH几乎完全反应,所以这时再增加精胺的质量分数,溶液的电位也基本保持不变。
2.1.2 氨基酸含量分析
表1示出丝素蛋白溶液的氨基酸组成分析结果。可以看出,阳离子化后家蚕丝素蛋白溶液中的缬氨酸、丝氨酸含量下降,说明丝素蛋白的阳离子化主要发生在这几种氨基酸上,这是因为缬氨酸、丝氨酸侧链含有—COOH。
表1 不同精胺质量分数丝改性素蛋白溶液中氨基酸含量
Tab.1 Amino acid contents in silk fibroin solution modifiedwith different mass fractions of spermine
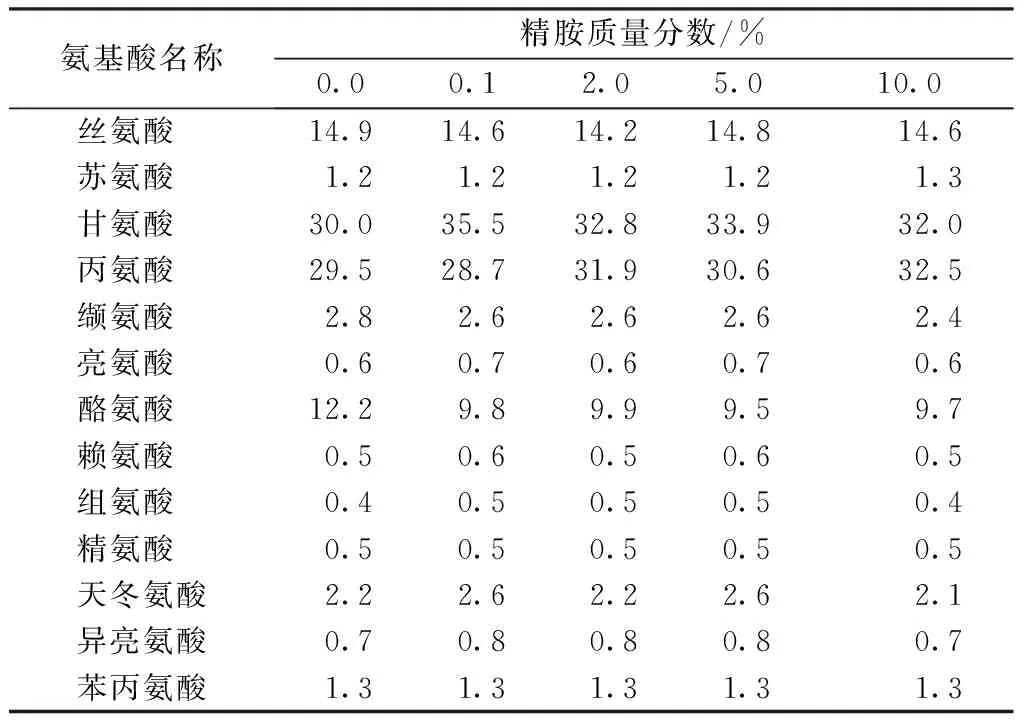
氨基酸名称精胺质量分数/%0.00.12.05.010.0丝氨酸14.914.614.214.814.6苏氨酸1.21.21.21.21.3甘氨酸30.035.532.833.932.0丙氨酸29.528.731.930.632.5缬氨酸2.82.62.62.62.4亮氨酸0.60.70.60.70.6酪氨酸12.29.89.99.59.7赖氨酸0.50.60.50.60.5组氨酸0.40.50.50.50.4精氨酸0.50.50.50.50.5天冬氨酸2.22.62.22.62.1异亮氨酸0.70.80.80.80.7苯丙氨酸1.31.31.31.31.3
图2示出不同精胺质量分数阳离子化前后丝素蛋白溶液的红外光谱图。精胺中—NH2基团的波数范围主要出现在3 500~3 300 cm-1区域内[7]。
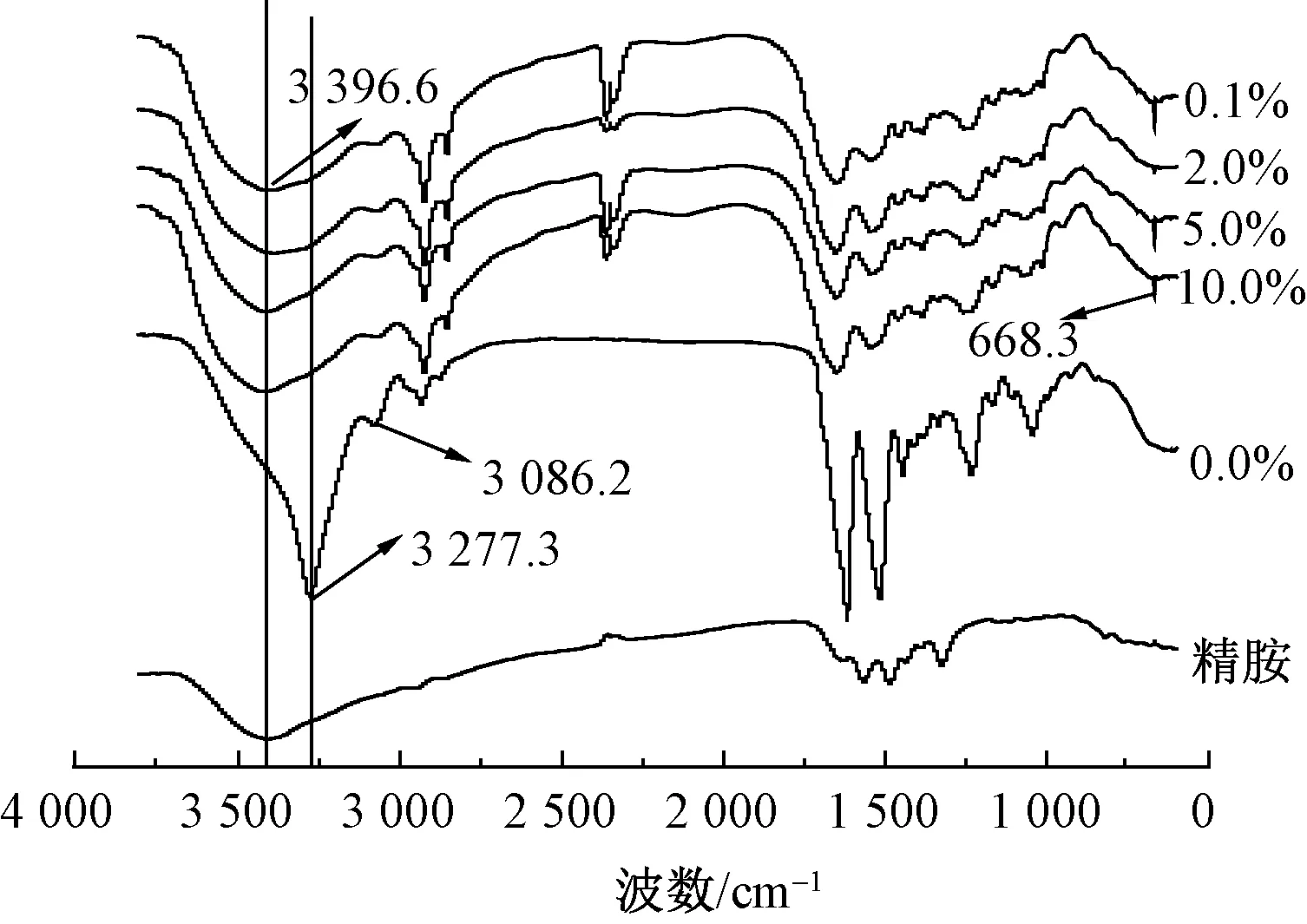
图2 改性家蚕丝素蛋白溶液的红外光谱图
Fig.2 FT-IR spectra of modified silk fibroin solution
由图2可以看出,未改性丝素蛋白红外光谱曲线在3 086.2 cm-1处的峰处于羧基基团(3 300~2 500 cm-1)波数范围内[7],而在精胺改性后的丝素蛋白红外光谱曲线中发现,该处特征峰消失,说明该波数的羧基基团发生了反应;在3 277.3 cm-1处的峰发生了偏移,均移向3 396.6 cm-1处,该波数在氨基波数区域(3 500~3 300 cm-1)内,说明有新的—NH2基团出现,此外,改性后的丝素蛋白均在668.3 cm-1处有新的特征峰出现,该峰为酰胺键(750~600 cm-1)的伸缩振动峰[11]。通过对比改性前后家蚕丝素蛋白的红外图谱发现,精胺被有效地偶合于丝素蛋白上,丝素蛋白溶液阳离子化成功。
2.2 改性羊毛的结构表征
2.2.1 改性羊毛的外观变化
图3示出处理前后羊毛纤维的扫描电镜照片。可以看出,原羊毛电镜照片中,羊毛鳞片暴露明显,鳞片层较厚且边缘突起,轮廓清晰,形状完整呈扁形;由图3(b)可知,改性羊毛鳞片层明显变薄,鳞片边缘损坏,棱角软化,鳞片无明显台阶,且一部分阳离子化丝素蛋白被修饰在羊毛纤维的表面,在羊毛表面形成丝素蛋白膜。这是因为阳离子化丝素蛋白中的氨基酸与羊毛角朊组成相近,浸渍过程中羊毛纤维表面及鳞片层间隙都有丝素蛋白溶液,而这些丝素蛋白溶液在羊毛烘干过程中随着水分的蒸发而发生转移。小部分丝素蛋白分子进入到纤维内部,大部分丝素蛋白分子则吸附于纤维表面与羊毛纤维大分子上的氨基、羟基等基团以氢键、酰胺键结合,形成一层丝素蛋白膜包裹在羊毛纤维表面。

图3 原羊毛、阳离子化丝素蛋白整理后羊毛的SEM照片
Fig.3 SEM images of wool (a) and cationized silk fibroin finished wool(b)
2.2.2 改性羊毛的结晶结构
据文献[13]报道,羊毛纤维的XRD曲线在2θ为9°、20°附近有2个α螺旋和β折叠构象共同的衍射峰,而这2种构象中任何1个构象均能各自规整堆砌,形成有序的排列甚至结晶,其中β折叠则更易形成有序排列。
图4示出羊毛的XRD图谱。可以看出:原羊毛的XRD图谱在2θ=22°处有衍射峰;而经丝素蛋白溶液处理后,其衍射峰出现在2θ=21°处,衍射峰向左偏移。根据布拉格定律[14],说明经丝素蛋白处理后的羊毛纤维其晶格间距变大,这是因为改性丝素蛋白携带的新的化学成分、改性后羊毛氨基酸数目和类型的变化以及丝素蛋白与羊毛纤维形成的氢键、范德华力等因素使羊毛晶体出现略微膨胀。与丝素蛋白处理后的羊毛相比,经阳离子化丝素蛋白处理后的羊毛纤维衍射峰强度增加。这可能与阳离子化丝素蛋白与羊毛氨基酸形成更多的氢键、酰胺键有关,需使用红外光谱仪对羊毛纤维结构做进一步分析。
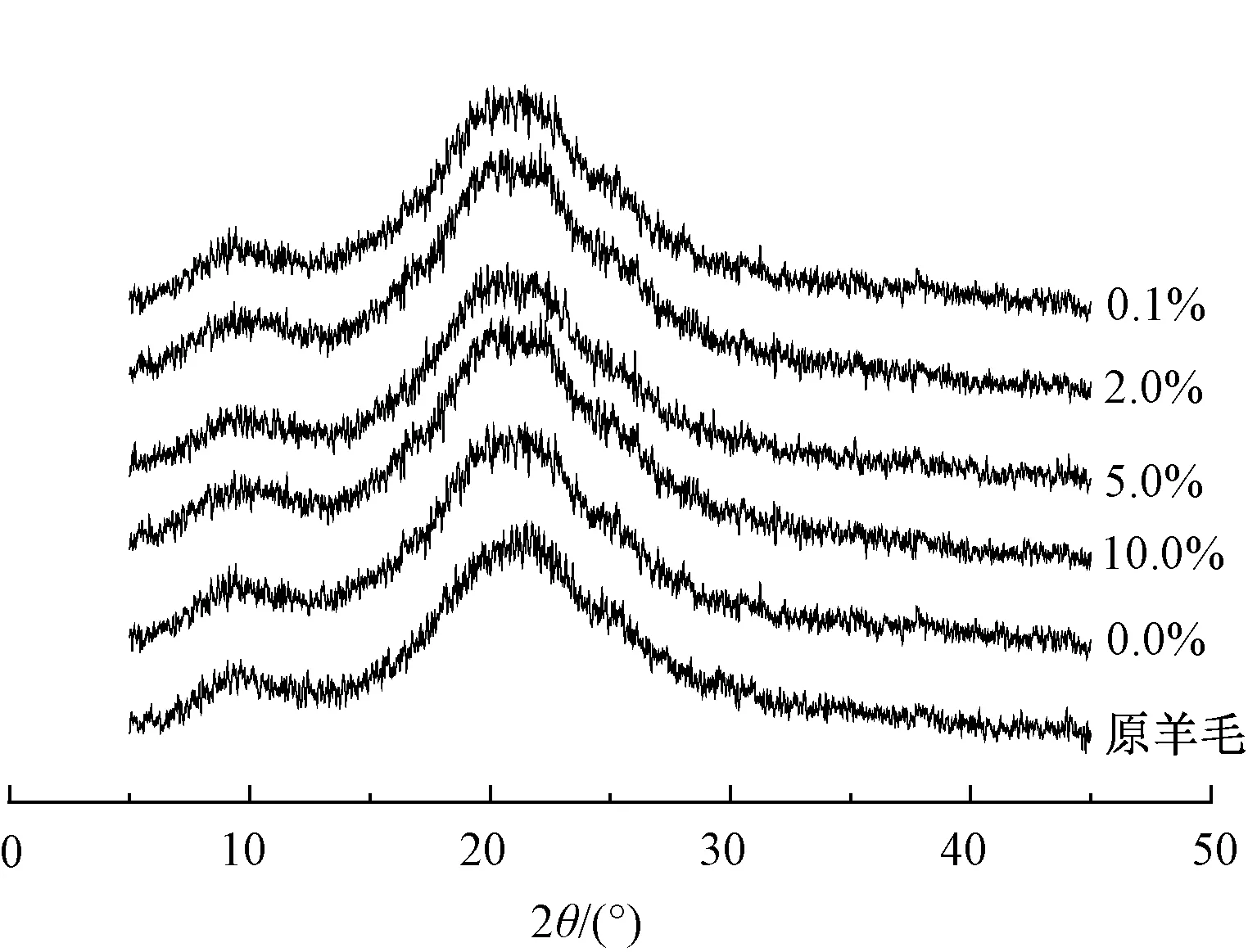
图4 不同精胺质量分数家蚕丝素 蛋白改性羊毛的XRD图谱
Fig.4 XRD pattern of wool modified by silk fibroin protein of silkworm with different concentrations of spermine
2.2.3 改性羊毛的化学结构
图5为羊毛的红外光谱图。可以看出,羊毛纤维分子的红外吸收谱带与常见蛋白质的一致[15]。原羊毛红外图谱在1 048.1 cm-1处的红外特征吸收峰,在经阳离子丝素蛋白处理后移至1 062.5 cm-1处。红外吸收峰的移动表明羊毛与丝素蛋白之间有物理键的相互作用,可能是羊毛的—NH2与阳离子化丝素蛋白的—NH2之间的氢键作用[16]。且用阳离子丝素蛋白整理后羊毛在1 583.5 cm-1处的N—H键振动峰相对强度加强,这可能是精胺的N—H键与羊毛纤维的N—H键共同作用的结果。
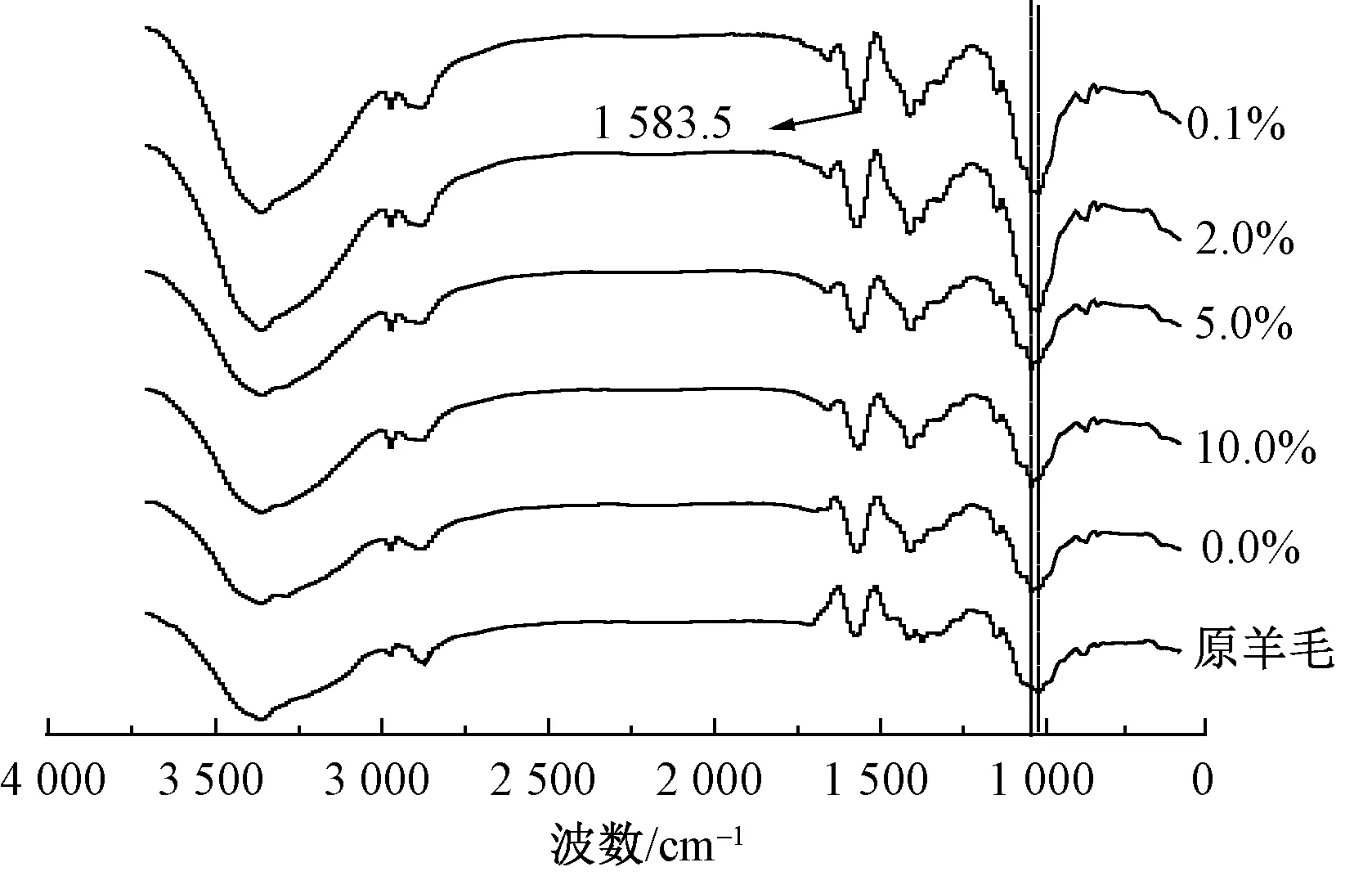
图5 不同精胺质量分数家蚕丝素蛋白 改性羊毛的红外光谱图
Fig.5 Infrared spectrum of wool modified by silk fibroin protein of silkworm with different concentration of spermine
2.2.4 改性羊毛的热性能分析
图6为羊毛的DSC曲线图。可以看出,羊毛纤维在230 ℃附近开始分解,且分解速度逐渐变快[14]。由原羊毛和丝素蛋白整理后羊毛的DSC曲线对比可知,原羊毛在230 ℃附近吸热峰不明显,而用纯丝素蛋白和阳离子化丝素蛋白整理后的羊毛均在230 ℃附近出现弱吸热峰,这可归因于更多酰胺键的降解[10]。相比于用纯丝素蛋白整理后的羊毛,用阳离子化丝素蛋白整理后的羊毛其吸热峰均移向高温方向,这说明整理后的羊毛结构更稳定。这可能源于阳离子化丝素蛋白与羊毛形成了更多的氢键、酰胺键,与前述实验测试结果相同。
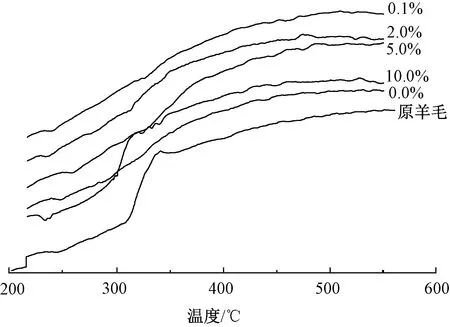
图6 不同精胺质量分数家蚕丝素 蛋白改性羊毛的DSC曲线
Fig.6 DSC curves of wool modified by silk fibroin protein of silkworm with different concentrations of spermine
2.2.5 改性羊毛的力学性能分析
表2示出不同改性程度羊毛纤维的力学性能。可以看出,经纯丝素蛋白处理的羊毛力学性能损失严重,断裂伸长率损失41.2%,而经阳离子化丝素蛋白处理后的羊毛断裂伸长率损失最高为36.1%,最低则只有8.0%,在可接受范围内。经丝素蛋白处理的羊毛强力为3.4 cN,而经阳离子化丝素蛋白处理的羊毛强力最高可达5.2 cN。可见,与纯丝素蛋白处理羊毛相比,采用阳离子化丝素蛋白改性的羊毛其力学性能损失均减少。
表2 不同精胺质量分数家蚕丝素蛋白改性羊毛纤维的力学性能
Tab.2 Mechanical properties of wool modified by silkfibroin protein of silkworm with differentconcentrations of spermine

精胺质量分数/%断裂强力/cN断裂伸长率/%0.15.253.72.05.139.15.05.147.110.03.856.30.03.436.0原羊毛5.361.2
经丝素蛋白处理后羊毛力学性能损失的原因:一方面可能是因为丝素蛋白向羊毛纤维内部的转移,使羊毛纤维内部出现损伤;另一方面则可能是因为处理液未能均匀分布,纤维局部出现损伤,使处理变得不均匀,形成处理弱节。而阳离子化丝素蛋白处理较纯丝素蛋白处理力学性能下降幅度小的原因与精胺、碳化二亚胺与羊毛氨基酸形成更多的氢键、范德华力有关。
2.3 改性羊毛的染色性能分析
2.3.1 上染率分析
由改性羊毛的上染率测试结果可知:经染色后,原羊毛的上染率为54.5%;经未改性丝素蛋白处理的羊毛上染率为42.3%;而经不同改性程度丝素蛋白(0.1%、2.0%、5.0%、10.0%)处理后的羊毛上染率分别为36.2%、33.0%、41.6%和33.7%。羊毛的上染率出现下降可能是因为阳离子化丝素蛋白使羊毛所带的正电荷与酸性橙Ⅱ所带的Na+离子电荷之间相互排斥所致。
2.3.2 染色后羊毛表面形貌分析
图7示出羊毛染色后的扫描电镜照片。可以看出:原羊毛染色后其磷片层突起明显,鳞片层边缘清晰;经纯丝素蛋白整理的羊毛染色后其表面形成的阳离子化丝素蛋白膜完好无损,羊毛鳞片层基本被该层薄膜包裹,而用阳离子化丝素蛋白处理的羊毛经酸性染料染色后其表面形成的改性丝素蛋白膜基本剥落,但对进入羊毛内部造成羊毛鳞片边缘损坏和棱角软化的丝素蛋白没有影响,因此,图7(c)中的羊毛鳞片层虽然暴露,但其边缘突起弱化,鳞片层间分界线模糊,鳞片棱角软化,这种现象在一定程度上有利于改善羊毛的毡缩性能。

图7 原羊毛、纯丝素蛋白整理羊毛、阳离子 化丝素蛋白整理羊毛染色后的扫描电镜照片
Fig.7 SEM images of wool (a), pure silk fibroin finished wool (b) and cationized silk fibroin finished wool (c) after dyeing
3 结 论
本文利用碳化二亚胺(EDC)激活家蚕丝素蛋白大分子链上的羧基,将精胺修饰于丝素蛋白的大分子链上,成功制备了不同改性程度的阳离子化丝素蛋白,并将阳离子化丝素蛋白整理到羊毛纤维上。一部分丝素蛋白被修饰在羊毛表面,羊毛纤维鳞片被软化且被表面形成的阳离子化丝素蛋白膜包裹,很大程度上解决了羊毛的毡缩问题;另一部分丝素蛋白膜则进入羊毛纤维内部,使处理后的羊毛纤维耐热性提高,羊毛纤维内部形成了更多的氢键、酰胺键,晶体结构更稳定。不同改性程度的阳离子化丝素蛋白对羊毛的纤维结构的影响差异不大,改性后羊毛的力学性能下降。改性羊毛用酸性染料染色,其上染率下降,有待于进一步研究改善。

