再生丝素蛋白/脱细胞真皮基质共混纳米纤维膜的制备及其性能
林永佳, 杨董超, 张佩华, 顾 岩
(1. 东华大学 纺织面料技术教育部重点实验室, 上海 201620;2. 上海交通大学医学院 附属第九人民医院, 上海 200011)
静电纺丝技术是利用外加电场使聚合物溶液带电,在喷头末端形成悬垂的锥状液滴,当液滴表面的电荷斥力超过其表面张力时,液滴表面会高速喷射出射流,经过电场的拉伸细化及溶剂的挥发,纤维固化沉积于接收板上,形成纳米纤维膜[1]。由静电纺丝制得的纤维膜具有孔隙率高、纤维精细程度高、比表面积大、均一性好等优点,能够从纳米尺度上模仿天然细胞外基质,可作为细胞生长的多孔支架,促进细胞的迁移和增殖[2-3]。再生丝素蛋白(RSF)无毒且具有良好的生物相容性及可降解性等[4-5],在生物医用领域得到了广泛的应用。脱细胞真皮基质(ADM)是一种多孔性的三维网状结构,其主要成分为胶原蛋白,可促进新生血管及上皮的形成[6-7], 具有良好的生物相容性。
目前,关于静电纺RSF的研究已不仅仅满足于单一组分的RSF,更多的是通过共混引入1个或者多个组分,从而使RSF在组织工程中的应用更加广泛。蔡江瑜等[8]通过静电纺丝技术制备了丝素蛋白/聚乳酸-聚己内酯纳米纤维支架,结果显示支架能够有效促进兔骨-腱愈合。蒋丹[9]以膀胱脱细胞基质/RSF混合水溶液进行静电纺丝,利用膀胱脱细胞基质内源性生物信号因子来增加共混膜的生物活性。尽管关于静电纺RSF的研究报道很多,但将ADM与RSF共混进行静电纺的研究报道很少。将ADM与RSF共混于纺丝液中,通过静电纺丝技术制备出RSF/ADM共混纳米纤维膜,不仅在结构上模仿了天然细胞外基质,具有高孔隙率、高比表面积等特点,且添加的ADM增加了RSF的细胞识别位点,促进RSF上细胞的增殖与黏附[10],其可用于创面修复的组织工程中,具有一定的医用发展前景。
本文将RSF与ADM按照一定质量比共混溶于甲酸中进行静电纺丝,探讨不同质量浓度的共混纺丝液及RSF/ADM质量比对纳米纤维形态及性能的影响,并通过体外接种细胞,初步考察了RSF/ADM共混纳米纤维膜的生物相容性。
1 实验部分
1.1 实验原料与仪器
桑蚕茧,产自江苏徐州;脱细胞真皮基质(ADM,DC-ADM-a 型),江苏优创生物医学科技有限公司;尿素(分析纯),上海凌峰化学试剂有限公司;无水溴化锂(纯度为99%),萨恩化学技术有限公司;甲酸(分析纯),国药集团化学试剂有限公司;C2C12细胞株,中国科学院细胞库;CCK-8试剂,凯基生物技术有限公司;透析袋(截留相对分子质量为14 000),上海雷布斯网络科技有限公司;医用一次性注射针管(5 mL),市售。
FA2004 型电子天平,上海良平仪器仪表有限公司;SHJ-6 A 型磁力搅拌水浴锅,常州迅生仪器有限公司;DHG-9 145 A型电热鼓风干燥箱,上海一恒科技有限公司;LGJ-10 型真空冷冻干燥机,北京松源华兴科技发展有限公司;KDS100型注射泵,美国KD Scientific公司;DW-P303-AADCD1型高压直流电源,东文高压电源(天津)有限公司;TM-3000型台式扫描电子显微镜,日本日立公司;ARES型流变仪,美国TA Instruments公司;Spectrum Two型傅里叶变换红外光谱仪,英国Perkin Elmer公司;DSC 4000型差式扫描量热仪,铂金埃尔默仪器(上海)有限公司;Synergy H1型多功能酶标仪,美国Bio Tek公司;Thermo 371型二氧化碳培养箱,美国Thermo Scientific 公司。
1.2 实验方法
1.2.1 丝素蛋白的提取
丝素蛋白的提取步骤为脱胶,溶解,透析,冻干[11],其实验过程如下。
脱胶:将桑蚕茧剪碎,置于8 mol/L的尿素溶液(浴比为1∶30)中,于90 ℃水浴3 h后取出脱胶蚕茧,然后采用去离子水洗净后于60 ℃烘干。重复以上步骤3次,得到丝素蛋白。
溶解:将丝素蛋白溶解于9.3 mol/L的溴化锂溶液中(浴比为1∶10),于60 ℃水浴溶解,待冷却后用纱布过滤未溶解的杂质得到丝素蛋白溶液备用。
透析:将经过前处理后的透析袋彻底洗净后装入丝素蛋白溶液,采用去离子水透析48 h。
冻干:将经过透析的丝素蛋白水溶液经冷冻干燥72 h后制得RSF。
1.2.2 静电纺纳米纤维膜的制备
将RSF与ADM按不同的质量比(10∶0、9∶1、8∶2、7∶3、6∶4、5∶5)共混溶于甲酸中,配制一定质量浓度的静电纺丝液。将纺丝液在室温搅拌24 h后静置脱泡装入5 mL的一次性医用注射器(针头型号为18#)中进行静电纺丝。静电纺丝工艺参数为:电压16 kV,推注速度0.7 mL/h,接收距离15 cm。采用接地的金属板接收静电纺纳米纤维膜。
1.2.3 形貌观察与直径测量
将静电纺纳米纤维膜剪成0.3 cm×0.3 cm后贴于导电胶上并进行喷金处理,通过扫描电子显微镜观察纤维的形态,并使用Image J软件随机选取50根纤维测量其直径,计算直径不匀率。
1.2.4 纺丝液黏度测定
将不同质量浓度的RSF/ADM共混纺丝液静置脱泡后,采用ARES 流变仪测定其在不同剪切速率下的黏度值。测试温度为(25±1)℃,频率扫描范围为0.1~1 000 Hz。
1.2.5 化学结构测试
将静电纺纳米纤维膜从铝箔上剥下,通过傅里叶变换红外光谱仪对其进行结构分析,扫描范围为4 000~400 cm-1。
1.2.6 热学性能测试
将静电纺纳米纤维膜从铝箔上剥下,称取3~5 mg,并记录质量。采用DSC 4000 型差示扫描量热仪对静电纺纳米纤维膜进行热学性能测试。测试温度区间为 30~400 ℃,升温速率为10 ℃/min。
1.2.7 细胞增殖实验
将C2C12细胞株(小鼠骨骼肌细胞)制备成5×104个/mL的细胞悬浊液,按照每孔100 μL将细胞悬液加入96孔板中。取尺寸为0.25 cm×0.25 cm的RSF/ADM 共混纳米纤维膜放入96孔板对应孔中,另外设置无材料的空白对照组。放置于37 ℃,体积分数为5%的二氧化碳培养箱内,每2 d更换1次培养液。分别于第1、3、5、7 d取出对应时间点的96孔板加入10 μL的CCK-8试剂,在37 ℃孵育2 h后,使用多功能酶标仪测试各孔中的光吸收值(OD值)。
2 结果与讨论
2.1 纺丝液质量浓度对纤维形态的影响
固定RSF与ADM 的质量比为9∶1,分别配制9、11、13、15 g/mL的共混纺丝液制备共混纳米纤维膜,其扫描电镜照片如图1所示,平均直径及其不匀率如表1所示。

图1 不同质量浓度的RSF/ADM共混纳米 纤维膜形态(×3 000)
Fig.1 Morphologies of different mass concentrations of RSF/ADM blended nanofibers(×3 000)
从图1和表1可以看出,当质量浓度从9 g/mL增加至15 g/mL,纤维形态先从较细的、不规整包含珠状物纤维到逐渐规整,再到再次出现珠状物变化,纤维直径的不匀率也随之上升。当纺丝液质量浓度较低时,分子链之间的缠结不足,纺丝时无法形成连续完整的纤维而带有珠状物或者纺锤形。随着质量浓度逐渐的增加,纳米纤维的形态逐渐规整,当质量浓度达到11 g/mL时珠状物开始明显减少。当质量浓度进一步上升,分子链之间的缠结增加,喷射流需要在电场内克服更大的表面张力去分化拉伸细化成丝,因而在同样的工艺参数下,纳米纤维的直径逐渐增大且不匀率上升,纺丝过程逐渐变得困难,质量浓度为15 g/mL时便出现纺丝液在针头被拉长且堵塞针头的现象,且铝箔上会收集到部分没有被拉伸细化的液滴。尽管质量浓度为11 g/mL时所测得纳米纤维的直径及CV值均较13 g/mL小,但在扫描电镜的观测过程中发现质量浓度为11 g/mL时所获得的共混纳米纤维膜依然存在些许纺锤形纤维,且纺丝效率不如质量浓度为13 g/mL时。综合考虑,选择13 g/mL作为后续实验的基础参数。
表1 不同质量浓度的RSF/ADM 共混纳米纤维的直径
Tab.1 Different mass concentrations of RSF/ADMblended nanofibers in diameter
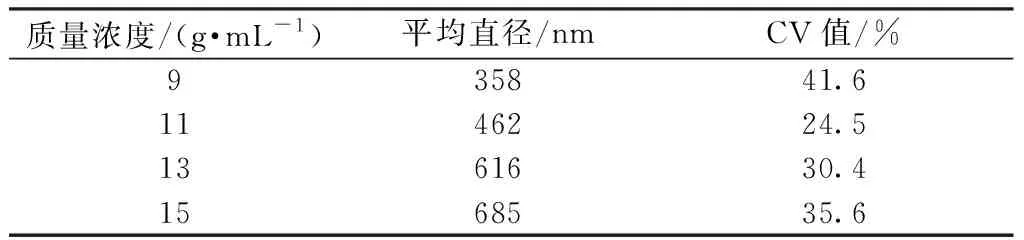
质量浓度/(g·mL-1)平均直径/nmCV值/%935841.61146224.51361630.41568535.6
2.2 RSF与ADM质量比对纤维形态的影响
在固定纺丝液的质量浓度为13 g/mL,纺丝电压为16 kV,推注速度为0.7 mL/h,接收距离为15 cm的静电纺工艺参数下,分别配制RSF与ADM不同质量比的纺丝液,制备的纳米纤维形态如图2所示。

图2 不同质量比的共混纳米纤维形态(×3 000)
Fig.2 Morphologies of nanofibers with different blending ratios (×3 000)
表2示出不同质量比的RSF/ADM共混纳米纤维的平均直径及其不匀率。
表2 不同质量比的RSF/ADM共混纳米纤维的直径
Tab.2 Diameter of RSF/ADM nanofibers withdifferent blend ratios

RSF与ADM质量比平均直径/nmCV值/%10∶061819.09∶161630.48∶250738.17∶349836.36∶449924.85∶5——
从图2及表2可以看出,在同样的工艺参数下,随着ADM占比的提高,纺出的纳米纤维形态逐渐变得不规整,纤维平均直径呈现减小的趋势,且在纺丝过程中,溶液的表观流动性下降,可纺性变差。使用流变仪分别对RSF与ADM质量比为10∶0、9∶1、8∶2的纺丝液进行不同剪切速率下液体黏度的测定,得到流变曲线图,如图3所示。结果显示,随着ADM在纺丝液中占比的提高,溶液的黏度呈现升高的趋势。这是由于ADM中的主要成分为胶原蛋白,具有一定的刚性,当ADM的含量增加的同时,纺丝液中胶原蛋白的含量也随之增加,因而纺丝液中分子链刚性增加,使溶液的表观流动性降低。尽管增加的ADM使得纺丝液中分子链间依然存在较多的结合点,使纺丝液的黏度呈现一个较高的水平;但ADM中胶原蛋白刚性的特点不利于分子链形成足够强度的有效缠结[12],能够形成有效缠结的柔性长链RSF又由于ADM的增加而相应降低,使其不足以克服电场力的牵伸作用,因此,随着ADM占比的提高,纳米纤维逐渐呈纺锤形及球形再到无法纺出纳米纤维。
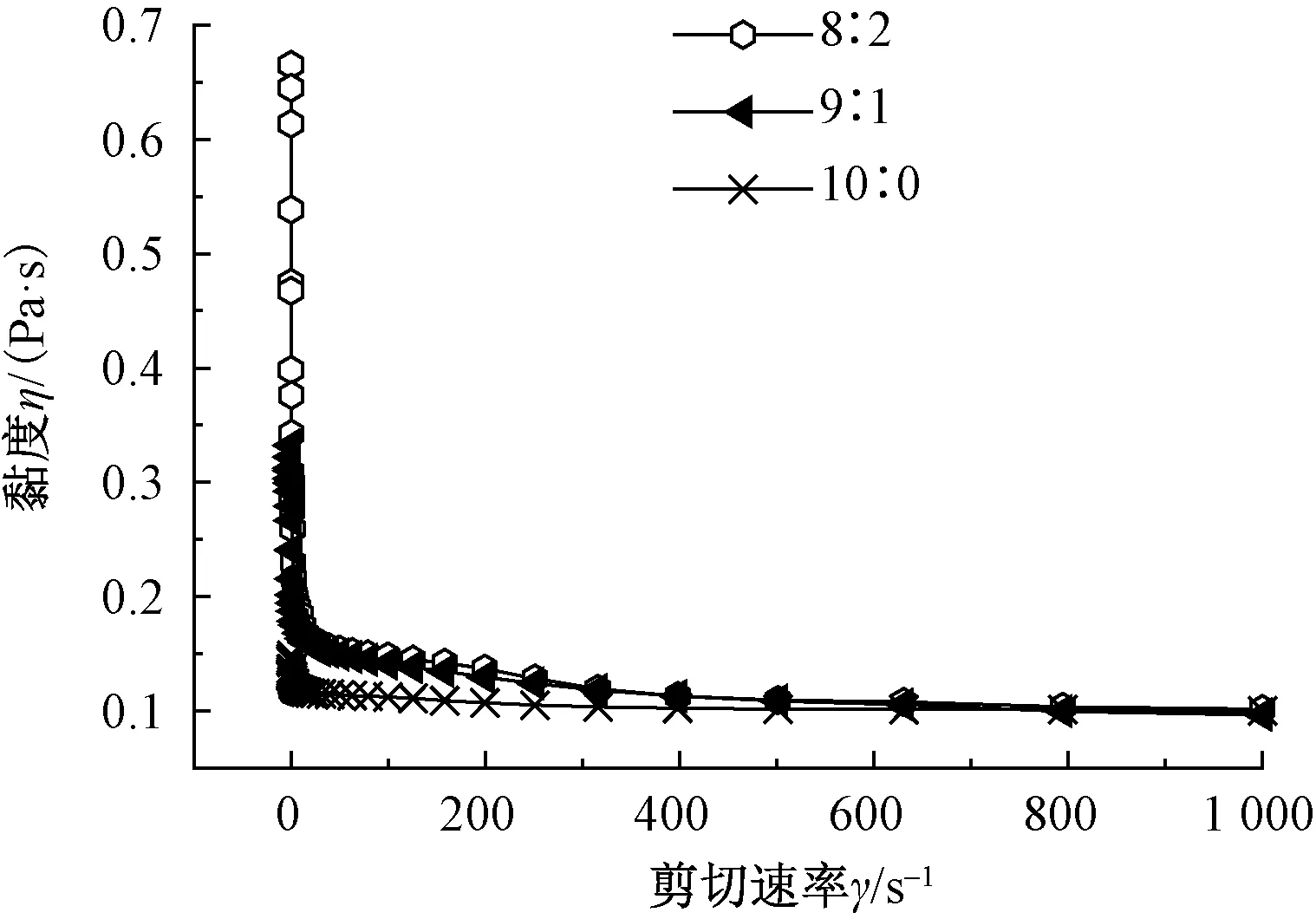
图3 不同质量比的RSF/ADM共混 纺丝液的流变曲线
Fig.3 Rheological curves of different proportions of RSF/ADM blend spinning solution
2.3 共混纳米纤维膜的性能分析
2.3.1 化学结构分析
对纳米纤维膜进行红外光谱测试得知:几种纳米纤维膜均在3 285 cm-1附近呈现蛋白质的酰胺A带,即N—H键的伸缩振动峰;在3 083 cm-1附近呈现蛋白质的酰胺B带,即C—H键的伸缩振动峰。图4示出不同质量比的共混纳米纤维膜在波数为1 700~1 450 cm-1区间的红外光谱图。蛋白质的酰胺I在1 650 cm-1处呈α螺旋结构,在1 640~1 625 cm-1处呈β折叠结构,在1 655 cm-1处呈无规构象;酰胺Ⅱ在1 545 cm-1处呈α螺旋结构,在1 525~1 515 cm-1处呈β折叠结构,在1 545~1 535 cm-1处呈无规构象[13]。随着共混纳米纤维膜中ADM占比的提高,共混纳米纤维膜的酰胺I的吸收峰分别为1 648、1 646、1 644、1 644、1 634 cm-1,从图4也可看出,吸收峰在向右移动,即其酰胺I逐渐向β折叠构象靠近。纯RSF的酰胺Ⅱ吸收峰出现在1 533 cm-1处,呈无规构象;纯ADM酰胺Ⅱ吸收峰出现在1 521 cm-1处,呈β折叠构象。而共混纳米纤维膜中,随着ADM占比的提高,共混纳米纤维膜的酰胺Ⅱ的吸收峰分别在1 517、1 516、1 516 cm-1处,即其酰胺Ⅱ逐渐呈β折叠构象。与纯RSF相比,特征吸收峰基本相同,但共混纳米纤维膜的β化程度提高了,这是由于ADM与RSF之间形成ADM氢键所致。
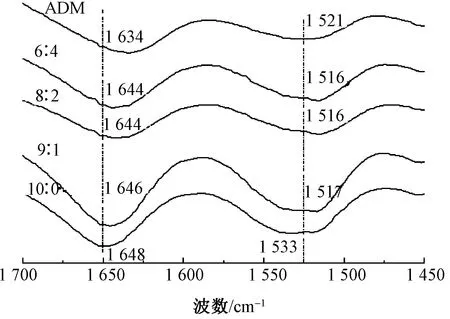
图4 不同质量比共混纳米纤维膜的红外光谱图
Fig.4 Infrared spectra of nanofiber membranes with different blending ratioes
2.3.2 热性能分析
图5示出RSF与ADM质量比为10∶0、9∶1、8∶2时共混纳米纤维膜的DSC曲线。可以看出,3种纳米纤维膜在75 ℃附近有1个明显的吸热峰,在175 ℃左右有1个阶梯状上升的转变峰。其中:75 ℃的吸热峰为3种纳米纤维膜的失水峰;175 ℃的转变峰是RSF纳米纤维的玻璃化转变峰[14];而260 ℃附近的吸放热峰可能是由于无规卷曲或者是α螺旋向β转变所引起的[15];275 ℃后的峰则是纳米纤维膜热分解所致[16]。 RSF的热分解温度与其分子的聚集态有关,结晶度越高,则热分解所需的能量越高[17]。通过DSC曲线可以得到3种纳米纤维膜热分解所需的能量,分别是114.55、297.90、383.68 J/g。随着ADM占比的提高,热分解所需的能量随之上升,图中的分解峰的峰型也越来越尖锐,因而以RSF与ADM质量比为8∶2的结晶度最高,这与红外光谱测试所得到的结果一致。共混纳米纤维膜中ADM占比提高,使得RSF结构中的部分无规结构及α螺旋逐步向β折叠结构转变,因而使得共混纳米纤维膜中的结晶度比纯RSF高。
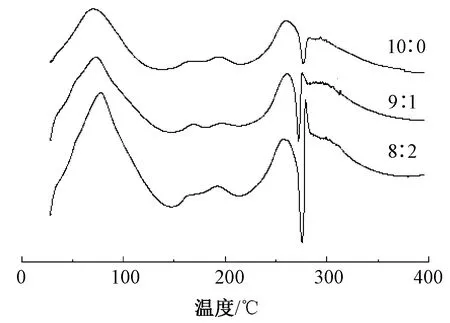
图5 不同质量比共混纳米纤维膜的DSC曲线
Fig.5 DSC curves a with different blending ratioes of nanofiber membranes
2.4 生物相容性分析
表3示出细胞C2C12在共混纳米纤维膜(RSF与ADM质量比为9∶1)及空白对照组分别培养1、3、5、7 d后的OD值。可以看出,随着时间的延长,RSF/ADM共混纳米纤维膜及空白对照组的OD值均逐步增大。其中,第1天共混纳米纤维膜的OD值略低于空白对照组,但差异性并不显著(P>0.05);第5、7天共混纳米纤维膜与空白对照组的OD值基本接近,差异性不显著(P>0.05);第3天共混纳米纤维膜的OD值明显高于对照组,差异性显著(P<0.01)。由此说明,静电纺丝过程中所使用的有机溶剂甲酸没有残留,C2C12细胞能够在RSF/ADM共混纳米纤维膜上正常生长、增殖,所制得的RSF/ADM共混纳米纤维膜没有细胞毒性,生物相容性较好。
表3 细胞在不同基质上培养后的OD值
Tab.3 OD value of cells after culture ondifferent substrates
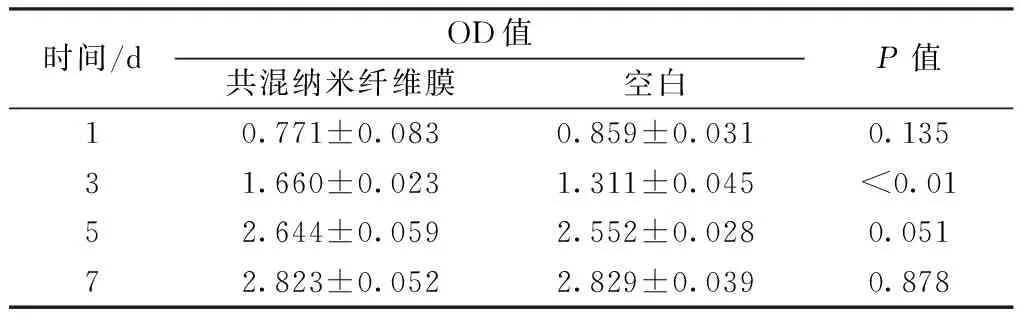
时间/dOD值共混纳米纤维膜空白P值10.771±0.0830.859±0.0310.13531.660±0.0231.311±0.045<0.0152.644±0.0592.552±0.0280.05172.823±0.0522.829±0.0390.878
3 结 论
1)在固定再生丝素蛋白(RSF)与脱细胞真皮基质(ADM)质量比为9∶1的条件下,随着纺丝液质量浓度的降低,所制得的共混纳米纤维的直径逐渐减小,纺丝过程从可纺性较差堵塞针头到纺丝过程较为稳定,再到纺丝出现纺锤形、球形变化。在质量浓度为13 g/mL时,所纺得的RSF/ADM纳米纤维的形态较为均匀,平均直径为616 nm,可纺性较好。
2)其他条件相同的情况下,随着共混纺丝液中ADM占比的提高,RSF/ADM纺丝液的表观流动性逐步降低,黏度提高,可纺性逐渐变差,纤维形态规整性下降,直至最后无法形成纤维。
3)与纯RSF纳米纤维膜相比,RSF/ADM共混纳米纤维膜中随ADM加入比例的提高, RSF与ADM中的主体成分胶原蛋白形成了氢键,部分无规构型及α螺旋结构逐渐向β折叠结构转变,共混纳米纤维膜的结晶度提高。
4)细胞增殖实验的结果表明,静电纺过程中使用的有机溶剂甲酸没有残留,细胞可以在RSF/ADM共混纳米纤维膜上正常生长、增殖,具有良好的生物相容性。

