脱氢表雄酮抑制高脂诱导的血小板源生长因子表达及细胞色素P450芳香酶基因在其中的作用
周颖 赵敏 李桃 陈艳昕 黄江梅
(秦皇岛市第一医院病理科,河北 秦皇岛 066000)
脱氢表雄酮(DHEA)是人体内最丰富的来源于肾上腺的甾体激素。研究显示DHEA有抗动脉粥样硬化(AS)作用〔1,2〕,但其机制尚不清楚。血小板源生长因子(PDGF)具有趋化作用,是AS发生发展过程中的主要因子〔3~5〕。本研究拟观察DHEA对高脂诱导的兔主动脉及人脐静脉内皮细胞(HUVEC)PDGF表达的影响,同时观察过表达细胞色素P450芳香酶基因(CYP19)能否增强DHEA的抗AS作用,从而探讨DHEA抗AS的可能机制。
1 材料和方法
1.1 细胞培养和分组 用胰酶消化法原代培养HUVEC,并传代。将生长良好的HUVEC更换无血清DMEM/F12培养基培养12 h后随机分成6组:①正常对照组无血清培养基;②氧化型低密度脂蛋白(ox-LDL)组无血清培养基+35 mg/L ox-LDL;③ox-LDL+DHEA(低浓度)组无血清培养基+35 mg/L ox-LDL+0.1 μmol/L DHEA(Fluka公司);④ox-LDL+DHEA(高浓度)组无血清培养基+35 mg/L ox-LDL+1.0 μmol/L DHEA;⑤ox-LDL+DHEA+全反式维甲酸(ATRA)组无血清培养基+35 mg/L ox-LDL+1.0 μmol/L DHEA+0.01 μmol/L ATRA;⑥DHEA组无血清培养基+1.0 μmol/L DHEA。24 h后收集细胞及上清液。
1.2 实时荧光定量聚合酶链反应(PCR)检测HUVEC PDGF mRNA的表达 按Trizol(Invitrogen公司)试剂盒说明书分别提取各组HUVEC总RNA,反转录获得cDNA,采用实时荧光定量PCR试剂盒进行PCR。反应条件:95℃ 3 min;94℃ 20 s,58℃ 20 s, 68℃ 20 s,40个循环。GAPDH基因为内参,运用2-△△Ct法计算目的基因的相对表达量。PCR引物由Gene Copoeia 公司合成,PDGF上游引物序列为5′-CTCCATCCGCTCCTTTGAT-3′,下游引物序列为5′-ACTTTCGGTGCTTGCCTTT-3′;GAPDH上游引物序列为5′-GCTGGGGCTCACCTGAAGGG-3′,下游引物序列为5′-GGATGACCTTGCCCACAGCC-3′ 。
1.3 酶联免疫吸附试验(ELISA)检测HUVEC PDGF蛋白的表达 在含有PDGF酶标抗体(mAb)包被的酶标板上,加入不同浓度的PDGF标准品和收集的各组HUVEC上清液各0.1 ml,37℃孵育1 h,加入辣根过氧化物酶标记的工作液37℃孵育1 h,邻苯二胺底物液暗处反应10 min,终止。酶标仪492 nm处的测吸光度值(A)表示PDGF蛋白,根据标准曲线得出相应的PDGF蛋白量。
1.4 HUVEC转染 采用脂质体转染法,将pcDNA3.1-CYP19-绿色荧光蛋白(GFP)真核表达质粒体外转染至HUVEC(CYP19转染组),按LipofectamineTM2000脂质体转染试剂盒(Invitrogen公司) 说明书操作。同时以转染空质粒pcDNA3.1-GFP(空质粒组)及未经转染的HUVEC(未转染组)作为对照。
1.5 实时荧光定量PCR检测转染后 CYP19 mRNA的表达 按Trizol试剂盒说明书提取转染48 h后的1.4中3组细胞的总RNA,反转录获得cDNA,采用实时荧光定量PCR试剂盒进行PCR。反应条件:95℃ 3 min;94℃ 30 s,58℃ 30 s, 72℃ 30 s,40个循环。GAPDH基因为内参,运用2-△△Ct法计算目的基因的相对表达量。CYP19上游引物序列为5′-TGGAAGGATGCACAGACTCG-3′,下游引物序列为5′-TGACCAGCCTTCTCTAGTGTTCC-3′;GAPDH上游引物序列为5′-GCTGGGGCTCACCTGAAGGG-3′,下游引物序列为5′-GGATGACCTTGCCCACAGCC-3′ 。
1.6 转染细胞分组及PDGF表达的检测 将转染后的HUVEC分为6组:①CYP19组:无血清培养基;②CYP19+ox-LDL组:无血清培养基+35 mg/L ox-LDL;③CYP19+ox-LDL+DHEA组:无血清培养基+35 mg/L ox-LDL+1.0 μmol/L DHEA;④空质粒组:无血清培养基;⑤空质粒+ox-LDL组:无血清培养基+35 mg/L ox-LDL;⑥空质粒+ox-LDL+DHEA组:无血清培养基+35 mg/L ox-LDL+1.0 μmol/L DHEA。各组转染细胞在药物作用24 h后,用实时荧光定量PCR和ELISA法分别检测PDGF mRNA和蛋白的表达,方法同1.2和1.3。
1.7 动物模型的制备和分组 新西兰大耳白兔25只,体重2.5~3.0 kg,成年雄性。平均分成5组:①正常对照组:常规饲料。②高脂组:高脂饲料(1%胆固醇、3%猪油)。③高脂+DHEA组:高脂饲料+0.3% DHEA。④高脂+DHEA+ATRA组:高脂饲料+0.3% DHEA+0.5 mg/(kg·d)ATRA。⑤单DHEA组:常规饲料+0.3% DHEA。各组按以上饮食喂养10 w后处死,从主动脉弓处取两段动脉壁,一段-80℃冰箱冻存,另一段4%多聚甲醛固定。
1.8 实时荧光定量PCR检测主动脉PDGF mRNA表达 按Trizol试剂盒说明书分别提取各组冻存兔主动脉的总RNA,反转录获得cDNA,采用实时荧光定量PCR试剂盒进行PCR。反应条件:95℃ 3 min;94℃ 20 s,58℃ 20 s, 72℃ 20 s,40个循环。GAPDH基因为内参,运用2-△△Ct法计算目的基因的相对表达量。PDGF上游引物序列为5′-TGCGGATACCTCGCCCAT-3′,下游引物序列为5′-GGTCGACCTGACTCCTGG-3′;GAPDH上游引物序列为5′-GCGCCTGGTCACCAGGGCTGCTT-3′,下游引物序列为5′-TGCCGAAGTGGTCGTGGATGACCT-3′。
1.9 免疫组化法检测主动脉PDGF蛋白表达 将用多聚甲醛固定好的主动脉石蜡包埋切片。石蜡切片脱蜡、水化后,用免疫组化链霉菌抗生物素蛋白-过氧化物酶(SP)法染色(福州迈新生物技术开发公司):3%过氧化氢灭活内源性过氧化氢酶,微波抗原修复,山羊血清封闭,滴加1∶400稀释的兔抗兔PDGF多克隆抗体,滴加1∶1稀释的酶标二抗,二氨基联苯胺(DAB)显色,苏木素复染,常规脱水、封片。各组PDGF蛋白的相对表达量以细胞内棕黄色颗粒的平均吸光度值(A)表示,采用Image J图像分析系统检测。
1.10 统计学分析 采用SPSS17.0软件进行单因素方差分析,SNN-q检验。
2 结 果
2.1 HUVEC PDGF mRNA和蛋白表达 ox-LDL组PDGF mRNA和蛋白表达较正常对照组明显升高(P<0.05)。ox-LDL+DHEA(低浓度)组、ox-LDL+DHEA(高浓度)组、ox-LDL+DHEA+ATRA组、DHEA组、PDGF mRNA和蛋白表达与ox-LDL组比较均明显降低(P<0.05)。与ox-LDL+DHEA(高浓度)组比较,ox-LDL+DHEA(低浓度)组PDGF mRNA和蛋白质表达显著增加(P<0.05),正常对照组、DHEA组PDGF mRNA和蛋白表达均显著降低(P<0.05)。见表1。
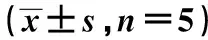
表1 各组HUVEC PDGF mRNA及蛋白表达
与ox-LDL组比较:1)P<0.05;与ox-LDL+DHEA(高浓度)组比较:2)P<0.05
2.2 CYP19转染HUVEC后其mRNA表达 CYP19转染组CYP19 mRNA的表达(4.06±0.20)均高于空质粒组(1.09±0.19)及未转染组(1.00±0.15,P<0.05)。
2.3 转染CYP19对PDGF表达的影响 CYP19+ox-LDL+DHEA组PDGF mRNA及蛋白的表达较空质粒+ox-LDL+DHEA组均显著降低(P<0.05)。见表2。
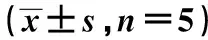
表2 各组转染细胞PDGF mRNA及蛋白的表达
与CYP19+ox-LDL组比较:1)P<0.05;与CYP19+ox-LDL+DHEA组比较:2)P<0.05
2.4 主动脉PDGF mRNA和蛋白的表达 高脂组PDGF mRNA和蛋白的表达较正常对照组明显升高(P<0.05),表现为明显增厚的内膜中见大量棕黄色颗粒。高脂+DHEA组PDGF mRNA和蛋白的表达较高脂组明显降低(P<0.05),内膜厚度较高脂组薄,内膜中棕黄色颗粒的数量较高脂组少、颜色较高脂组淡。单DHEA组与正常对照组、高脂+DHEA+ATRA组与高脂+DHEA组PDGF mRNA和蛋白表达均无显著性差异(均P>0.05)。见表3,图1。
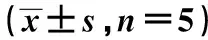
表3 各组主动脉PDGF mRNA及蛋白的表达
与高脂组比较:1)P<0.05;与高脂+DHEA组比较:2)P<0.05

图1 各组主动脉PDGF蛋白表达情况 (SP,×100)
3 讨 论
DHEA是性激素合成的前体物质〔6〕, DHEA 及脱氢表雄酮硫酸盐(DHEAS)血清水平随着成人年龄的增长而不断降低,研究认为它们的缺乏可能与AS等许多老年性慢性疾病的病理生理学发生机制相关〔7,8〕。研究者在老年男性和更年期妇女中发现〔9〕,调整年龄后,高水平的DHEA与颈动脉内膜-中膜厚度呈负相关,提示老年人生理范围内的DHEA与颈AS的危险性有关。刘佳〔10〕研究发现,DHEA 可抑制由PDGF-BB诱导的丝裂素活化蛋白激酶(MAPK)活性,进而抑制大鼠血管平滑肌细胞增殖。本研究模型组兔主动脉内膜有明显脂纹形成,表明模型构建成功。以往研究结果显示DHEA对血脂水平的影响不大,DHEA的抗AS作用不依赖于血脂水平的改变〔11〕。本研究结果提示DHEA能够抑制兔主动脉及HUVEC PDGF的表达。DHEA单独存在时对PDGF的表达无明显影响。由此推断,DHEA能够特异性的抑制高脂诱导的PDGF表达是其抗AS的机制之一。
DHEA在体内主要是在细胞内CYP19的作用下降解成雌酮而发挥作用〔12,13〕。由此推想,过表达CYP19,增加细胞内CYP19的活性,应该可以特异性地加强DHEA在血管局部发挥的抗AS作用。本实验说明过表达CYP19能够增强DHEA抑制高脂诱导的PDGF表达的作用。同时本课题组另有实验也已证明过表达CYP19同样能够增强DHEA抑制高脂诱导的基质金属蛋白酶(MMP)-9、MMP-2、巨噬细胞炎性蛋白(MIP)-1α表达的作用〔14~16〕。研究指出,CYP19具有多个启动子,在血管内皮细胞中由启动子1.6发挥作用,推测补充ATRA可以激活维甲酸受体,后者被激活后可通过1.6启动子增强CYP19表达〔17〕,从而增强DHEA的抗AS作用。本研究推测可能由于ATRA通过1.6启动子对CYP19表达的增强是有限的,ATRA能否增强DHEA的抗AS作用及其可能机制有待进一步研究。
——一道江苏高考题的奥秘解读和拓展

