小鼠生殖细胞特异性转录因子SOHLH1调控Sox30基因表达的机制
齐婉婧,孙 奇,李 媛,张 雪,金美玉,何 岩,郑志红
(中国医科大学实验动物部,沈阳 110001)
雄性生殖细胞经历一系列特定基因程序性表达,使具有有丝分裂活性的原始生殖细胞发育为成熟精子的过程被称为精子发生。精子发生起源于精原干细胞,经历精原细胞的有丝分裂期和精母细胞的减数分裂期[1],在精子形成期圆形精子细胞经历复杂的结构重塑最终成为成熟精子[2]。精卵发生特异表达螺旋-环-螺旋转录因子1 (Spermatogenesis- and oogenesis-specific bHLH transcription factor-1,Sohlh1)编码357个氨基酸含有一个bHLH结构域,SOHLH1可以形成异源二聚体或同型二聚体并与DNA上的E-box序列(CANNTG)结合[3]调控下游基因表达。SOHLH1在雄性生殖细胞中特异表达,主要表达于A1-A4型精原细胞,在Int型及B型精原细胞中该蛋白逐渐消失[4]。SOHLH1是涉及精原细胞分化的重要转录因子[4],调控c-Kit表达[5]、与SOHLH2形成异源二聚体下调Stra8表达[6-8]并参与精子发生相关的重要信号通路[9]从而影响精原细胞发育和减数分裂。本课题组前期研究发现Sohlh1基因敲除纯合子雄性小鼠不育,精原细胞发育及分化异常导致进入减数分裂的精母细胞减少,精母细胞大量凋亡,无成熟精子产生。基因芯片检测结果显示出生后7天野生型雄鼠与Sohlh1基因敲除雄鼠睾丸组织中Sox30、Rnf17等精子发生中关键基因均出现表达差异[10],推测SOHLH1可能直接或间接调控Sox30基因转录。
Sox30是睾丸生殖细胞特异表达基因Sox(Sry-related High Motility Group (HMG) box)家族H亚族唯一的成员,含有3个外显子,编码蛋白具有一个HMG box结构域[11],参与性腺发生、精子发生[12]并且与顶体形成相关[13]。Sox30基因敲除雄性小鼠无生育能力,精子发生阻滞于精子形成期,圆形精子细胞核表面没有参与顶体形成的顶体颗粒[14]。目前,关于转录因子调控Sox30表达未见文献报道。我们利用生物信息学预测Sox30基因上游启动子区域,发现存在SOHLH1转录因子结合的E-box序列,本研究旨在探究精原细胞早期发育相关的重要转录因子SOHLH1参与精子发生后期相关基因Sox30的转录调控机制,并进一步筛选Sox30基因启动子序列上SOHLH1特异性结合位点的DNA序列。
1 材料和方法
1.1 实验动物
本实验中共使用7周龄的SPF级C57BL/6J雄性小鼠9只(三次重复实验),体重约22~24 g(误差不大于10%),来源于中国医科大学实验动物部[SCXK(辽) 2018-0004]。取材在中国医科大学实验动物科学部屏障动物实验设施进行[SYXK(辽)2018-0008],并按实验动物使用的3R原则给予人道的关怀。本实验经中国医科大学实验动物福利与伦理委员会(Institutional Animal Care and Use Committee, IACUC)审查通过,审批编号:No. 2017018。
1.2 主要试剂与仪器
Tris平衡酚(鼎国生物技术有限公司,北京),PCR引物(Genescript,南京),Q5® High-Fidelity DNA Polymerase(Cat.#M0491S,NEB,美国),Axygen mini-prepare 质粒提取试剂盒(Cat.AP-MN-P-50)、AxyPrep DNA凝胶回收试剂盒(Cat.AP-GX-50)、AxyPrep PCR清洁试剂盒(Cat.AP-PCR-50)(Axygen,美国),pMD18-T Vector、E.coliDH5α感受态大肠杆菌、限制性内切酶HindⅢ和KpnⅠ(宝生物公司,大连),pGL3-Basic质粒、pRL-TK质粒(Promega,美国),T4DNA连接酶(NEB,美国),pcDNA3.0-Sohlh1真核表达质粒(本课题组构建)[15],转染试剂LipofectamineTM3000(Invitrogen,美国),Dual-Luciferase® Report Assay Systerm试剂盒(Cat.# E1980,Promega,美国),EZ-ChIPTM-Chromatin Immunoprecipitation Kit试剂盒(Cat#17-371RF,Millipore,美国),SOHLH1抗体(3∶50,ab41520,Abcam,美国),PCR仪(Bio-Rad,美国),Galaxy R二氧化碳培养箱(RS Biotech,德国),多功能酶标仪(M200 PRO,Tecan,瑞士)。
1.3 实验方法
1.3.1 基因组DNA提取
剪取成年C57BL/6J雄鼠0.5 cm鼠尾组织,放入1.5 mL 离心管中并分别加入500 μL鼠尾消化液和5 μL蛋白酶K,55℃水浴锅中消化过夜。鼠尾消化液配置方法如下:取NaCl 2.93 g,SDS 2.5 g,1 mol/L Tris-HCl(pH 8.0)5 mL,0.5 M EDTA(pH 8.0)10 mL混匀后定容至500 mL。酚氯仿法提取基因组DNA,产物4℃保存。
1.3.2Sox30基因启动子区域SOHLH1结合位点分析及引物设计
针对Sox30转录起始位点上游2000 bp范围内启动子DNA序列使用Jasper软件预测SOHLH1特异性结合位点E-box(CANNTG),根据评分及位点分布设计合成引物,构建三个启动子荧光表达质粒1784 bp-Sox30-promoter、984 bp-Sox30-promoter、876 bp-Sox30-promoter,启动子区域PCR引物序列为Sox30-JD1784-F:5’-TCTGCTTGATATCCTTCCCTTT CA-3’,Sox30-JD1784-R:5’- GTGCGAGAACCCTGG AATCA-3’,Sox30-JD984-F:5’-TTACTCAACAGTCG GCAC-3’,Sox30-JD984-R:5’-CGAGAACCCTGGAA TCAT-3’,Sox30-JD876-F:5’- AAGCACTTCAAAGGA CAT-3’,Sox30-JD876-R:5’- CGAGAACCCTGGAA TCAT-3’。
1.3.3 PCR扩增Sox30基因启动子片段
以C57BL/6J雄鼠鼠尾DNA为模板进行PCR扩增,在50 μL PCR反应总体系内使用Q5® High-Fidelity DNA Polymerase扩增所需DNA片段,反应条件:98℃ 8 s,54℃ 30 s,72℃ 1 min,30个循环,72℃延伸10 min。1.5%琼脂糖凝胶电泳进行PCR扩增产物检测,切胶回收目的片段。
1.3.4 构建Sox30启动子全长和截短序列的pGL3-Sox30荧光素酶报告质粒
纯化回收的DNA片段与pMD18-T Vector 16℃连接过夜。连接产物转化E.coliDH5α感受态大肠杆菌,提取质粒DNA进行测序,筛选正确连接的菌种提取质粒。限制性内切酶HindⅢ和KpnⅠ双酶切所提取的Sox30质粒DNA和pGL3-Basic质粒载体骨架,使用TaKaRa公司说明书提供的双酶切体系。T4DNA连接酶反应体系16℃连接过夜,连接产物转化感受态大肠杆菌,挑菌落克隆提取质粒DNA,测序鉴定。
1.3.5 转染293T细胞并检测双荧光素酶报告基因系统荧光素酶活性
于37℃、5% CO2的培养箱中培养HEK293T细胞,当细胞处于对数生长期时,将细胞接种于96孔板中培养16 h,汇合度达到80%时进行转染。将构建好的pGL3-Sox30启动子萤光素酶报告质粒(0.4 μg/孔)、pcDNA3.0-Sohlh1真核表达质粒(0.4 μg/孔)和内参pRL-TK质粒(0.008 μg/孔)按照LipofectamineTM3000实验手册共转染293T细胞。
37℃、5% CO2在培养箱中培养48 h后,将共转染的HEK293T细胞取出,弃掉96孔板中培养基,每孔加入100 μL 1×PBS清洗细胞,弃掉PBS。根据Dual-Luciferase® Report Assay Systerm操作手册指导,样品放入M200 PRO多功能酶标仪检测萤火虫荧光素酶活性及海肾荧光素酶活性,保存数据进行计算及统计分析。
1.3.6 染色质免疫共沉淀(ChIP)实验筛选SOHLH1结合位点
颈椎脱位法处死成年C57BL/6J雄鼠取双侧睾丸组织剥离出曲细精管,实验方法参照文献所述[10],甲醛处理新鲜睾丸组织DNA与蛋白交联,按照EZ-ChIPTM- Chromatin Immunoprecipitation Kit试剂盒说明书提取SOHLH1抗体结合的DNA片段。根据双荧光素酶报告基因实验筛选出的Sox30核心启动子片段及SOHLH1结合位点设计ChIP实验所需qRT-PCR引物(引物序列分别为ChIP-892 bp-105F:5’-ATTACTCAACAGTCGGCACTGG-3’,ChIP-892 bp-105R:5’- TGTGTGATTATTCTGCGCCTC-3’,ChIP-837 bp-177F:5’- GAGGCGCAGAATAATCAC-3’,ChIP-837 bp-177R:5’- AGGACGCTTTAGCAAG TC-3’,ChIP-449 bp-101F:5’- GGAGGTAGTGGGAC ATAG-3’,ChIP-449 bp-101R:5’- CCACCATTATCCT GCTTA-3’, ChIP-514 bp-151F:5’- GGTTTATCAG GCTCTGC-3’,ChIP-514 bp-151R:5’-TTGCTCT TCACCTATGT-3’)。
1.4 统计学方法
2 结果
2.1 构建pGL3-Sox30启动子区域荧光素酶报告质粒
以C57BL6/J小鼠基因组DNA为模板,PCR扩增得到长度分别为1784 bp、984 bp和876 bp的启动子区域DNA片段,双酶切后使用T4DNA 连接酶与pGL3-Basic载体连接。质粒DNA经测序并进行序列比对,证实连入载体中的启动子片段与预期一致,获得目标序列正确连接的pGL3-Sox30-876 bp、pGL3-Sox30-984 bp和pGL3-Sox30-1784 bp质粒。如图1所示。
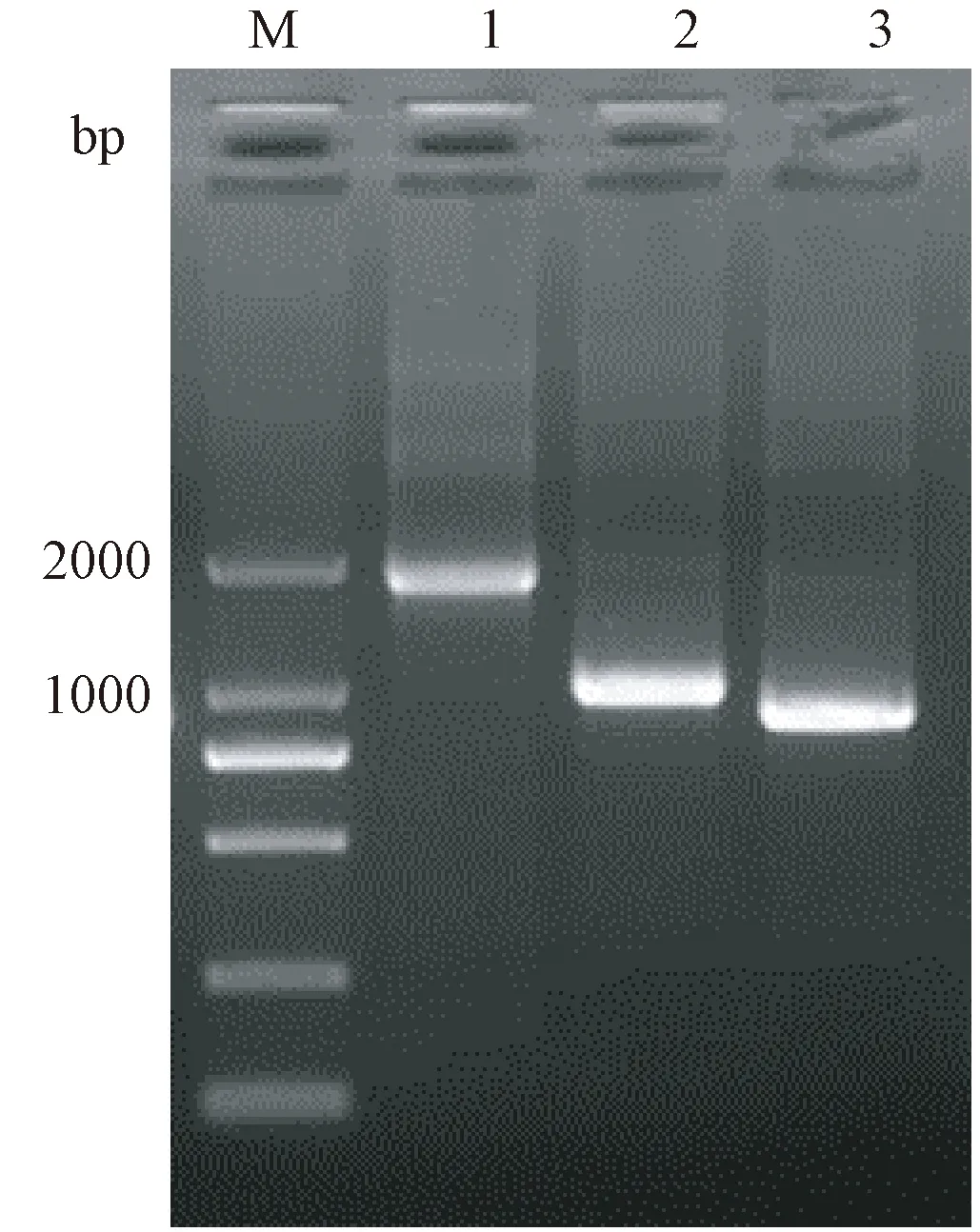
注:M:TaKaRa DL2000 Maker;孔道1:Sox30启动子1784 bp目的片段;孔道2:Sox30启动子984 bp目的片段;孔道3:Sox30启动子876 bp目的片段。图1 Sox30启动子DNA序列PCR扩增产物电泳Note. M, TaKaRa DL2000 Maker. Lane 1, Sox30 promoter 1784 bp target fragment. Lane 2, Sox30 promoter 984 bp target fragment. Lane 3, Sox30 promoter 876 bp target fragment.Figure 1 Sox30 promoter DNA sequence via PCR amplification of the electrophoresis products
2.2 双荧光素酶实验验证转录因子SOHLH1对Sox30基因启动子区的转录调节作用
将构建好的pGL3-Sox30启动子区域萤光素酶报告质粒、pcDNA3.0-Sohlh1真核表达质粒和内参TK共同转染293T细胞,检测不同启动子片段的荧光素酶活性,进行统计分析比较(图2)实验结果显示,共同转染Sox30启动子荧光表达载体和pcDNA3.0-Sohlh1真核表达质粒的实验组与转染pGL3-Basic空载载体的对照组相比,实验组的荧光强度有不同程度增强,SOHLH1可以激活Sox30基因转录,证明该基因存在延时翻译现象。共转染了pGL-Sox30-876 bp质粒的实验组荧光活性最强,推测Sox30核心启动子片段位于区域内。
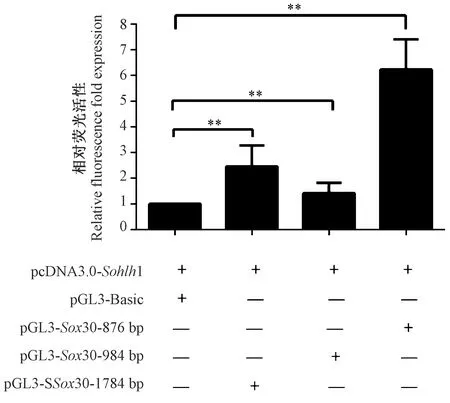
注:误差线代表重复实验的平均数±标准误差;**P<0.01。图2 转录因子SOHLH1对Sox30基因启动子序列转录调控作用Note. Error bars represent the mean ± standard error of repeated experiments. **P<0.01.Figure 2 Transcriptional regulation of the Sox30 gene promoter sequence by the transcription factor SOHLH1
2.3 ChIP实验筛选转录因子SOHLH1与Sox30基因启动子区的主要结合位点
ChIP实验中与SOHLH1抗体结合的DNA片段洗脱纯化后qRT-PCR进行检测。ChIP结果(见图3)显示SOHLH1可以结合于Sox30启动子片段-876 bp中-544 bp E-box (CAACTG)、-489 bp E-box(CAGGTG)、-166 bp E-box(CAACTG)、-101 bp E-box(CATATG),这四个E-box位点起直接转录激活作用。SOHLH1与-489 bp (CAGGTG)位置E-box位点的结合作用较强,预示此位点为Sox30基因启动子上的主要转录激活位点。
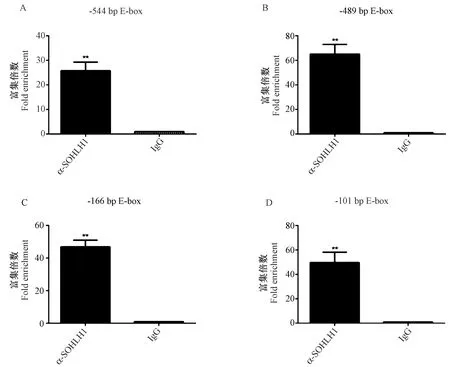
注:A:Sox30 -544 bp E-box (CAACTG) ChIP实验结果;B:Sox30 -489 bp E-box (CAGGTG) ChIP实验结果;C:Sox30-166 bp E-box (CAACTG) ChIP实验结果;D:Sox30 -101 bp E-box (CATATG) ChIP实验结果。IgG:阴性对照;误差线代表三次重复实验的平均数±标准误差;与IgG相比,**P<0.01。图3 转录因子SOHLH1与Sox30基因启动子序列上E-box位点的结合作用Note. A, Sox30 -544 bp E-box (CAACTG) ChIP test result. B, Sox 30-489 bp E-box (CAGGTG) ChIP test result. C, Sox30 -166 bp E-box (CAACTG) ChIP test result. D, Sox30 -101 bp E-box (CATATG) ChIP test results. IgG was the negative control. Error bars represent the mean ± standard error of three replicate experiments. Compared with IgG, **P<0.01.Figure 3 Binding of the transcription factor SOHLH1 to the E-box site on the Sox30 gene promoter sequence
3 讨论
在雄性小鼠中SOHLH1蛋白特异表达于精原干细胞和A1-A4型精原细胞中,是精子发生过程中关键的转录因子[4]。Sox30基因编码的SOX30蛋白具有一个HMG box结构域,是性腺发生和精子发生中顶体形成相关的转录因子[11-14]。本研究构建了Sox30启动子荧光素酶质粒,利用Sohlh1真核表达质粒进行共转染实验,通过荧光素酶活性检测实验证明SOHLH1对Sox30基因存在直接转录激活作用。并且通过ChIP实验证明SOHLH1结合于Sox30基因转录起始位点上游-544 bp、-489 bp、 -166 bp和-101 bp处的E-box序列对Sox30产生直接转录激活作用,并发现位于-489 bp (CAGGTG)位置的E-box位点与转录因子SOHLH1的结合作用较强,预示着此E-box位点为Sox30基因启动子上的主要转录激活位点,表明精原细胞早期发育相关转录因子SOHLH1可以直接激活精子发生相关基因Sox30的转录。
SOHLH1在精原细胞中表达,Sox30 mRNA在出生后4-7天雄鼠睾丸组织中可通过RT-PCR检测到,此阶段的睾丸组织中只存在精原干细胞和精原细胞,说明此时Sox30 mRNA的转录发生于这两种细胞内,与本研究中所证实的SOHLH1在精子发生早期直接激活Sox30基因转录的调控机制相符。而SOX30蛋白存在于精子发生后期的圆形精子细胞中,对顶体形成的过程起关键作用[14],结合本研究的结论,说明在精子发生的早期Sox30基因就被激活转录,mRNA处于翻译抑制状态直至圆形精子阶段才启动翻译。由于这两种转录因子表达及翻译的时空特异性,推测本文所证实的SOHLH1直接调控Sox30基因转录的机制涉及了精子发生中存在的延时翻译现象。在精子发生过程中,参与精子形成相关的基因甚至在雄性生殖细胞发育的早期如精原细胞中已经开始转录,mRNA在细胞发育至后期时才被翻译为蛋白质并发挥功能[16-21]。虽然目前关于延迟翻译现象的推论较多,但延迟翻译基因的具体表达调控机制尚不清楚。本研究通过证明精子发生早期精原细胞中重要转录因子SOHLH1对圆形精子细胞顶体形成相关基因Sox30的直接转录调控机制,丰富了精子发生中延时翻译表达调控的现象,并为精原细胞延迟翻译调控机制的研究提供了线索。
——一道江苏高考题的奥秘解读和拓展

