高脂血症食蟹猴模型的建立及初步分析
唐明甜,肖百全,徐世千,李比海,刘忠华,饶军华*
(1.广东省生物资源应用研究所,广东省动物保护与资源利用重点实验室,广东省野生动物保护与利用公共实验室,广州 510260; 2.华南农业大学实验动物中心,广州 510642)
近年来,随着我国人口老龄化进程的加快以及饮食结构的改变,血脂异常总体患病率呈快速上升趋势,主要表现为高血脂。高血脂是冠心病、心肌梗死、心脏性猝死的重要危险因素[1]。目前,高脂血症及其并发症几乎占了全球死亡率的50%[2],每年造成的经济损失高达1000亿美元。其发病率高、分布广,且呈年轻化趋势[3-4]。因此,高脂血症动物模型对于脂代谢性疾病以及由高血脂症继发的心脑血管疾病的研究具有重大意义[5]。目前,已报道的用于高脂血症动物模型研究的实验动物主要有兔、大鼠、小鼠等[5-7],模型相对成熟。然而,近年来全球范围内生物制品类药物研发非常迅速,已经成为生物医药主要的增长点。生物制品类药物有其自身特点,其中种属特异性是该类药物研发时需要着重考量的因素,例如2017年美国FDA批准的首个生物制品类降脂药Praluent(PCSK9抑制剂[8])在临床前毒理学研究中大量使用灵长类动物,其主要原因为该类药物和灵长类动物之间存在交叉反应,而与啮齿类动物不存在交叉反应,即Praluent给药后可在灵长类动物体内发生药理学和/或毒理学效应,而不会与啮齿类动物的组织产生反应,丧失其药理学和毒理学的作用基础。目前,采用半流质膳食乳剂模拟人类高脂血症发病进程的灵长类动物模型尚未见报道[9-13]。
相比较于其他常用高脂血症实验动物,非人灵长类实验动物(NHP)具有以下优点:(1)NHP在基因、生理、生化指标和解剖学等方面都比其他动物更接近人类;(2)发病机制及伴随的风险因子也与人类疾病高度相似;(3)NHP有较长的生命周期;(4)能为药物的发现提供十分重要的临床前信息,特别是对于生物制品类药物,灵长类动物具有明显种属的优势;(5)从NHP实验获得的数据确保了将来临床应用的更高的效率和可靠性,使NHP成为临床前研究的“黄金标准”。
在此背景下,本研究选用食蟹猴为研究对象,模拟人类过度摄入高糖高脂饮食,采用灌胃法给予半流质高糖高脂膳食乳剂诱导建立高脂血症食蟹猴模型,旨在丰富现有高脂血症灵长类动物模型库,为生物制品类降脂药的研发提供合适、理想的动物模型。
1 材料与方法
1.1 实验动物
普通级雄性食蟹猴22只,来源于广东蓝岛生物技术有限公司[SCXK(粤)2014-0010],成年组10只(对照组5只,处理组5只),体重4~6 kg,5~7岁;中老年组12只(对照组6只,处理组6只),体重7~10 kg,10~12岁。动物均饲养于广东省生物资源应用研究所灵长类实验动物研究中心普通级动物实验室(12 h/12 h昼夜周期,湿度40%~70%,温度16℃~26℃)[SYXK(粤)2018-0187]。本研究所涉及的动物实验方案经广东省蓝岛生物技术有限公司实验动物使用与管理委员会(IACUC)批准(LD20150518),并按实验动物使用的3R原则给予人道的关怀。
1.2 主要试剂与仪器
胆固醇(广州威佳科技有限公司);胆酸盐(广州威佳科技有限公司);蔗糖(广州华侨食品专营店);猪油(广州市肉联厂);舒泰50(Zoletil 50)麻醉剂。SANLI一次性使用人体静脉血样采集容器;离心管(Eppendorf管)1500 μL/2000 μL;离心机(Eppendorf Centrifuge 5810R);全自动生化析仪(Hitachi 7020、7180)。
1.3 实验方法
1.3.1 膳食给喂方法
对照组雄性食蟹猴每日正常饲养,处理组雄性食蟹猴每日与对照组雄性食蟹猴一致,给予常规猴维持饲料。同时,根据雄性食蟹猴体重每日通过鼻饲管灌喂一次半流质高糖高脂膳食乳剂(膳食乳剂均为每日现配),每只每天的灌胃剂量为5 mL/kg,每周6 d,连续灌喂21个月,每日记录雄性食蟹猴临床症状(例如活动、精神、粪便状况等)。诱导过程中半流质高糖高脂膳食乳剂给予量每两个月随雄性食蟹猴体重增减进行调整。
半流质高糖高脂膳食乳剂质量比配方为:蔗糖∶猪油∶胆固醇∶胆酸盐=10∶10∶1∶0.5,将各组份按其含量混合均匀,加热至约50℃,搅拌均匀乳化即得膳食乳剂。
1.3.2 体重、BMI动态监测
每2个月监测一次雄性食蟹猴的体重并计算BMI,计算方法:BMI=体重(kg)/身高(m2),非人灵长类动物的身高为坐高[14]。
1.3.3 血脂四项的测定
采血前禁食约12~14 h后,后肢静脉采血2 mL,离心10 min(4℃,3000 r/min),分离血清,于-80℃冻存备用。TC、TG采用氧化酶法测定, HDL-C、LDL-C采用直接法,用日立(Hitachi 7020、7180)全自动生化检测仪检测。
1.4 统计学方法
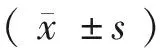
2 结果
2.1 雄性食蟹猴体重、BMI结果
与成年对照组相比,在造模期间,成年处理组雄性食蟹猴体重和BMI每个月均上升,但未见明显改变(P>0.05)。与中老年对照组相比,中老年处理组雄性食蟹猴在造模第5月体重上升,但改变不明显(P>0.05)。在造模期间体重和BMI均未见明显改变(P>0.05)。如图1、图2所示。
成年雄性食蟹猴中,造模后因机体抵抗力较强,且因年龄较小,体重未达到稳定,所以呈缓慢、均匀上升趋势;中老年处理组雄性食蟹猴,在造模前后体重和BMI出现短暂的升高或基本持平,但在造模的中后期,由于灌喂了较长时间,可能引起机体的脂代谢紊乱,从而表现为体重和BMI的下降。

注:A:成年食蟹猴;B:中老年食蟹猴。图1 雄性食蟹猴体重变化Note. A, Adult cynomolgus monkeys. B, Middle-aged and old cynomolgus monkeys.Figure 1 Changes in body weight of the male cynomolgus monkeys
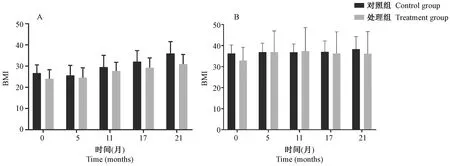
注:A:成年食蟹猴;B:中老年食蟹猴。图2 雄性食蟹猴BMI变化Note. A, Adult cynomolgus monkeys. B, Middle-aged and old cynomolgus monkeys.Figure 2 Changes in BMI of the male cynomolgus monkeys
2.2 造模前后雄性食蟹猴血脂对比结果
2.2.1 甘油三酯(TG)结果
与成年对照组相比,成年处理组1~21月血清TG水平均未见明显改变(P>0.05);与中老年对照组相比,中老年处理组1~21月TG水平均未见明显改变(P>0.05),变化如图3所示。

图3 雄性食蟹猴血清TG变化曲线图Figure 3 Curve graph of serum TG in the male cynomolgus monkeys
2.2.2 胆固醇(TC)结果
与成年对照组相比,成年处理组2~21月血清TC水平明显升高(0.01 注:与成年食蟹猴对照组相比,*0.01 2.2.3 高密度脂蛋白(HDL-C)结果 与成年对照组相比,成年处理组在处理第3、5、9月时HDL-C水平明显升高(0.01 注:与成年食蟹猴对照组相比,*0.01 2.2.4 低密度脂蛋白胆固醇(LDL-C)结果 与成年对照组相比,成年处理组除第1个月LDL-C水平未见明显改变,其它处理时间LDL-C均明显升高(0.01 注:与成年食蟹猴对照组相比,*0.01 目前国内外在进行制作高脂血症动物模型时所采用的方法多为饲喂高脂饲料,将高能量物质掺入动物饲料之中,由动物自由采食,但高脂饲料有其自身物理特点:油腻且适口性差,啮齿类动物食用高脂饲料尚可进行,但也会由于饲料硬度不足导致动物不喜食,且高脂饲料在长期试验中保存条件高,否则容易发霉变质。众所周知,灵长类动物具有较高的智商,在进食时喜爱用饲料玩耍。在正常饲养过程中,多数饲料被其玩耍丢弃而浪费,该特点决定了很难精确计算每只动物每天摄入的饲料量。初步分析这也是众多文献中报道的以高脂饲料饲养方式复制高血糖、高血脂模型时间特别长的原因,因为动物每天实际上摄入的有效热量有限,多数饲料被动物玩耍丢弃。为解决灵长类动物不能精确计算热量摄入量的问题,本研究首先将高糖、高脂等高能量的物质从饲料中分离,并通过一定的方式制备为半流质高糖高脂膳食乳剂,然后采用鼻饲灌喂的方式按照动物体重定量给予。该法的优势:(1)改善高脂饲料适口性差而导致动物不喜食、易变质、无法精确定量的不足;(2)可对动物摄入的能量(糖脂)量化,缩短模型的制作周期。 近年来,高脂血症的发病呈年轻化趋势[3-4],为对比成年人群和中老年人群在摄入高能量物质后血脂升高的差异,本文中除选用了中老年雄性食蟹猴(>10岁)为研究对象,还增加了成年雄性食蟹猴(5~7岁)进行比较,中老年和成年雄性食蟹猴都分为对照组和处理组,分组后按照体重给予半流质高糖高脂膳食乳剂。 TG结果表明,成年和中老年处理组雄性食蟹猴造模1~21月TG平均水平与相应的对照组相比均未见统计学差异,该结果提示,本研究中的半流质高糖高脂膳食乳剂配方对成年和中老年雄性食蟹猴血清TG的影响较小,连续处理21月尚未能引起雄性食蟹猴TG升高,推测该配方可能不适合用于复制高TG模型。 TC结果表明,成年和中老年处理组雄性食蟹猴在造模第3个月血清TC均明显升高,造模7个月后基本所有处理组雄性食蟹猴TC水平均大于6.2 mmol/L,高TC一直持续至造模第21月。LDL-C结果表明,成年处理组除第1个月LDL-C水平未见明显改变,其它时间LDL-C均明显升高。与中老年对照组相比,中老年处理组在第3、7、11、17、19、21个月LDL-C水平明显升高,其它时间LDL-C水平均未见明显改变。其可能的机制为高脂和高TC的摄入使动物体内血液的TC含量剧增,TC代谢障碍,从而引起机体的血脂代谢紊乱,直接导致LDL-C的代谢障碍并在体内蓄积[15],从而表现为高TC血症和高LDL-C血症。 HDL-C结果表明,造模后各造模组HDL-C平均水平均出现短暂的升高,但升高的幅度较低,高HDL-C水平持续的时间也较短,分析HDL-C出现波动的原因可能与给予半流质高糖高脂膳食乳剂有关,因为本模型为外源性糖、脂摄入性增加模型,在大量摄入胆固醇后,代偿性的促进胆固醇的排泄而引起HDL-C短暂的升高,随着造模时间的延长,基本适应了灌服胆固醇等操作,HDL-C逐渐恢复至正常水平。 本文结果表明,经半流质高糖高脂膳食乳剂造模后,雄性食蟹猴血浆TC和LDL-C水平明显升高。由于目前尚无食蟹猴高血脂判断的标准,我们参考美国胆固醇教育计划成人治疗组第三次指南[16](ATPⅢ)中人类胆固醇水平和本机构食蟹猴背景数据研究结果,可认为食蟹猴在TC大于6.20 mmol/L时即可诊断为高TC血症;在LDL-C大于3.64 mmol/L时即可诊断为高LDL-C血症。根据这个标准,本实验中成年处理组于造模第3月时5只雄性食蟹猴全部造模成功;中老年处理组至造模第3月时6只雄性食蟹猴全部造模成功,至第21月时所有处理组雄性食蟹猴的血脂依然处于高水平,所有造模成功雄性食蟹猴均为高脂蛋白血症Ⅱa表型。 根据高脂血症在临床上的分类[17-18],用半流质高糖高脂膳食乳剂诱导建立的食蟹猴模型具有高TC血症和高LDL-C血症的特征,属于高TC血症、高LDL-C血症[19-20],且该造模方法对成年雄性食蟹猴和中老年雄性食蟹猴均敏感。通过各项血脂指标分析,本研究已经建立了高脂血症食蟹猴模型,可为人类高脂血症发病机制及药物临床前药效评估研究提供理想的动物模型。


3 讨论

