不同浓度胰岛素原对大鼠肝脏细胞胰岛素敏感性的影响及意义
邵 红,杜 娟,王 锐,黄 毅
(1.吉林省人民医院,吉林 长春130021;2.长春医学高等专科学校)
高胰岛素血症和胰岛素抵抗(IR)导致2型糖尿病(T2DM)发病的分子病理学机制成为国内外研究的难点和热点。观察发现,临床应用放免法测定胰岛素,其测定值包括真胰岛素、胰岛素原(PI)及胰岛素中间代谢物。但是T2DM和糖耐量异常(IGT)的患者及动物模型中出现的高胰岛素血症,主要是PI增高引起,真胰岛素水平并不增高,掩盖了机体真胰岛素分泌不足的变化。随着医学检验的发展,现在已经能分别测定真胰岛素和PI,并推测高PI可能在DM及其并发症中有重要作用。此外,高PI水平还与高血压、冠心病、血脂异常等多种疾病密切相关,但病因尚不完全清楚,有作者认为胰岛素降解过快可能是IR的重要原因[1]。本研究采用大鼠肝脏细胞培养技术,观察不同浓度PI引起胰岛素抵抗的作用,旨在探讨PI导致T2DM的分子病理学机制。
1 材料与方法
1.1 试剂及仪器DMEM培养液(Thermo Fisher Scientific,USA),小牛血清(Gibco,Australia),PBS(国产),肝细胞消化液及纯化液(Invitrogen,USA),胰岛素原(上海),人胰岛素(Lilly,USA),青霉素(国产),链霉素(国产),Ⅳ型胶原酶(Sigma,USA),14C-2-脱氧葡萄糖(Sigma,USA)。液体闪烁仪(Beckman LS1801,USA),Gamma-C12计数器(DPC,German),800型离心机(上海)。
1.2 大鼠原代肝细胞培养参照文献方法[2,3]。健康雄性SD大鼠2只,吉林大学实验动物中心提供,体重180-200 g,分笼饲养,各12小时的明暗交替照明,标准饮水和饮食,适应性饲养1周。动物被处死前禁食水12小时。乙醚吸入麻醉,仰卧位固定,麻醉起效后,无菌条件下打开腹腔,取肝脏组织。本实验程序遵守动物福利道德原则。用胶原酶法分离纯化肝脏细胞,置于培养瓶中,冲洗,消化,转移到EP管中离心,所获得的肝细胞加入DMEM和小牛血清培养液中,青霉素10 U/ug,链霉素10 μg/uL,37℃ CO2孵箱孵育3小时。贴壁细胞用PBS冲洗,倒置显微镜下观察,具有肝细胞形态,台盼蓝染色,细胞活性大于85%,用不含小牛血清的DMEM培养液,将细胞浓度调至2×106/ml 。
1.3 分组根据预实验结果,分离后的肝细胞接种在2块24孔培养板,浓度为每孔2×105个细胞,(1)胰岛素组:含有5×107mol/L真胰岛素培养液,(2)PI-L组:用含有浓度为1×108mol/L PI的培养液,(3)PI-M组:用含有浓度为3×108mol/L PI的培养液,(4)PI-H组:用含有浓度为7×108mol/L PI的培养液,以上4组细胞均在37℃,5% CO2孵箱孵育16小时。
1.4 大鼠肝细胞的胰岛素敏感性测定4组肝细胞孵育后弃去培养液,分别用DMEM洗涤2次,加入含100 ng/mL胰岛素的DMEM培养液1 ml,在37℃,5% CO2孵箱孵育30 min,加入14C-2-脱氧葡萄糖,1.51×104Bq,终浓度6 μmol/L,孵育后用液体闪烁仪测定14C-2-脱氧葡萄糖掺入率。
1.5 大鼠肝细胞的胰岛素酶(IDE)活性测定4组细胞分别用0.05% 的胶原酶PBS缓冲液消化,然后加入10倍体积的低离子强度缓冲液,0℃作用30 min,用吸头反复吹打细胞,使细胞碎裂,溶解物离心后,取上清,用放射酶分析法测定IDE活性。用Gamma计数仪进行计数,为消除细胞数目不同对测定值的影响,IDE活性用酶比活性表示,即单位质量蛋白质的酶活性,即mol/s/mg 蛋白表示。

2 结果
PI-M组和PI-H组大鼠肝细胞的14C-2-脱氧葡萄糖掺入率降低,低于胰岛素组,P<0.05。见表1 和图1。 PI-M组和PI-H组大鼠肝细胞的IDE活性增高,高于胰岛素组,P<0.05。见表1 和图2。
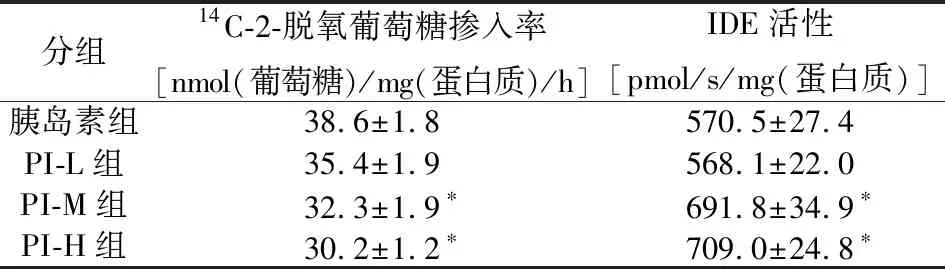
表1 四组大鼠原代肝细胞体外培养胰岛素敏感性及IDE活性比较
*P<0.05,与胰岛素组比较
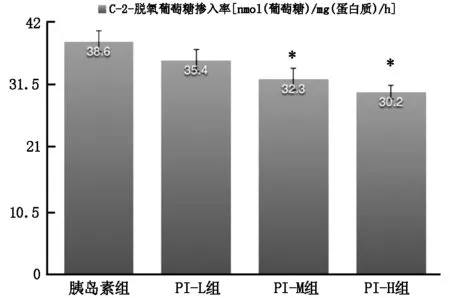
图1 四组大鼠原代肝细胞体外培养胰岛素敏感性比较
3 讨论
本研究采用体外细胞培养技术,分离培养大鼠原代肝细胞,这样实验条件单一而固定,相比在体实验干扰因素少。该细胞模型具有较好的稳定性,可观察在单纯情况下IR的发生,是观察细胞IR的理想模型。
PI是胰岛素的前体物质,由胰岛β细胞合成和分泌。生理情况下,只有极少量的PI释放入血,在正常胰腺β细胞分泌的总胰岛素中,PI所占比例不超过5%,应用刺激胰岛素分泌的物质,这一比例也无明显增高。因此,外周血中既有胰岛素和C肽,又存在PI。而高PI导致胰岛素原前体基因几乎只在胰岛β细胞表达,对维持胰岛素的分泌至关重要,葡萄糖是该基因的主要生理性调节剂。慢性高血糖和高血脂可通过抑制PI前体基因表达[4],胰岛β细胞释放PI增多,血中PI水平相应升高,促进T2DM中β细胞的损伤。在T2DM 和IGT患者以及DM患者一级亲属中,PI明显增高,可占总胰岛素50%。有学者依据PI占总胰岛素比例来统计IGT人群,发现该比例越高,2年后转变为DM的人数越多[5]。因此,认为PI升高可做为预测T2DM发病的指标,并认为PI可能是部分T2DM病人的遗传标志。但是PI增高的原因尚不清楚,为探讨 PI比例增高的直接原因,本研究观察不同浓度PI引起大鼠肝细胞模型IR,与胰岛素引起的IR做对比研究,探讨PI升高在T2DM发病机制中的作用及其与浓度的相关性。

图2 四组大鼠原代肝细胞体外培养IDE活性比较
14C-2-脱氧葡萄糖掺入率是反应胰岛素敏感性的指标,反应胰岛素刺激的葡萄糖摄取能力,本研究结果显示,中高剂量PI组14C-2-脱氧葡萄糖掺入率降低,PI可降低体外培养的大鼠原代肝细胞对胰岛素的敏感性,从而引起胰岛素抵抗,并且与浓度相关。
IDE是含巯基的金属蛋白水解酶,是细胞内催化胰岛素降解的最主要的酶,可特异性催化细胞内的胰岛素或者胰岛素-受体复合物的降解作用。该酶只特异性的代谢真胰岛素,而对胰岛素原无代谢作用,故其活性在细胞水平上影响胰岛素降解速度。细胞水平的胰岛素降解过快可能是胰岛素抵抗的主要原因,而胰岛素抵抗是糖耐量异常和T2DM的重要发病机制。还有研究也证实T2DM和非DM一级亲属中IDE活性增高,家系成员的红细胞IDE活性增高与代谢相关,并与胰岛素敏感性相关[6]。本研究观察到IDE活性增强并引起PI 增高,与胰岛素敏感性负相关,促进细胞IR。IDE基因表达增强引起PI升高,促进DM的发生。而IDE活性增高,说明PI促进胰岛素快速降解,与相关报道一致[5,6]。

