传染性造血器官坏死病毒RT-RAA快速检测方法的建立
吕晓楠 徐立蒲 张 文 王小亮 曹 欢 王静波 王 姝
(北京市水产技术推广站 北京 100176)
1 前言
传染性造血器官坏死病(Infectious Hematopoietic Necrosis,IHN)是由传染性造血器官坏死病毒(Infectious Hematopoietic Necrosis Virus,IHNV)感染引起,严重危害虹鳟(含金鳟)等鲑科鱼类的一种急性冷水鱼病毒性传染病,分布广泛、发病率高,对我国鲑鳟鱼养殖业造成了巨大危害[1-4]。世界动物卫生组织(OIE)将IHN 列为必须申报的动物疫病。近年来,随着水生动物及其产品的进出口贸易,IHNV也随之在世界范围内扩散,造成该病的感染率急剧增加,因此,IHN 的检测和防治显得愈发重要[5,6]。
该病的病原为IHNV,属弹状病毒科Rhabdoviridae,基因组为不分节段的单股负链RNA。目前检测IHNV 的方法主要有细胞分离培养、ELISA 和RT-PCR 方法等,均需借助专业设备完成检测,缺少能够现场检测IHNV 的快速检测技术[7-9]。本文通过一系列的引物设计筛选、体系建立以及试验验证等工作,建立了针对IHN 的逆转录重组酶介导扩增(Reverse Transcription Recombinase -Aid Amplifica -tion,RT-RAA)检测技术,实现快速、灵敏的检测IHNV。在养殖场发生疑似IHNV 感染时,可及时进行方便、快速的检测,为IHN 的控制提供一种有效的工具。
2 材料与方法
2.1 样品来源
健康和患病的鱼样品均由北京市水产技术推广站水生动物疾病检测技术中心收集及保藏。35 份IHNV 的检测样品均来自北京、新疆、贵州、云南、陕西、甘肃等虹鳟(含金鳟)养殖场。传染性鲑鱼贫血病毒(Infectious Samon Anaemia Virus,ISAV)、传染性胰脏坏死病毒(Infectious Pancreatic Necrosis Virus,IPNV)和病毒性出血性败血症病毒(Viral Hemorrhagic Septicemia Virus,VHSV)样品均由本实验室保藏。
2.2 主要试剂与仪器
PCR 仪(Veriti 96 well Thermal cycler,Applied Biosystems);荧光 PCR 仪(7500 real timePCR system,Applied Biosystems);电泳仪(DYY-6C,北京六一仪器厂);凝胶成像仪(ChampGel5000,北京赛智创业科技有限公司)。
RNeasy Mini Kit 试剂盒(QIAGEN,德国);RTRAA 恒温荧光检测试剂盒(杭州众测生物技术有限公司);2×Power Taq PCR MasterMix(北京百泰克生物技术有限公司);引物和探针(上海生工)。
2.3 方法
2.3.1 RT-RAA 引物的设计
以NCBI 数据库中IHNV G 基因序列为靶位点,依据RT-RAA 引物设计原则,采用DNAMAN 6.0 软件进行序列比对分析,选取同源性高的片段,用primer primer 5.0 进行引物设计,详见表1。

表1 IHNV 引物和探针序列
2.3.2 重组质粒的构建与定量
由北京华大基因合成IHNV G 基因序列(1527bp),并克隆至pUC57 载体上,构建成标准质粒pUC57-IHNV,标准质粒浓度约为269.4ng/μL,推算出pUC57-IHNV 质粒拷贝数大约是 6.39×1010copies/μL。
2.3.3 RNA 的提取
样品取鱼肝、脑、脾、肾组织,匀浆后加含M199 细胞培养液(含10%的胎牛血清、1000IU/mL 的青霉素和1000IU/mL 的链霉素),4℃下 6 000 r/min 离心 20 min,收集上清液用于RNA 的提取。
2.3.4 实时荧光逆转录重组酶介导核酸扩增反应条件
RT-RAA 反应体系配方表详见表2。
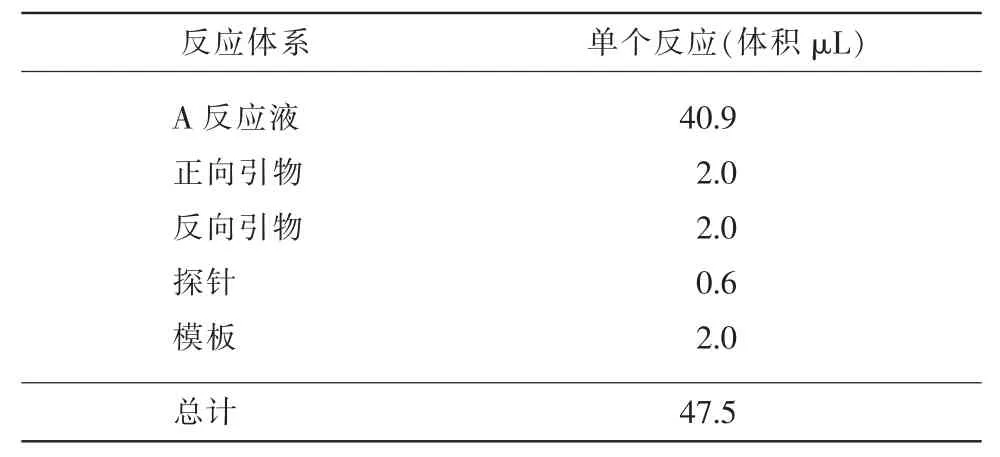
表2 RT-RAA 反应体系配方表
按照表2配置反应体系,混合均匀,加入到RTRAA 荧光反应单元干粉管中,使干粉重悬均匀,瞬时离心。再向每个反应管中加入2.5 μL B Buffer 反应液(内含MgAc)。将上述反应溶液放到荧光PCR仪中,37℃反应20 min。阴、阳性对照按照同样方法进行操作。
2.3.5 灵敏度实验
为了比较本文建立的RT-RAA 检测方法与国际OIE 提供的参考方法RT-PCR 的检测灵敏度,将标准质粒pUC57-IHNV 进行10 倍系列稀释,浓度分 别为 105copies/μL、104copies/μL、103copies/μL、102copies/μL、101copies/μL。每个稀释度取 2 μL 作为模板分别加入到RT-RAA 和RT-PCR 反应体系中,分别参照对应的方法进行扩增、比较。
2.3.6 特异性验证
利用本实验室确定的IHNV 阳性样品和3 份IHNV 为阴性的其他鲑鳟RNA 病原阳性样品(包括ISAV、IPNV 和 VHSV)作为 RT-RAA 检测模板,分别加入到RT-RAA 反应体系中,以测试本研究建立的IHNV RT-RAA 检测方法的特异性。
2.3.7 与其他检测方法检测符合性的比较
用本文所建立的RT-RAA 检测方法与GB/T 15805.2—2017《传染性造血器官坏死病诊断规程》[10]中RT-PCR 方法对35 个虹鳟(含金鳟)养殖场样品进行检测。采用OIE《水生动物诊断试验手册》推荐的诊断敏感性和诊断特异性计算方法,对2 种方法的检测结果进行比较。
3 结果
3.1 RT-RAA引物的设计和筛选
经过NCBI 数据库中多条IHNV-G 基因序列的比对,选取同源性较高的片段,共设计3 对引物和1条探针(具体信息表1)。以IHNV 质粒pUC57-IHNV为模板,分别对这些引物进行测试,选取扩增信号强,扩增时间短的引物组合(IHNV-1-F/IHNV-1-R),作为最终选择的引物,进行后续的实验。
3.2 RT-RAA检测IHNV的灵敏度
将梯度稀释的 105~101copies/μL 的 IHNV 阳性质粒为模板,加入到检测管中对其进行检测,从荧光结果(图1)可以看出,100 copies/μL 的阳性质粒有明显的荧光值,表明IHNV 的RT-RAA 恒温荧光快速检测方法灵敏度为100 copies/μL。RT-PCR 方法检测结果显示(图2),其最低能检测到质粒浓度为100 copies/μL。综上建立的IHNV RT-RAA 检测方法和国际OIE 提供的参考方法IHNV G 基因的RT-PCR 方法灵敏度相当,且RT-RAA 检测时间为20 min,而RT-PCR 检测时间(包含核酸电泳)至少需要210 min。
3.3 RT-RAA检测IHNV的特异性
利用本文研发的IHNV 的RT-RAA 恒温荧光快速检测方法对1 份IHNV 阳性样品和3 份IHNV为阴性的其他鲑鳟病原阳性样品,包括ISAV、IPNV和VHSV 进行检测,从荧光结果(图3)可以看出,除IHNV 阳性样品有荧光值以外,阴性对照和其他鲑鳟样品均未检测到荧光信号。结果表明,IHNV 的RT-RAA 恒温荧光快速检测方法对含有其他鲑鳟病原核酸的样品RNA 无交叉反应,该技术具有良好的特异性。
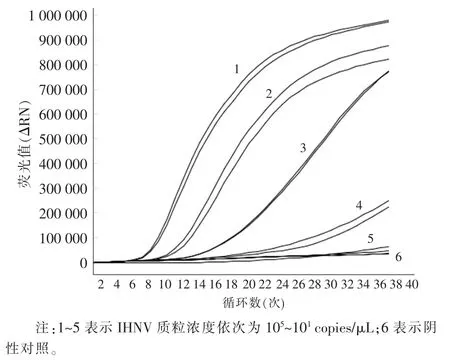
图1 RT-RAA 检测方法的最低检测限
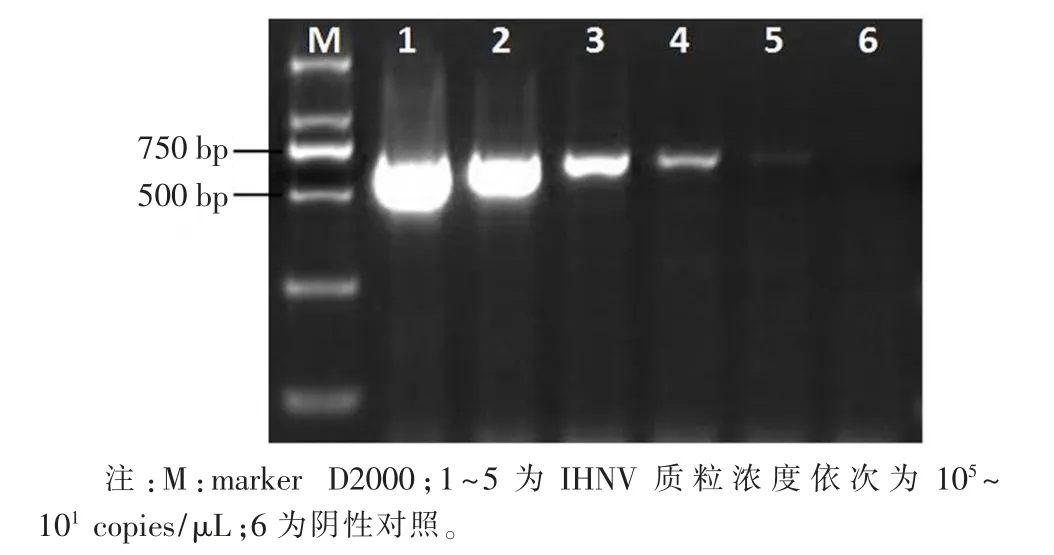
图2 RT-PCR 检测方法的最低检测限

图3 RT-RAA 特异性分析
3.4 RT-RAA方法和RT-PCR方法符合性的比较
利用本文建立的IHNV RT-RAA 方法和国际OIE 推荐的参考方法RT-PCR 对来自全国6 个省市的35 份虹鳟(含金鳟)养殖场的样品进行检测,部分样本的检测结果详见图4和图5。采用RT-PCR 方法的阳性检出率为(25/35),采用本文建立的RTRAA 方法的阳性检出率为(23/35)。根据 OIE《水生动物诊断实验手册》 推荐的诊断敏感性和诊断特异性计算方法,本文建立的RT-RAA 方法对IHNV 检测结果在诊断特异性上的符合率为100%,在诊断敏感性上的符合率为92%。说明RT-RAA 方法基本可以用来检测IHNV,且检测准确快速,20 min 内即可完成检测。

图4 RT-RAA 方法检测实际样本

图5 RT-PCR 方法检测实际样本
4 讨论
自1985年以来,我国已相继在多地发现并报道IHN 疫情,该病给鲑鳟鱼的养殖业造成了巨大的经济损失[11-14]。2008年,农业农村部《一、二、三类动物疫病病种名录》将其列为二类动物疫病,随后该病还列入国家动物疫病监测计划。由于该病尚无有效的治疗方法,在病原的早期快速检测对疾病的控制至关重要。
目前OIE 推荐的诸多诊断方法中,病毒分离、中和试验等传统病毒检测方法费时费力;ELISA 等免疫学检测方法,具有快速高通量的优点,但前期需准备特异性抗体,费时费力,并且操作步骤烦琐,存在一定漏检情况。国内由于受到抗体来源的限制,免疫学技术方面的研究比较缺乏;目前RT-PCR 是较为常见检测IHNV 的分子生物学方法,但检测时间长、对仪器设备温度精准度和人员操作技术要求极高、设备投入大且容易造成气溶胶污染。因此上述方法均不适用于IHNV 的现场快速检测。
逆转录重组酶介导扩增检测技术(RT-RAA)是通过设计RT-RAA 引物,采用源于真菌或细菌的重组酶,并结合RNA 逆转录酶以及DNA 聚合酶,替代了PCR 高温变形循环过程,从而实现了在37℃~39℃常温条件下,快速、灵敏检测目的基因片段。RTRAA 方法灵敏度高、特异性好、可将RNA 直接作为模板,无需额外逆转录过程、操作流程简便、检测周期短、不需要高温循环,没有升降温处理、不需要昂贵PCR 仪器(仅需携带手持便携恒温装置),结合荧光探针能够实现实时检测以及现场快速检测[15-20]。
本文以IHNV 高度保守G 基因为模版,设计特异性RT-RAA 引物和探针,建立了IHNV 的逆转录重组酶介导扩增检测技术。结合RNA 提取法,不需要单独逆转录RNA 以及凝胶电泳等其他辅助,操作简单无需专业人员操作,仅需将样本放入37℃恒温反应20 min,即可通过荧光曲线来判断样品是否感染了IHNV。本方法可最低检测到100 个病毒拷贝,灵敏度与RT-PCR 方法相当,且检测时间缩短为RT-PCR 的1/10。本方法还具有良好的特异性,仅与IHNV 特异性的发生反应,而与IPNV 等3 种鲑鳟鱼病病原RNA 均不发生交叉反应。
采用本方法和RT-PCR 方法同时对35 份虹鳟(含金鳟)样品进行检测2 种方法的检测结果符合率为96%,在诊断特异性上的符合率为100%,在诊断敏感性上的符合率为92%。本文建立的RT-RAA 检测方法可高效、准确、快捷地从虹鳟(含金鳟)样品中检测到IHNV 阳性。值得注意的是,用RT-RAA 方法检测实际样本时,有2 份阳性样品扩增信号偏弱,这对结果判定造成干扰,提示在后续研究中需要进一步优化实验体系提高检测灵敏度。
综上所述,本文建立的IHNV 实时荧光RTRAA 核酸检测方法操作简单、特异性好、灵敏度高,反应只需要20 min,大大缩短了反应时间,摆脱了复杂仪器的束缚,完全满足基层、小型实验室或现场检测的需求,为IHNV 快速检测提供了一种新的技术与方法。该技术具有广泛的应用场景,将为IHNV 控制措施提供检测技术支撑。
——一道江苏高考题的奥秘解读和拓展

