多梳基因蛋白EZH2促进喉鳞状细胞癌血管生成的机制及临床评价
苏 娟 吉晓滨 李 鹏 李 雯 谢景华
1 广州市第一人民医院耳鼻咽喉头颈外科(广州 510180) 2 广州市第一人民医院病理科(广州 510180)
喉鳞状细胞癌(1 aryngal squamous cell carcinoma,LSCC)是头颈部肿瘤比较常见的一种恶性肿瘤,LSCC的发病率、死亡率一直逐年增加,严重影响人类的生存质量。癌有血管依赖性,癌组织中丰富的新生血管为肿瘤的生长提供充足的营养成分、氧气及癌细胞转移途径[1]。肿瘤微血管密度(microvessel density,MVD)是目前公认的评估肿瘤血管生成形态学的金标准[2]。血小板-内皮细胞黏附分子31(platelet endothelial cell adhesion molecule-31,CD31)是广泛应用的新生血管生成标记物,其标记的微血管密度(CD31-MVD)可用于评估肿瘤血管新生,与肿瘤形成、发展、预后密切相关[3]。
果蝇zeste基因增强子同源物2(enhancer of zeste homolog 2,EZH2)属于多梳基因蛋白,可促进肿瘤血管生成,在多种肿瘤细胞中呈高表达[4- 6],是目前肿瘤生物治疗研究的新热点。但迄今关于EZH2在LSCC中表达的研究并不多见,EZH2、CD31与LSCC临床及预后的关系研究也很少,我们对此作了测定和探讨。
1 资料与方法
1.1 临床资料
选择2012年1月—2013年8月就诊于广州市第一人民医院耳鼻咽喉头颈外科,并住院行部分喉或全喉切除术的61例LSCC患者的石蜡组织标本。临床资料齐全,病理明确为LSCC,分化程度明确。术前均未经化疗、放疗或其他治疗。其中男56例,女5例,年龄35~79(60.9±10.8)岁。所有患者均接受术后常规随访,主要通过电话、门诊复查等形式,随访时间≥5年,自确诊之日开始,最晚至2018年10月结束。同期正常对照组20例,其中男18例,女3例,年龄在39~75(58.1±8.9)岁。标本来源于接受全喉手术的患者,标本距肿瘤边缘≥2 cm,病理证实无癌组织。标本由两位病理医生双盲法复查。
1.2 试剂
CD31单克隆抗体、通用型SP免疫组化检测试剂盒、DAB显色试剂盒购自美国SantaCruz生物工程有限公司;兔抗人EZH2单克隆抗体购自美国Cell Signaling 公司,二抗购自福州迈新生物技术开发有限公司。
1.3 实验方法
标本常规石蜡包埋切片,厚度约4 μm。脱蜡、水化后以3%H2O2室温孵育10min,消除内源性过氧化物酶活性,热修复抗原5min。滴加一抗(EZH2为1:50;CD31为1:100)4 ℃孵育过夜。次日加入二抗37 ℃孵育2 h,DAB室温下显色。苏木精复染、脱水、透明、中性树胶封片。用试剂公司提供的大肠癌组织切片作CD31染色的阳性对照,EZH2以已知阳性乳腺癌组织切片做阳性对照。以PBS缓冲液代替一抗做阴性对照。
1.4 结果判定
CD31-MVD计数:凡被抗体染成棕黄色的内皮细胞、细胞簇作为1个微血管计数,按Weidner[7]法进行,随机计数5个高倍镜下微血管数,取平均值作为MVD值。EZH2阳性呈棕黄色染色,主要位于细胞核/胞浆。根据染色强度和细胞数目进行分级。随机选取5个高倍镜(×400)下视野取平均值。染色强度:无着色、淡黄色、黄或深黄色、褐或棕褐色分别评为0、1、2、3分;细胞数目:无阳性细胞、阳性细胞<25%、26%~50%、51%~75%、>75%分别评为:0、1、2、3、4分。两评分相加:0分为(-);1~2分为(+);3~4 分为(++);5~6分为(+++),≥3分则为强阳性表达。
1.5 统计学方法
采用SPSS 21.0统计软件。计数资料采用χ2检验、Fisher精确检验。计量资料采用t检验、秩和检验,多组间比较用单因素方差分析。相关性检验采用Spearman秩相关分析。Kaplan-Meier生存分析、Log-rank检验和Cox比例风险分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 CD31的表达
2.1.1 CD31在LSCC和NLT中的表达对比 CD31的阳性表达为棕黄色颗粒,主要集中在肿瘤组织边缘区的血管内皮细胞,微血管或呈条索状、或具有管腔,形态不规则,分布不均。而在NLT中微血管形态规则,分布少、较均匀(图1)。61例LSCC中CD31-MVD值(/0.5 mm2)为10.26±2.46,20例NLT中为1.20±1.10,差异有统计学意义(t=-15.85,P<0.05)。
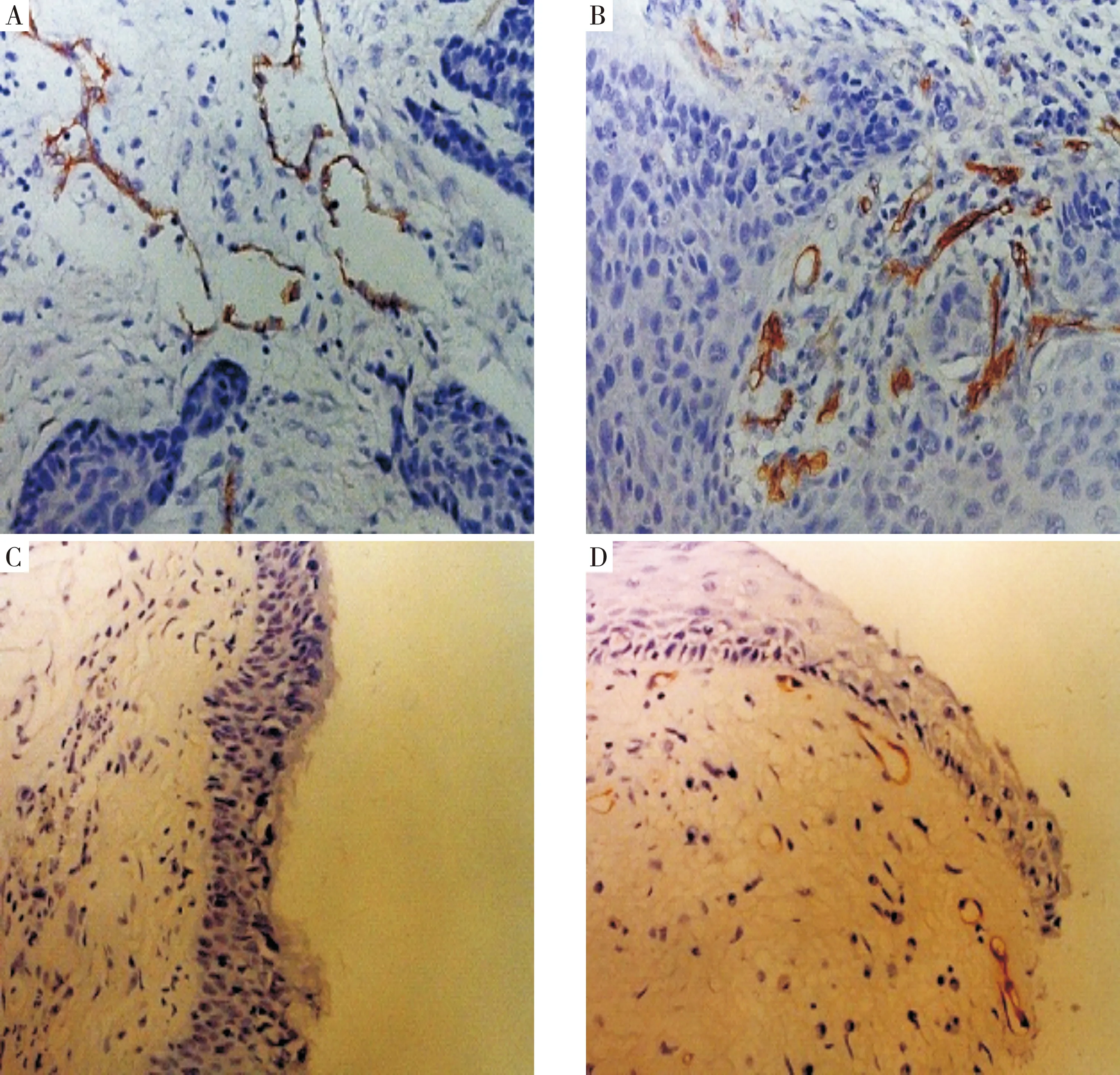
A CD31在T3期LSCC中的阳性表达;B CD31在T4期LSCC中的阳性表达;C CD31在NLT中的阴性表达;D CD31在NLT中的弱阳性表达图1 CD31在LSCC和NLT中的表达(SP×400)
2.1.2 CD31-MVD与LSCC临床病理参数的关系 CD31-MVD与LSCC淋巴结转移、T分级和临床分期有关(P均<0.05,见表1)。
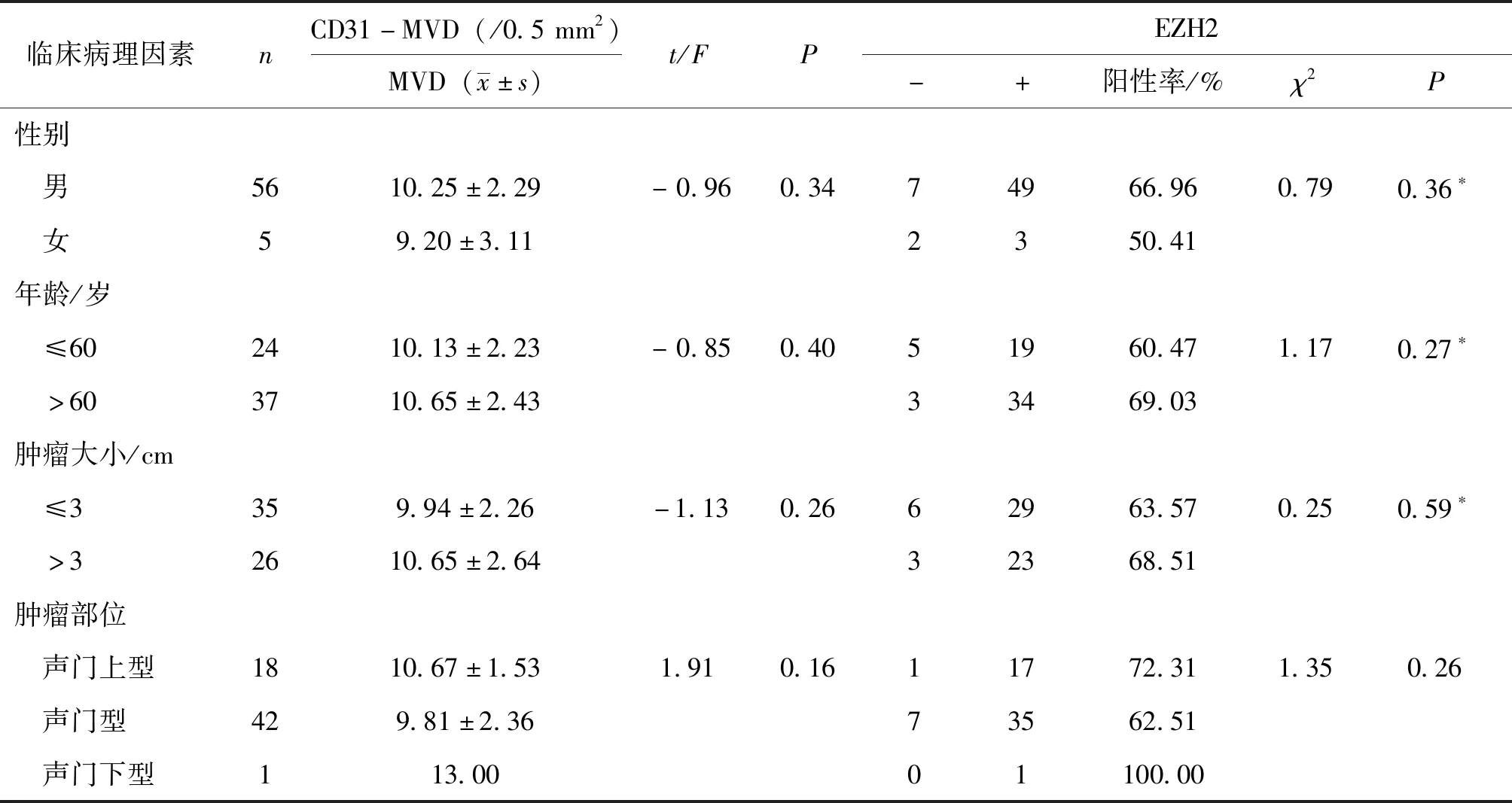
表1 LSCC中CD31-MVD、EZH2表达与临床病理参数的关系
*为连续性校正检验结果
续表
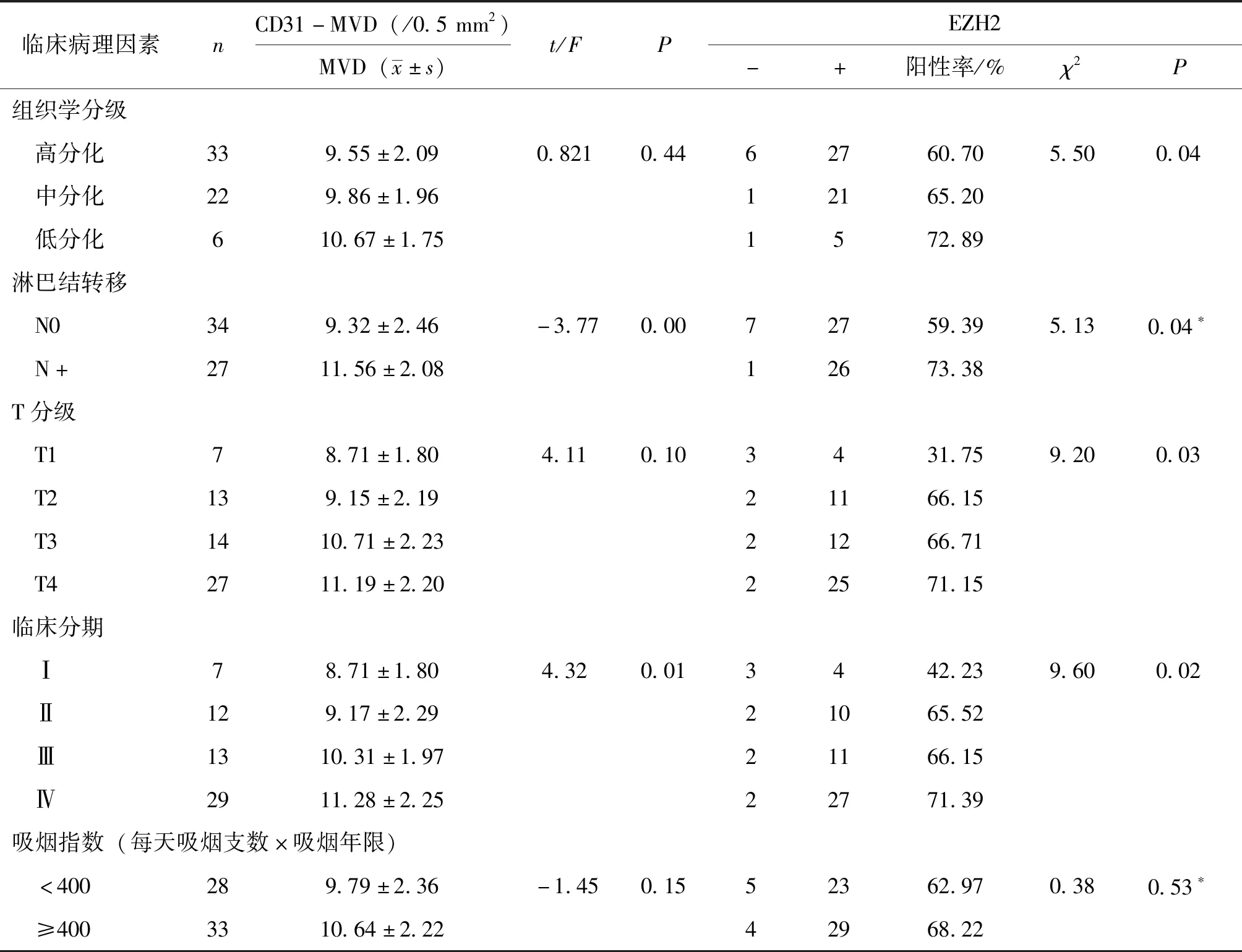
临床病理因素nCD31-MVD(/0.5mm2)MVD(x±s)t/FPEZH2-+阳性率/%χ2P组织学分级 高分化339.55±2.090.8210.4462760.705.500.04 中分化229.86±1.9612165.20 低分化610.67±1.751572.89淋巴结转移 N0349.32±2.46-3.770.0072759.395.130.04∗ N+2711.56±2.0812673.38T分级 T178.71±1.804.110.103431.759.200.03 T2139.15±2.1921166.15 T31410.71±2.2321266.71 T42711.19±2.2022571.15临床分期 Ⅰ78.71±1.804.320.013442.239.600.02 Ⅱ129.17±2.2921065.52 Ⅲ1310.31±1.9721166.15 Ⅳ2911.28±2.2522771.39吸烟指数(每天吸烟支数×吸烟年限) <400289.79±2.36-1.450.1552362.970.380.53∗ ≥4003310.64±2.2242968.22
*为连续性校正检验结果
2.1.3 CD31-MVD对LSCC的术后预后评估 27例术后5年复发患者组的CD31-MVD(/0.5 mm2)为10.19±2.11,高于34例术后5年未复发患者组(8.71±1.43,t=3.26,P<0.05)。
2.2 EZH2的表达
2.2.1 EZH2在LSCC和NLT中的表达对比 EZH2蛋白定位于细胞核,阳性染色深浅不一,表现为棕黄色或棕褐色颗粒状,可呈灶状或弥漫分布。LSCC中的染色深,以强阳性为主,NLT中阳性着色浅,以弱阳性为主(图2)。EZH2蛋白表达的阳性率在LSCC为65.57%(40/61),大于NLT 30.0%(6/20),差异有统计学意义(χ2=23.92,P<0.05)。

A EZH2在LSCC中呈中度阳性表达;B EZH2在LSCC中呈强阳性表达;C EZH2在NLT中呈阴性表达;D EZH2在NLT中呈弱阳性表达图2 EZH2在LSCC和NLT中的表达(SP×400)
2.2.2 EZH2与LSCC临床病理参数的关系 EZH2阳性表达与组织学分级、T分级、临床分期及淋巴结转移有关(P<0.05,表1)。
2.2.3 EZH2对LSCC的术后预后评估 27例术后5年复发患者组的EZH2阳性率为74.07%(20/27),高于34例术后5年未复发患者组的EZH2的阳性率(52.94%,18/34,χ2=3.89,P<0.05)。
2.3 CD31-MVD与EZH2的相关性分析
LSCC中EZH2表达阳性者的MVD值(/0.5 mm2)为10.62±2.03、阴性者为7.37±2.55,两者比较差异有统计学意义(t=6.53,P<0.05)。CD31-MVD和EZH2呈正相关(r=0.67,P<0.05,图3)。
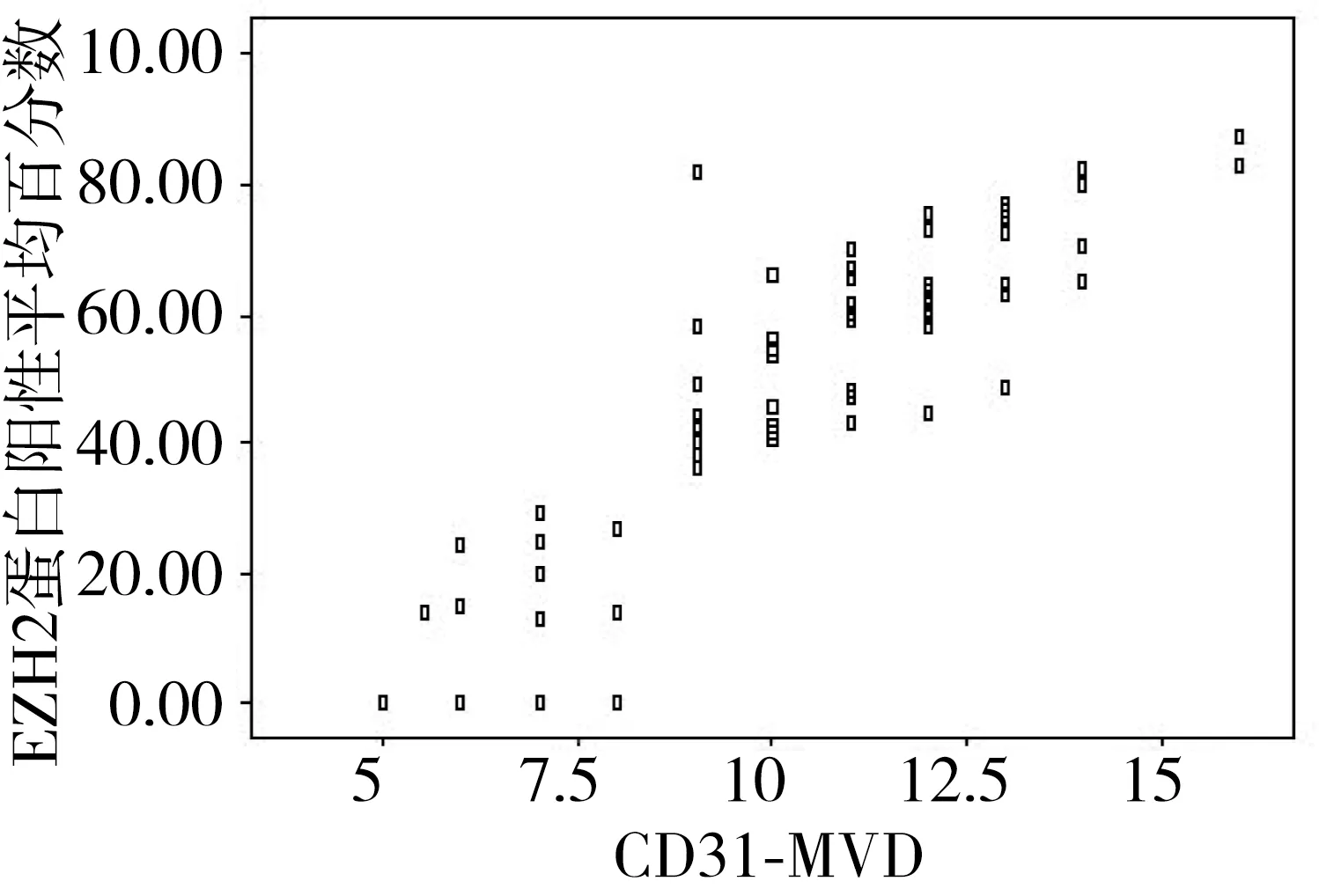
图3 EZH2与CD31-MVD相关性分析
2.4 CD31-MVD、EZH2与生存的关系
2.4.1 生存情况 61例LSCC失访3例,随访率95.08%。3年生存率83.71%,5年生存率70.49%。
2.4.2 生存分析显示,CD31-MVD逐渐增大,则LSCC总生存率随之下降。在CD31-MVD各组之间差异有统计学意义(F=5.03,P<0.05)。61例LSCC患者中,18例≤5年生存组中CD31-MVD值(/0.5 mm2)为10.91±2.13,43例>5年生存组为8.76±2.52,表达差异有统计学意义(t=4.36,P<0.05)。
2.4.3 生存分析显示,EZH2染色级别增高,则LSCC总生存率随之下降,在EZH2表达(-)-(+++)之间差异有统计学意义(χ2=4.69,P<0.05)。61例LSCC患者中,18例≤5年生存组中与43例>5年生存组相比较,EZH2表达差异有统计学意义(χ2=4.60,P<0.05)。
2.5 LSCC预后的单因素分析
组织学分级、有无淋巴结转移、临床分期、吸烟指数、有无复发对预后的影响有统计学意义(P均<0.05,表2)。
2.6 多因素Cox比例风险分析
以随访5年生存状态为结局变量,1=死亡,0=截尾(生存或失访),以表2中有统计意义的因素加上CD31-MVD、EZH2建立回归模型。在Cox Regression中,CD31-MVD、EZH2、淋巴结转移、临床分期、有无复发是预后独立影响因素(见表3)。
2.7 生存模型和预后指数
根据表3结果,建立LSCC患者的生存模型如下:h(t,x)=h0(t)exp(1.302 X1+1.531 X2+1.509 X3+2.891 X4+2.678 X5),预后指数PI=1.302 X1+1.531 X2+1.509 X3+2.891 X4+2.678 X5(X1:EZH2;X2:CD31-MVD;X3:是否复发;X4:临床分期;X5:有无淋巴结转移)。说明:PI值大,则生存的可能性低、预后差;PI值小则相反。

表2 LSCC患者预后影响因素的单因素分析结果 [例(%)]
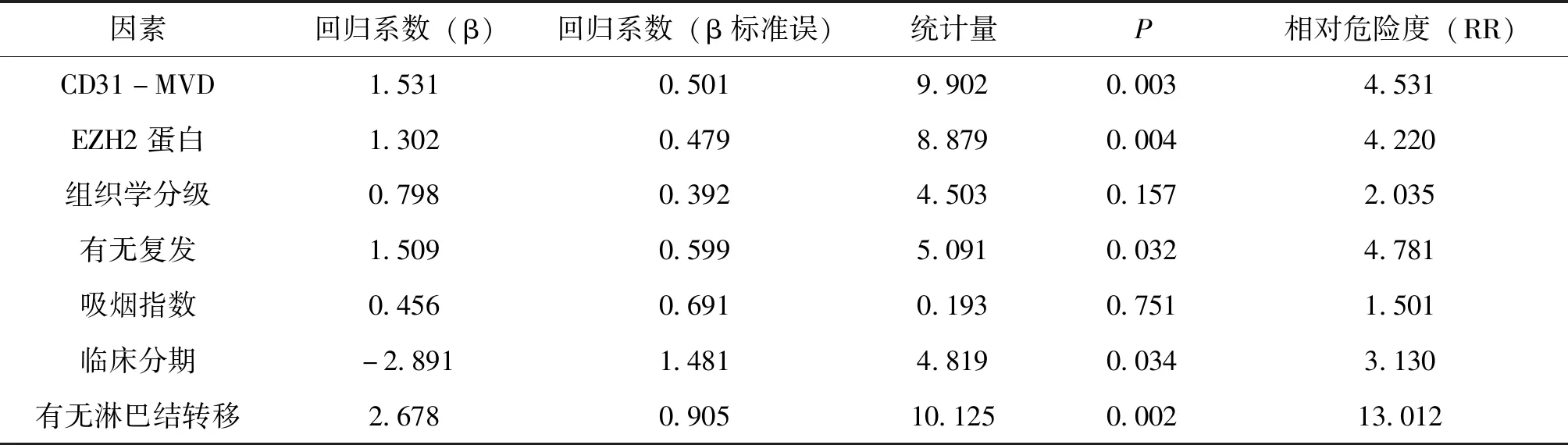
表3 LSCC患者的Cox比例风险模型多因素分析结果
3 讨 论
喉鳞状细胞癌作为一种常见的头颈部肿瘤,其病因一直不明确,目前大多数学者认为,恶性肿瘤血管生成促进其增殖、浸润、转移和复发。MVD是反映血管生成的重要指标,对衡量肿瘤血管生成及预后具有重要意义[8]。CD31是免疫球蛋白超家族成员,作为血管内皮细胞标记物,CD31在成熟与未成熟的肿瘤血管中均有表达,并调节肿瘤血管生成。目前临床上广泛应用CD31对血管内皮细胞进行标记,可精确地反映MVD[9]。我们的研究表明:①CD31-MVD值在LSCC组织中的表达(10.26±2.46)明显高于NLT(1.20±1.10)。CD31在LSCC中表达明显,主要集中于肿瘤组织边缘区的血管内皮细胞,而在NLT中表达较弱,说明CD31可提示恶性肿瘤中新生微血管的旺盛程度;②CD31-MVD值与LSCC的T分级、临床分期、淋巴结转移、是否复发有关;③生存分析显示CD31可用于预后的判断,CD31-MVD值越大,则生存期越短。
血管生成基因对于研究肿瘤血管生成机制、探寻生物治疗靶点意义非常。EZH2是近年来新发现的一种血管生成基因,是多梳基因家族(polycomb group genes, PcGs)的核心成员。肿瘤血管生成机制主要在于血管生成促进因子(如血管内皮生成因子、纤维母细胞生长因子)和血管生成抑制因子(如血管抑素、内皮抑素)之间的相互调节,血管内皮细胞为调节因子作用的靶细胞,血管生成促进因子浓度升高或抑制因子浓度下降都可促进肿瘤血管生成,造成肿瘤侵袭及转移[10]。而 EZH2主要通过 VEGF-E2、F-EZH2-VASH1[11]和 FGF-2-NDY1/EZH2-miR-101-EZH2[12]机制参与了这一调节过程。
许多研究证实,相对于正常组织,EZH2高表达于多种癌组织,如前列腺癌[13]、乳腺癌[14]、膀胱移行细胞癌[15]、胃癌[16]、肺癌[17]、口腔癌[18]、白血病[19]等,且在它们的病程发生发展、预后中起重要作用。然而,EZH2在LSCC发生发展过程中的生物学作用研究在国内外还极为少见。本研究中LSCC组EZH2呈高表达,与组织学分级、T分级、临床分期及淋巴结转移相关。相关性分析显示LSCC中EZH2阳性组CD31-MVD值明显高于阴性组、CD31-MVD计数与EZH2呈正相关,表明EZH2与LSCC血管生成有关。生存分析显示LSCC中EZH2蛋白高表达预示着患者生存期短、预后较差。
全组61例LSCC总3年生存率83.71%,5年生存率70.49%。生存分析显示,CD31-MVD值增加,LSCC总生存率则随之下降,CD31-MVD计数各组之间差异有统计学意义,表明CD31-MVD高,预示患者生存期短。61例LSCC患者>5年、≤5年两组之间EZH2蛋白表达差异均有统计学意义,EZH2蛋白表达高,则患者生存期短。在Cox多因素分析中,CD31-MVD、EZH2、淋巴结转移、临床分期、有无复发是预后独立影响因素,EZH2、CD31表达高,提示LSCC预后差。
综上所述,EZH2蛋白在LSCC中表达上调,促进LSCC新生血管生成、发展、浸润、转移及不良预后。这与EZH2可促进血管生成的机制及癌组织侵袭转移相一致[20]。进一步研究、开发EZH2分子抑制剂可为LSCC的治疗提供新的分子靶点和理论依据,为LSCC患者带来了新的福音。

