探究脑缺血再灌注对小鼠学习记忆能力及Bax、Bcl-2的表达的影响
张少君 陈小娟 李若兰 李才应 邓梓濠 吴建聪
广州医科大学 (广州510000)
随着城市节奏加快和生活压力加重,缺血性脑血管病发病率逐年上升,有研究表明,脑缺血再灌注损伤可导致脑组织损伤和功能障碍[1],而海马区(学习记忆中枢)对缺血较敏感[2],脑缺血后学习记忆功能会减退或丧失,严重影响身心健康和生活质量。在脑缺血再灌注损伤时,大脑缺血边缘区(半暗区)细胞以凋亡为主要死亡方式,而调控细胞凋亡最主要的基因是Bax,它是Bcl-2基因家族中的一员。大量研究表明,Bax的表达大幅度增加可以促进caspase3激活而抗凋亡[3- 4],但Bcl-2的大量表达可抑制caspase3的激活而起到抗凋亡作用[5];另外,Bax还可以通过编码能与Bcl-2结合成异二聚体的Bax蛋白,从而拮抗Bcl-2的作用。因此,Bax和Bcl-2的表达情况以及Bax/Bcl-2的比率对细胞凋亡有着重要的影响。因此,为了给临床研究降低脑缺血再灌注损伤提供思路,本实验通过建立脑缺血再灌注模型,探讨脑缺血再灌注损伤对学习记忆的影响及海马区Bax、Bcl-2的表达情况。
1 材料与方法
1.1 实验动物
选用健康的4周龄小鼠20只,自由饮食饮水饲养,自然光暗周期。(实验动物由广州中医药大学实验动物实验中心提供,符合相关实验要求)。增强型 DAB 显色试剂盒,由北京索莱宝科技有限公司提供,货号:DA1015;SABC 免疫组化染色试剂盒,由博士德生物工程有限公司提供,产品编号:SA1020;Morris水迷宫全套设备,由广州医科大学附属第二医院神经科学研究所提供。
1.2 动物模型[6]
选用健康的4周龄小鼠20只,随机分为空白组10只;实验组(缺血24 h组)10只;称重,用质量浓度为100 g/L的水合氯醛腹腔注射麻醉, 待小鼠无翻正反射后仰卧固定于手术台上,保持呼吸通畅,用碘伏消毒,经颈部做 0.8~1 cm 正中切口,切开皮肤和皮下组织,钝性分离二腹肌和胸锁乳突肌,暴露颈动脉鞘,小心分离双侧颈总动脉及迷走神经约 0.5~1 cm,并在颈总动脉下穿过零号丝线。提拉丝线,同一时间,用无创伤性微动脉夹夹闭双侧颈总动脉20min, 然后去除动脉夹,逐层缝合肌肉、皮肤,再次消毒。正常饲养3天,待小鼠伤口愈合,进行水迷宫行为学。
1.3 水迷宫行为学
将两组小鼠分别放在Morris水迷宫内寻找平台,人为将水迷宫划分为4个象限,每天下午同一时间将受试小鼠按顺时针方向依次由第一,二,三,四入水点顺序放入水中,记录小鼠在2min内寻找平台的时间,如果小鼠在2min内找到平台,记录2min内的逃避潜伏期,如果2min内未找到平台,由实验者将其引上平台并停留10s,逃避潜伏期记录为2min。训练小鼠历时4天。4天训练逃避潜伏期结束后,次日将水迷宫内的平台移除,让两组小鼠从原来平台所在象限的对侧象限进入水迷宫,用Smart系统测其在5min内跨越原平台位置的次数和小鼠在平台各个象限停留的时间,以判断小鼠记忆储存以及提取再现能力。
1.4 免疫组化
1.4.1 脑片标本制作
将以上跑完水迷宫后的空白组和缺血组小鼠灌注取脑,质量浓度为40 g/L的多聚甲醛固定12 h,依次用质量浓度为100 g/L、200 g/L、300 g/L的蔗糖脱水,制作冰冻切片。
1.4.2 免疫组化检测步骤如下:
选取含海马区的冰冻切片于孔板内,用PBS溶液冲洗;质量浓度为30 g/L的H2O2去离子水室温孵育5~10min, 消除内源性过氧化物酶活性。PBS(AR,30)冲洗5min,冲洗3次;质量浓度为50 g/L的BSA封闭液 37 ℃孵育30min,甩干。滴加一抗,37 ℃孵育1~2 h或4 ℃过夜。PBS冲洗,5min×3次;滴加生物素标记IgG,37 ℃孵育30min。PBS冲洗5min,冲洗3次;滴加 SABC,37 ℃孵育30min;PBS冲洗5min,冲洗3次。DAB染色,复染、脱水、透明、封片。
1.4.3 Bax,Bcl-2检测方法
阳性细胞计数:在200倍光学显微镜下在脑组织海马区切片内随机选取5个视野计数免疫组化染色阳性的细胞数。并分别记录每组切片Bax和Bcl-2染色阳性细胞数量。
1.5 统计学方法
采用SPSS 19.0统计软件,两组间比较采用独立样本t检验,多组之间采用单因素方差分析,P<0.05表示差异有统计学意义。
2 结 果
2.1 水迷宫实验结果
2.1.1 空白组在D3、D4逃避潜伏期最短,D5穿越平台次数最多,目标象限停留时间最长,空白组小鼠的活动区域集中于目标象限;与空白组比较, 实验组D3、D4逃避潜伏期时间延长(P<0.05)、D5穿越平台次数减少 (P<0.05),小鼠的学习记忆能力呈下降趋势。其余没有统计学意义(目标象限停留时间没有差异)。(见表1)
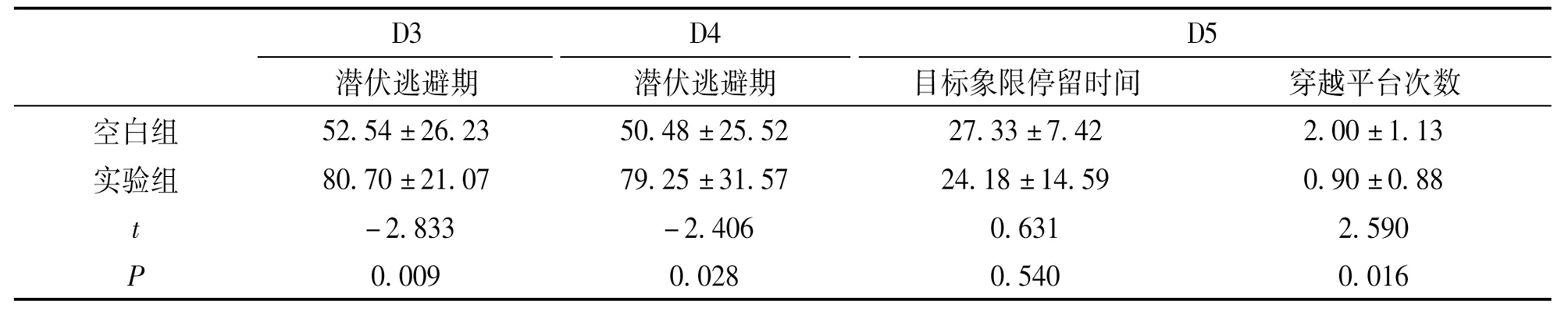
表1 小鼠Morris水迷宫数据(s)
2.1.2 在空间探索阶段,空白组小鼠在目标象限活动路径长于实验组,路径图呈趋向型搜索策略;实验组小鼠在各个象限路径长短没有差异,呈现边缘型搜索策略。(见图1)
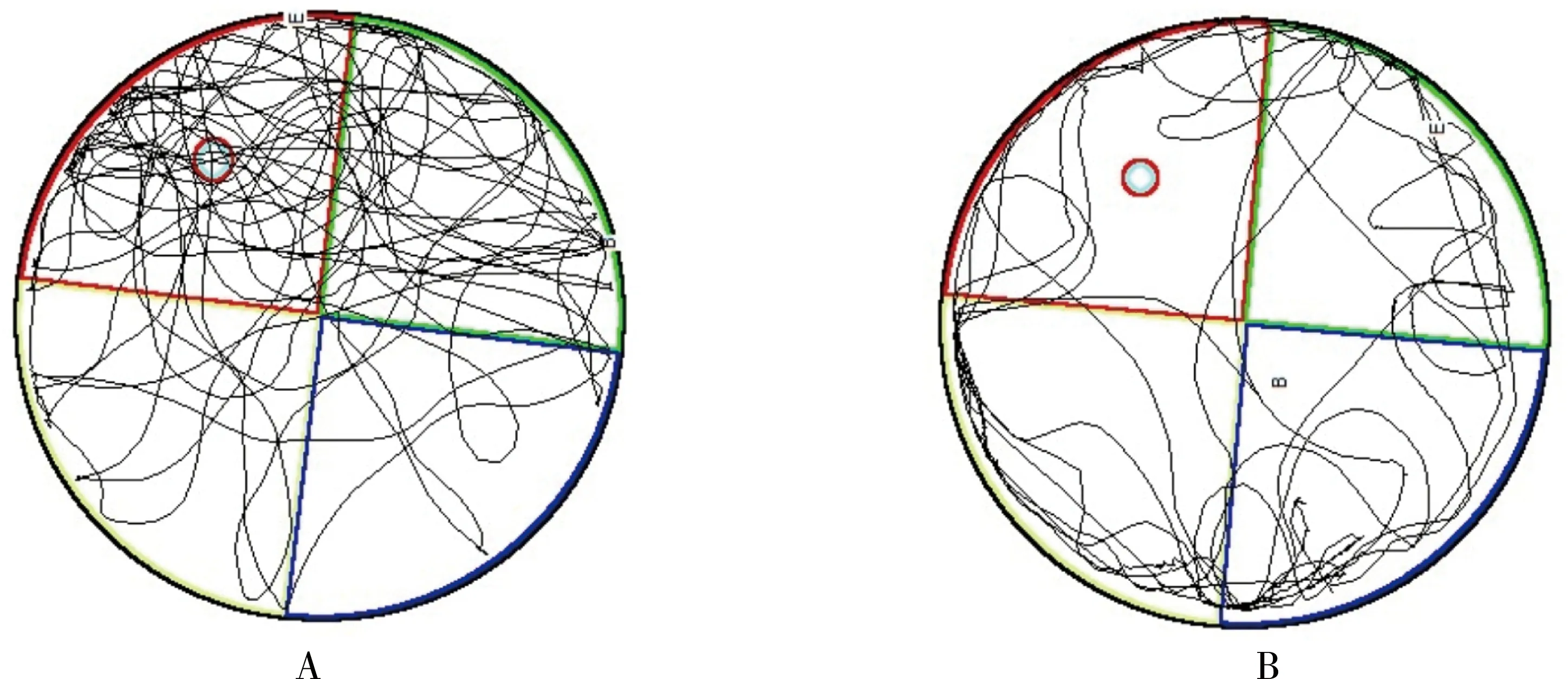
图1 小鼠空间探索阶段路径图
2.2 免疫组织化学结果
2.2.1 Bcl-2表达情况 空白组第9天Bcl-2表达量为2.91±2.09,实验组表达量为26.18±17.52;与空白组相比,实验组的Bcl-2蛋白表达水平均增加(P<0.05)。
2.2.2 Bax表达情况 空白组第9天Bax表达量为3.97±4.09,实验组表达量为63.60±12.77;与空白组比较,实验组的Bax蛋白表达水平增加 (P<0.05)。
空白组Bcl-2/Bax比值为0.92±0.52,实验组Bcl-2/Bax比值为0.44±0.29,说明Bax在9 d内相比Bcl-2表达增幅较大。(见图2、3)
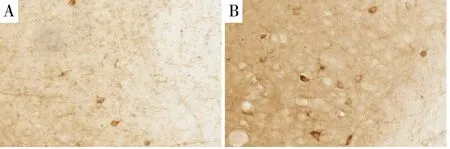
图2 小鼠海马区神经细胞免疫组织化学染色×200(Bcl-2表达情况)A空白组;B实验组
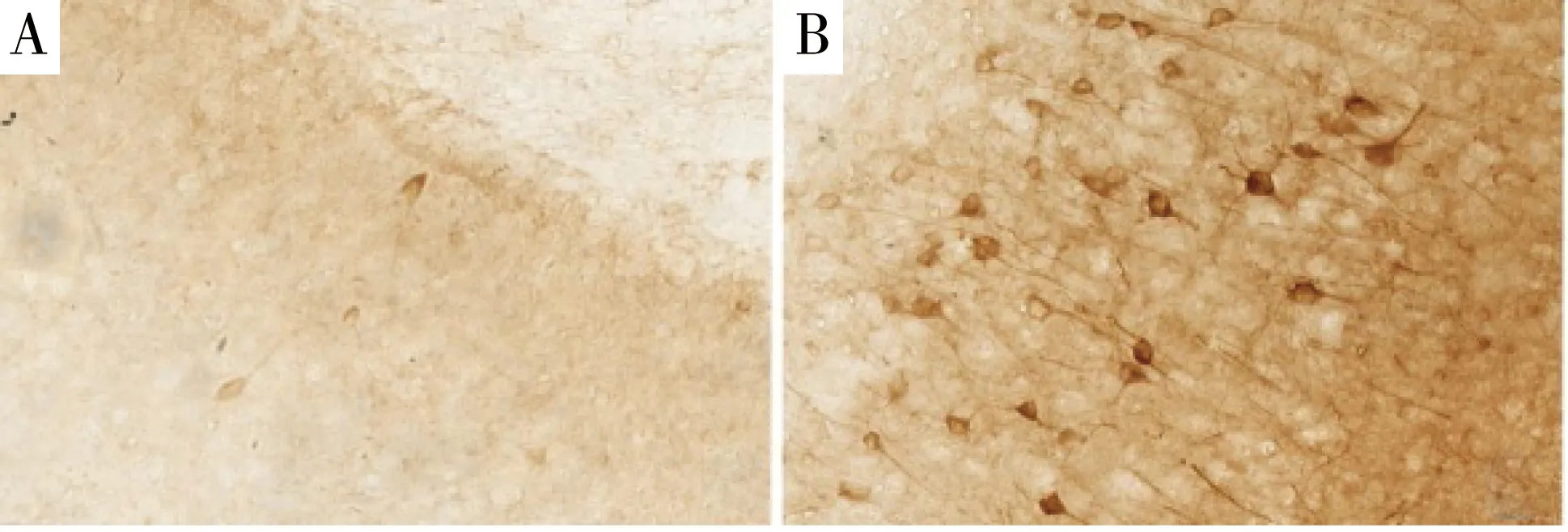
图3 小鼠海马区神经细胞免疫组织化学染色×200(Bax表达情况)A空白组;B实验组
3 讨 论
脑缺血再灌注损伤可导致脑组织损伤和功能障碍,而海马区(学习记忆中枢)对缺血较敏感。而Morris水迷宫是利用小鼠寻找水中的休息场所的本能, 通过定位航行试验和空间探索试验两个部分来测试小鼠对空间位置感和方向感 (空间定位) 的学习记忆能力。并且在固定时间进行,选取同年龄同性别小鼠,实验过程中保持水迷宫之外的一切物品静止,以达到尽量减少外部因素对实验数据的干扰的目的[7],本实验用Morris水迷宫的定位航行试验,对比实验组(缺血再灌注小鼠)与空白组(未做任何处理的正常小鼠)的学习记忆能力。水迷宫实验结果显示,与空白组比较, 实验组小鼠逃避潜伏期时间延长、穿台次数减少(P<0.05),实验组小鼠的学习记忆能力呈下降趋势(P<0.05)。该结果说明缺血再灌注影响了小鼠的学习记忆,缺血再灌注模型制作成功。
有研究表明,细胞凋亡是造成小鼠大脑缺血后海马区神经元丢失的重要原因[8],而且神经元的凋亡会加重再灌注后对海马区的损伤。Bcl-2、Bax基因调控的蛋白在神经细胞凋亡过程中起着非常关键的作用。Bcl-2蛋白对细胞凋亡有一定的抑制作用,而Bax蛋白则对细胞凋亡具有一定的促进作用[9]。另外,近年来大量研究提示,Bcl-2家族调控细胞凋亡的发生发展取决于促进抗凋亡蛋白Bcl-2和抑制凋亡蛋白Bax的相对浓度[10],所以Bcl-2/Bax也可以间接地反映细胞凋亡的情况。
本实验中,未做任何处理的空白组小鼠海马区Bax和Bcl-2均有少量表达,实验组缺血再灌注9天后的小鼠海马区Bax、Bcl-2的表达均大幅度提高,并且Bax上升的幅度较Bcl-2大。相关实验也表明正常情况下Bcl-2、Bax仅有微弱的表达,而模型组Bcl-2、Bax阳性表达增加[11]。根据实验结果分析,实验组Bcl-2/Bax比值较空白组降低,表明Bcl-2/Bax的下调与神经细胞的凋亡亦有密切的关系。他人研究已发现Bcl-2/Bax的比值变化决定细胞的凋亡与生存,比值越高,细胞存活率越高;比值越低,细胞的凋亡率越高[12],本研究结果与其相符。
综上所述,Bax在小鼠缺血再灌注模型中起到促进细胞凋亡的作用,Bcl-2/Bax比值下调也与细胞凋亡有关,对小鼠学习记忆造成影响。

