食管癌和肺癌患者血清TGF-β1、PDGF-B、IL-10预测放射性肺炎的初步临床观察
常晓龙 文景丽 桑茂忠 刘 杰 姜迎霄 郭英华 马瑞忠 郝福荣 王明臣
1 潍坊市人民医院放疗科(潍坊 261041) 2 东营市人民医院肿瘤科(东营 257091)
放射治疗是肺癌和食管癌治疗的主要手段之一。然而,胸部放射治疗可以引起肺部的损伤(radiation induced lung injury RILI)。放射治疗引起的肺损伤包括急性反应:急性放射性肺炎(radiation pneumonitis,RP)以及慢性反应:肺纤维化[1]。RP是胸部肿瘤放疗后最常见的并发症,也是放疗剂量的限制因素之一,因此也限制了肿瘤剂量,降低了肿瘤的局部控制率和患者生活质量。虽然医学影像学技术、放射治疗技术及放疗设备有了较大的提高和改进,但仍有15%的患者在胸部照射后出现放射性肺炎和后续的肺纤维化[2]。研究发现一系列细胞因子参与了RP和肺纤维化的过程。但目前尚缺乏这些细胞因子与放射性肺损伤的临床关系研究。本文旨在通过观察肺癌、食管癌患者放疗前、放疗过程中血清TGF-β1、PDGF-B、IL-10浓度变化,RP发生,分析以它们之间的关系,探寻其对RP的预测价值。
1 资料与方法
1.1 病例选择及一般资料
收集潍坊市人民医院放疗科2014年3月—2014年7月间收治的原发性食管和肺癌患者。所有患者放疗前均完成病史采集、体格检查、肿瘤标志物、生化、三大常规、肺功能测定、胸部CT、腹部彩超或CT、心电图、ECT骨扫描、颅脑MRI检查,明确病情。入组标准:①经病理学确诊为肺癌或食管癌,均适合并同意行原发灶放射治疗;②KPS评分≥70分;③预计生存期>半年;④同意参加实验的患者。排除标准:①已发生远处脏器转移;②胸部二次放疗者;③临床资料不全者;④未按计划完成放疗者;⑤合并放疗禁忌症者。
共入组患者30例,剔除10例,纳入分析20例,中位年龄60岁(50~81岁),其中男18例(90.0%),女2例(10.0%);6例合并高血压病史,2例合并胃溃疡病史,4例外伤骨折病史;肺癌8例(肺腺癌3例,其中术后1例,肺小细胞肺癌4例,肺鳞癌1例),临床分期均为Ⅲ期(AJCC第七版癌症分期),食管癌12例(胸上段食管癌4例,中段食管癌7例,下段食管癌1例,全部为食管鳞癌),病变中位长度5 cm(3.5~12 cm);吸烟者16例(80.0%);放疗前行诱导化疗者肺癌7例,食管癌3例,化疗方案为含铂方案,中位化疗周期1.5(1~8);中位放疗剂量60.0 Gy(40.0~66.0 Gy)。随访截止日期2014年10月1日。
1.2 放疗基本情况
采用3~7野共面三维适形或调强放射治疗,由主任或副主任医师确认放疗计划,100%处方剂量覆盖95%PTV。危及器官限量:脊髓最大剂量≤45 Gy,全肺V20≤35%,全肺V30<20%,平均剂量≤18 Gy,心脏D1/3≤50 Gy,或心脏V45≤67%。根据患者的病情及放射治疗目的确定处方剂量为40~66 Gy,单次剂量1.8~2.0 Gy/天,1次/天,5次/周,共4~6.5周完成,采用VARIAN clinac 23-EX直线加速器治疗。
1.3 RP评价
放射治疗18~23次时、放射治疗结束后1月时,或放疗开始90天内有RP征兆时复查胸部CT,按美国肿瘤放射治疗协作组(Radiation Therapy Oncology Group,RTOG)标准评价RP分级[3]。
1.4 血液细胞因子的测定
分别在放射治疗前、放疗中(放疗5、10、15、20次时)及放疗结束后1月时,应用EDTA防凝管采集清晨空腹血液标本4 mL,4 ℃低温冷藏,于采集标本4 h内离心5min(转速为3 000 r/min)后,取上层血清标本置于-80 ℃低温冰箱中冻存备用。选用TGF-β1、PDGF-B、IL-10 ELISA试剂盒(美国 R&D Systems 公司),按照试剂盒提供的标准操作流程进行标准曲线制定,预实验和正式试验。
1.5 统计方法

2 结 果
2.1 临床概况
20例患者中位随访时间4月(1~5.3月),随访率为100%,其中9例(45.0%)患者发生RP,1级7例(35.0%),2级2例(10.0%),无3级及以上RP发生。各级RP间的V20、V30、MLD有差异,但在年龄(≥60岁与<60岁)、性别、吸烟史、化疗史、放疗总剂量(≥60 Gy与<60 Gy)、病种类型、V5、V10、V40方面均无差异,见表1。
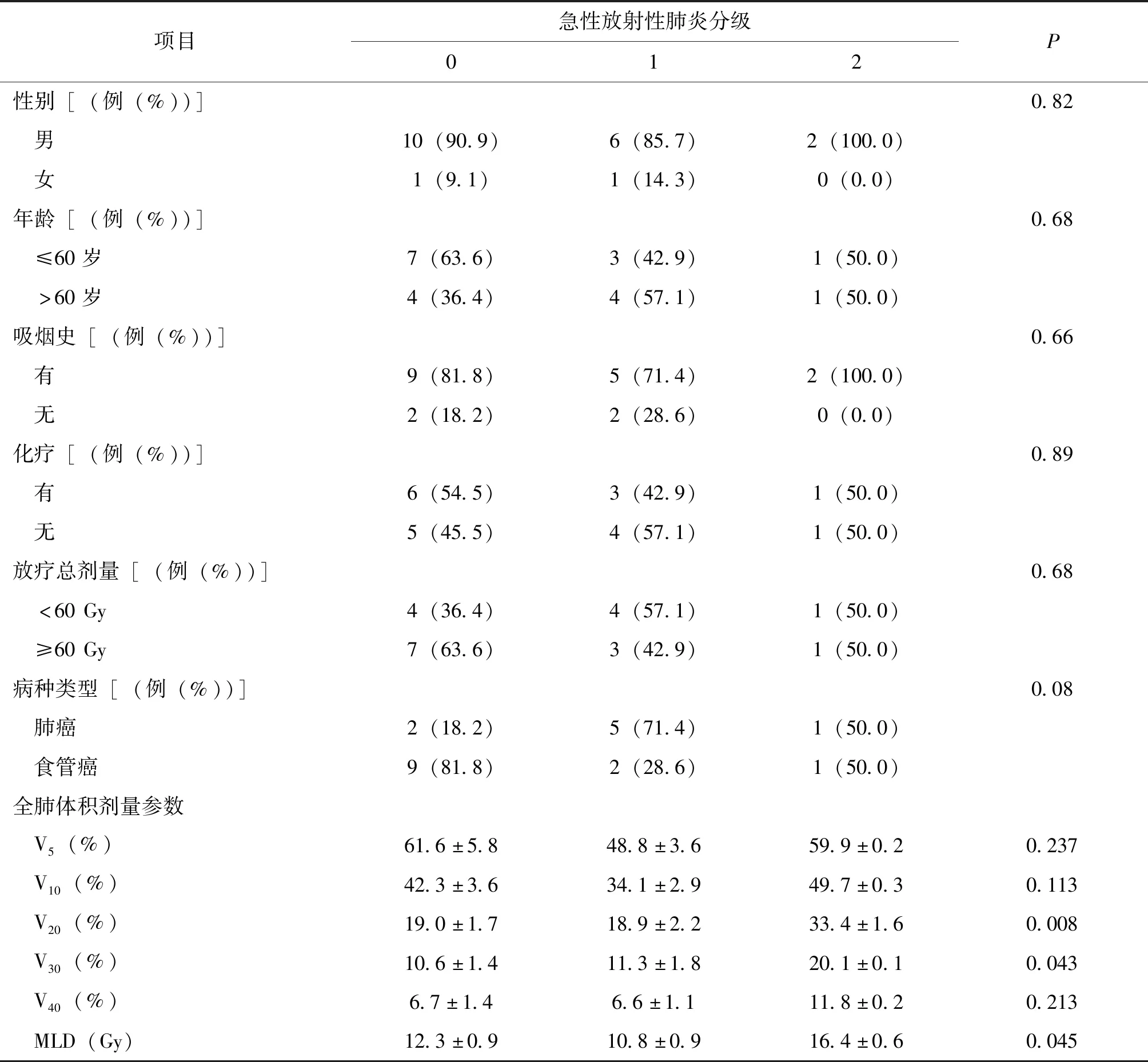
表1 各级急性放射性肺炎的临床特征
MLD:Mean Lung Dose;Vx:某器官超过×Gy剂量的体积百分比
2.2 食管癌和肺癌患者放疗不同时期血清3种细胞因子浓度的变化
配伍组方差分析显示,食管癌和肺癌患者放疗前、放疗中(放疗5、10、15、20次时)及放疗后1月3种细胞因子血清浓度不同程度波动,均无统计学差异(P>0.05),但各患者之间血清TGF-β1、PDGF-B、IL-10浓度差异有统计学意义(P<0.05),见表2。
2.3 食管癌和肺癌放疗患者各时期各级RP间血清细胞因子浓度比较
以放疗时期、RP为影响因素的双因素方差分析显示,放疗不同时期血清IL-10浓度差异无统计学意义(P=0.648),不同级别RP间血清IL-10浓度差别有统计学意义(P=0.037),见表3,进一步行两两比较示2级RP与1级RP、无RP患者血清IL-10浓度有差别(P<0.05),见表4。同样的分析显示,不同级别RP间血清TGF-β1、PDGF-B浓度差别均无统计学意义(P>0.05),不同时期血清TGF-β1、PDGF-B浓度差异亦均无统计学意义(P>0.05),见表3。
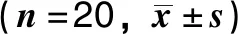
表2 食管癌和肺癌患者血清细胞因子浓度放疗前中后变化
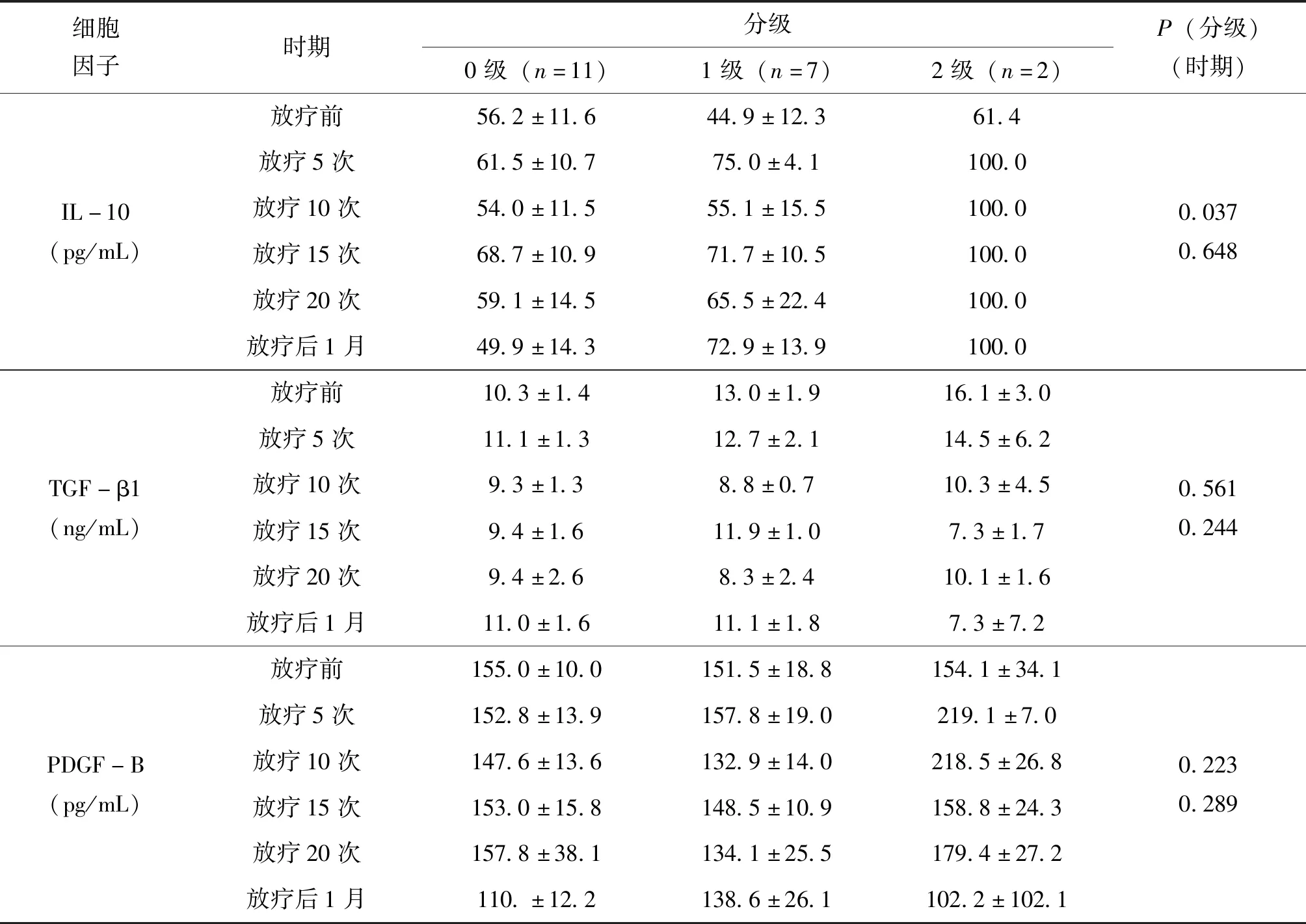
表3 食管癌和肺癌患者血清3种细胞因子各时期急性放射性肺炎分级间比较
2.4 食管癌和肺癌放疗患者血清细胞因子浓度与RP相关性
以放疗时期为控制因素,对食管癌和肺癌放疗患者血清细胞因子浓度与RP发生行偏相关分析发现,血清IL-10浓度与RP发生呈正相关(P<0.05),血清TGF-β1、PDGF-b浓度与RP发生无相关性,见表5。
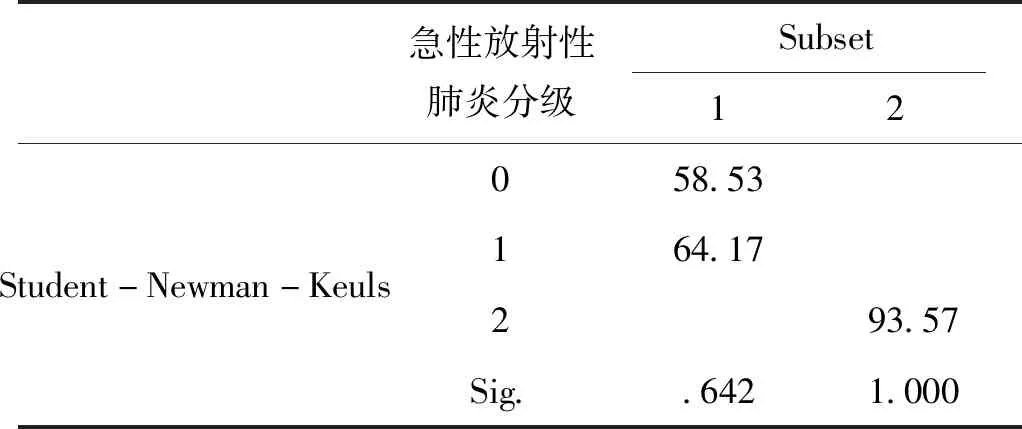
表4 食管癌和肺癌患者各时期急性放射性肺炎 分级间血清IL-10两两比较(pg/mL)
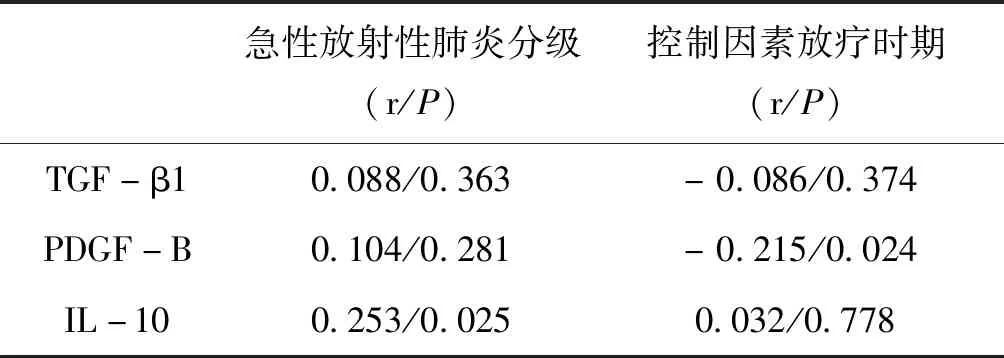
表5 食管癌和肺癌患者血清细胞因子浓度与 急性放射性肺炎分级的偏相关分析
3 讨 论
3.1 临床及剂量因素与放射性肺损伤的发生
胸部肿瘤放射治疗者约有1/5~1/3的患者发生症状性RP,其发生严重影响并限制了临床有效放射治疗剂量的应用。众多研究表明,年龄、性别、治疗前基础肺功能、慢性阻塞性肺疾病史、体力状态评分、吸烟史、剂量分割方式、放疗方式、肿瘤分期、肿瘤病理类型、肿瘤位置、肿瘤大小、是否接受化疗、是否同步放化疗等临床因素可能与RILI的发生有关,但也有研究得出不同结论[4- 9]。本研究中RP的发生率为45.0%,有临床意义的2级及以上RP发生率10%,低于相关文献报道。本研究中各级RP间在年龄、性别、吸烟史、化疗史、放疗总剂量(≥60 Gy与<60 Gy)、病种(食管癌、肺癌)方面未见统计学差异,为各级RP间血清细胞因子提供了合理比较的基础,但也不排除影响因素多而样本量小的因素。
3.2 血清中细胞因子浓度与放射性肺损伤的发生
大量实验研究表明,RILI实质上是由放射线引起肺内Ⅱ型肺泡上皮细胞、毛细血管内皮细胞、巨噬细胞及成纤维细胞等受损靶细胞参与,多种细胞因子介导的炎症和纤维化过程。RP主要由TGF-β1、TNF-α、白介素等细胞因子参与发生的急性炎症反应[10-11]。由此可见,在RILI发生发展的整个过程中,细胞因子诱发的级联反应是发生RILI的决定因素。血清细胞因子含量检测具有便捷、快速、廉价的特点,放疗前、中及后细胞因子含量的检测有助于筛检、预测发生RILI的高危人群,制定个性化的优化治疗方案,降低RILI的发生率。本研究初步观察了食管癌和肺癌患者放疗过程中TGF-β1、TNF-α、IL-10血清浓度动态变化,探讨其对RP发生的预测价值。
TGF-β1是一种由肺泡巨噬细胞产生并释放的细胞因子,能通过一系列自分泌及旁分泌的方式刺激成纤维细胞增殖,调节胶原的转录及翻译的过程,使其产生细胞基质蛋白,并诱导肺结缔组织生长因子出现高水平表达状态,进而促进肺纤维化的发生和加速[12]。在多种因素(如环磷酰胺、射线、肿瘤)导致的肺损伤中,均发现TGF-β1含量存在不同程度的升高[13]。有临床研究表明,食管癌和肺癌患者放疗过程中TGF-β1在放疗过程有波动,其动态变化与RP的发生有关,发生RP者的TGF-β1较未发生者明显升高[5],并且放疗结束后血清TGF-β1水平恢复到放疗前水平或降至正常意味着治疗后发生肺部并发症的风险降低[14]。但也有临床研究未见TGF-β1与RP发生相关。本研究显示食管癌和肺癌患者血清TGF-β1水平在放疗前较健康成人高(P<0.05),放疗过程中有波动,但放疗不同时期间差异无统计学意义(P>0.05),未见与RP发生相关(P>0.05)。
IL-10在体内主要是由单核巨噬细胞、T淋巴细胞、B淋巴细胞等多种炎性细胞产生的抗炎细胞因子,它的主要功能是通过阻断炎性细胞因子的产生,下调炎性反应的发生。一方面,IL-10能保护机体组织器官在炎性反应过程中不会产生过度的病理性改变,另一方面可抑制机体的免疫应答,对病原微生物的清除能力降低,为肿瘤生长营造合适的环境[9]。但也有研究发现IL-10具有免疫刺激作用[14-15]。但IL-10与RP关系的临床研究鲜见。本研究中食管癌和肺癌患者血清IL-10在放疗前、放疗中及放疗结束后1月均较健康成人高约50%以上(P<0.05),在放疗不同时期无显著变化(P>0.05),但各级RP间IL-10浓度有显著差异(P<0.05),且二者间存在偏正相关关系。
PDGF是于1974年发现的一种刺激结缔组织等组织细胞增长的肽类调节因子,当血液凝固时由崩解的血小板释放并被激活,具有刺激特定细胞的趋化及促进特定细胞的生长的活性。此外,在组织受到损伤后巨核吞噬细胞、血管平滑肌细胞、成纤维细胞、内皮细胞、胚胎干细胞等也可以合成并释放PDGF。人类PDGF是由两条独立的多肽链A、B借二硫键相连构成的同型或异型二聚体,这使PDGF具有多种形式的二聚体结构,如PDGF-AB、PDGF-A或PDGF-B等。在人体内主要是结缔组织细胞具有PDGF表面受体,如血管平滑肌细胞、成纤维细胞等,是结缔组织的促分裂剂,较低浓度的PDGF即可激活成纤维细胞的分裂增殖。研究发现在肺内PDGF与TGF-β起协同作用,能够对成纤维细胞的增殖及细胞外基质含量的变化进行调控,并且RP及肺纤维化进程中,肺泡巨噬细胞产生大量的PDGF-B,并且成剂量依赖性,其浓度的增加对肺成纤维细胞有明显的趋化作用[19]。本研究显示,食管癌和肺癌患者放疗前血清PDGF-B水平较健康成人高约40%(P<0.05),但放疗不同时期无变化(P>0.05),未见与RP发生相关(P>0.05)。
因此,本前瞻性初步研究提示食管癌和肺癌患者放疗前血清TGF-β1、PDGF-B、IL-10浓度较健康成人组升高;食管癌和肺癌放疗患者血清IL-10浓度在不同RP分级间有统计学差异,且呈偏正相关关系,有望成为RP的预测因子。但由于样本量较小,且RP临床研究的混杂因素多,有待扩大样本量进一步研究。

