海参肽的提取分离及其体外抗氧化活性
史亚萍,张玉,张绵松,贾爱荣,王加祥,刘昌衡*
山东省科学院生物研究所,山东省应用微生物重点实验室(济南 250014)
海参是海洋棘皮动物,属于海参纲,在世界各大海洋中均有广泛的分布,在我国沿海地区也有多个种类的分布。自古以来,海参即是十分贵重的营养保健品,人们一直都有食用海参的习惯。海参肽是指从海参中提取的具有特殊生理功能的活性肽,可以是由2~12个氨基酸组成的小肽或是分子量更大的多肽。海参肽生物利用率高,比氨基酸更易吸收[1-2]。
研究发现海参肽具有降血压、抗氧化、抗肿瘤及抗疲劳等多种功能,且其生理活性可能与海参肽分子量分布有一定的关系[3]。刘程慧等[4]研究发现分子质量在1~3 kDa海参肽对DPPH自由基有较强的清除能力;王静等[5]研究发现提取自溶酶酶解海参产生的不同分子量海参肽对活性氧(ROS)具有较强清除能力,分子量小于3 kDa海参肽清除能力最强。付学军等[6]研究发现清除超氧阴离子的海参肽分子量主要分布在5 kDa以下。目前对于在不同体系下,海参肽抗氧化活性与分子量关系的系统性研究较少。
试验采用生物酶解法,将海参蛋白酶解成多肽,并对酶解工艺进行优化。对酶解产物采用超滤法分离不同分子量海参肽,最后在多种体系下,对不同分子量海参肽进行体外抗氧化活性研究,比较分析不同体系下海参肽抗氧化活性与分子量关系,旨在为利用海参开发功能食品,促进海参资源开发利用与工业化生产提供技术指导和参考依据。
1 材料与方法
1.1 材料与仪器
海参,产自山东威海。水产蛋白酶(30万 U/g):南宁东恒华道生物科技有限公司;中性蛋白酶(5.7万U/g)、风味蛋白酶(6.8万 U/g)、碱性蛋白酶(30万U/g)、复合蛋白酶(1.3万 U/g)、胰蛋白酶(5.3万U/g):诺维信生物技术有限公司;木瓜蛋白酶(8.9万U/g):南宁庞博生物工程有限公司;其他试剂均为分析纯。
JSP-350 A高压多功能粉碎机(浙江省永康市金穗机械制造厂);YXQ-LS-60 SII立式压力蒸汽灭菌器(上海博迅实业有限公司医疗设备厂);FA 1004 N电子天平(上海精密科学仪器有限公司);ST 3100实验室pH计:奥豪斯仪器(常州)有限公司;RE-52 A旋转蒸发器(上海亚荣生化仪器厂);SHB-Ⅲ循环水式多用真空泵(郑州长城科工贸有限公司);F 12冷冻循环器(Julobo公司);XX 80 EL 005超滤系统(MILLIPORE公司);MD 44-5 M透析袋(MYM生物技术有限公司);RETBS 025磁力搅拌器(IKA公司);CR 22 GⅢ冷冻离心机(Hitachi集团);M 200 pro多功能酶标仪(TECAN公司)。
1.2 试验方法
1.2.1 酶解试验
1) 蛋白酶种类的确定。新鲜海参清洗,去除内脏,热水漂烫,沥干称质量,加5倍水粉碎打浆,过胶体磨磨细。将海参浆加热至100 ℃,保温10 min,待冷却后,将海参液分为7等份,选用复合蛋白酶、木瓜蛋白酶、水产蛋白酶、中性蛋白酶、风味蛋白酶、胰蛋白酶和碱性蛋白酶在各自适宜的条件下进行酶解,酶解后于100 ℃保温10 min灭酶,以4 000 r/min离心10 min,收集上清液进行水解度测定,每组试验重复进行3次。以水解度为指标,选择水解度最大的酶做后续研究。
2) 单因素试验。分别考察酶解时间、料液比和加酶量对水解度的影响。水解完成后于100 ℃保温10 min灭酶,以4 000 r/min离心10 min,收集上清液进行水解度测定。
3) 响应面法优化提取工艺。为了优化海参多肽的提取工艺,参考李莉等[7]的方法,在单因素试验的基础上,确定酶解时间、料液比和加酶量3个单因素的水平分别为:加酶量(0.4%,0.6%和0.8%)、料液比(1∶3,1∶5和1∶7 g/mL)、酶解时间(2,4和6 h)。以料液比、加酶量和酶解时间为试验因素,水解度为响应值,用Design Expert 8.0软件,采用Box-Behnken设计进行试验,分析研究这3个因素对提取工艺的影响。
1.2.2 水解度的测定
水解度的测定参考TNBS法[8-9]。

式中:海参蛋白为8.0 mmol/g。
1.2.3 3种分子量海参多肽体外抗氧化活性的研究
海参经复合蛋白酶酶解后,酶解液通过超滤得到分子量大于3 kDa,1~3 kDa和小于1 kDa 3种海参多肽,经过冷冻干燥后得到固体样品,然后在ABTS+·清除能力、还原能力、O2-·清除能力、DPPH·清除能力4种体系下研究并比较三者的体外抗氧化活性。
ABTS+·清除活性的测定参考刘薇等[10]的方法。
ABTS+·清除能力的测定:将20 μL质量浓度为100,50,25,10和1 mg/mL的样品溶液、空白(甲醇)分别加到离心管中,再加入800 μL新鲜配制的ABTS+工作液,室温条件下,避光孵育5 min。各取200 μL加到96孔板中,用酶标仪于734 nm波长下检测,每个样品重复3次。

式中:AS为样品溶液吸光度,AO为空白溶液吸光度。
还原力的测定参考陈英等[11]的方法。
准确量取0.2 mL质量浓度为100,50,25,10和1 mg/mL的待测样品的水溶液及空白溶液(蒸馏水),再加入0.5 mL磷酸缓冲液(0.2 mol/L,pH 6.6)及0.5 mL 1%铁氰化钾溶液,混合均匀后,于50 ℃水浴孵育20 min;再加入0.25 mL 10%三氯乙酸溶液,室温孵育10 min;以8 000 r/min离心5 min;取上清液1 mL,再加入1 mL蒸馏水和0.2 mL 0.1%氯化铁溶液,混合均匀;取200 μL于96孔板,在700 nm处测定吸光度。溶液的吸光度越高,还原力越强,反之越弱。
在离心管中加入3.0 mL Tris-HCl溶液,然后分别加入0,1,2,4,8和16 mg/mL VC标准品及样品各200 μL,充分混匀后精确反应4 min,加入500 μL浓盐酸终止反应,于325 nm处测定吸光度,每个样品重复3次。

式中:A空白为Tris-HCl的OD值;A对照为Tris-HCl+邻苯三酚混合液的OD值;A样品为样品的OD值。
4) DPPH·清除活性的测定参考赵玲等[13]的方法。
将30 μL质量浓度为100,50,25,10和1 mg/mL的待测样品的水溶液及空白(蒸馏水)分别加到离心管中,再加入120 μL新鲜配制的DPPH甲醇溶液以及570 μL的甲醇溶液,混合均匀;在室温下,避光孵育30 min。分别取200 μL加到96孔板,用酶标仪于517 nm波长下进行检测,每个样品重复3次。

式中:AS样品溶液吸光度,AO空白溶液吸光度。
1.2.4 统计分析
以上重复3次试验,结果取其平均值。采用SAS软件和Design Expert对数据进行响应面分析,包括显著性差异分析、方差分析以及最佳试验条件和最佳响应值预测。
2 结果与讨论
2.1 蛋白酶种类筛选结果
将各种蛋白酶在各自适宜条件下对海参进行酶解,其酶解效果见表1。其中复合蛋白酶对海参酶解效果最好,碱性蛋白酶次之,木瓜蛋白酶最差。因此选定复合蛋白酶进行后续酶解条件优化。

表1 不同蛋白酶的水解效果
2.2 响应面试验结果与分析
2.2.1 单因素试验
料液比、加酶量和酶解时间分别对海参酶解效果的影响见图1。由图1(a)可知,当料液比为1:3~1:5(g/mL)时,水解度随料液比增大而不断提高;当料液比为1:5(g/mL)时,水解度最大,此后继续增大料液比,水解度稍有下降。由图1(b)可知,当加酶量为0.4%~0.8%时,水解度随加酶量增大而不断提高;当加酶量超过0.8%时,水解度变化不大。由图1(c)可知,当酶解时间为2~4 h时,水解度随加酶解时间增加而不断提高;当酶解时间超过4 h时,水解度变化不大。
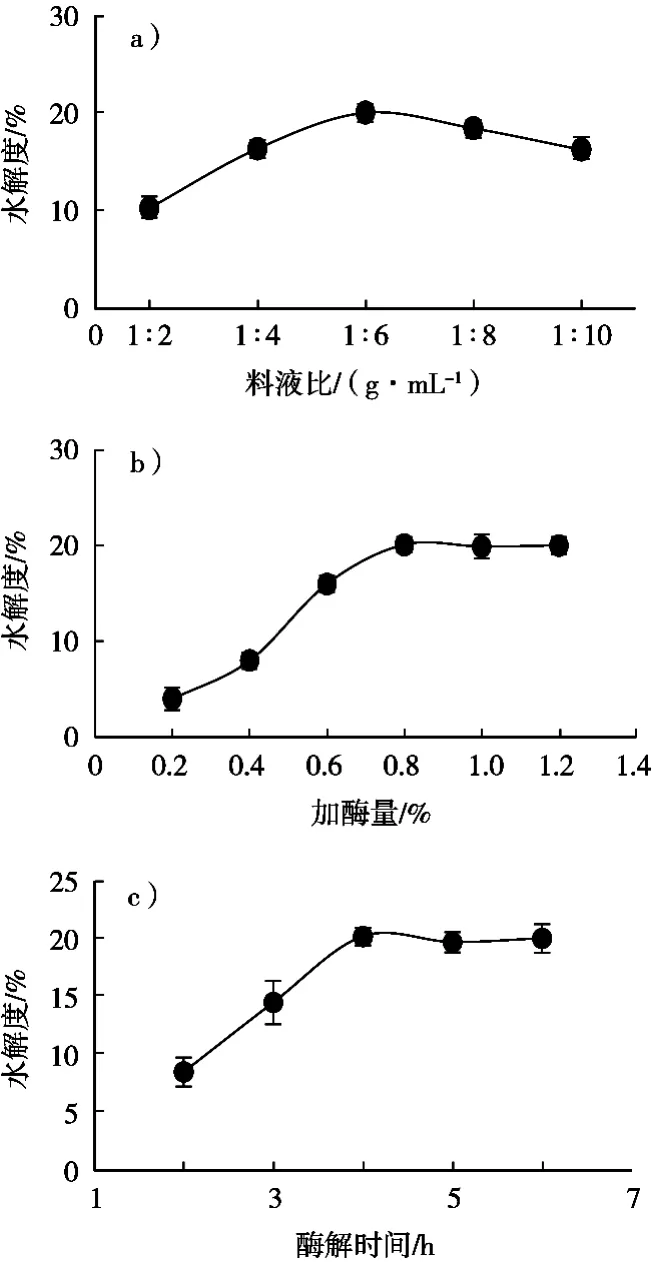
图1 料液比、加酶量和酶解时间分别对海参蛋白水解度的影响
2.2.2 响应面法优化
在单因素试验的基础上,以料液比、加酶量和酶解时间为试验因素,水解度为响应值,用Design Expert 8.0软件,采用Box-Behnken设计进行试验,分析研究这3个因素对提取工艺的影响。
2.2.2.1 数学模型的建立
采用Design Expert 8.0软件对水解度响应值进行回归拟合,建立二次回归模型,得回归方程:Y=21.21-0.27A+1.73B-0.32C+0.66AB-0.34AC+0.52BC-3.11A2-1.84B2-3.08C2。
对上述方程进行方差分析,结果见表3。R2=0.997 2,说明试验拟合程度良好;失拟项的p=0.331 6,说明模型失拟项不显著;校正系数=0.993 5,说明此模型可用来分析海参蛋白水解度。此外,料液比B对水解度有极显著影响;交互作用项AB、BC、A2、B2和C2均对水解度有显著影响;其他变量的影响均不显著。由表3可知,影响水解度的因素顺序为B(料液比)>C(酶解时间)>A(加酶量)。

表2 响应面法优化提取工艺
2.2.2.2 两因素间的交互效应分析
两因素间的交互效应分析见图2。
2.2.2.3 最优值预测及方法预测
软件解析得出海参蛋白酶解的最佳条件:加酶量0.79%,料液比1:5.36(g/mL),酶解时间3.93 h。在此条件下,海参蛋白水解度的理论值为21.38%;实际操作,酶解时间4 h,3次重复试验测出海参蛋白水解度为21.12%,与理论值相比,相对误差为1.21%。
2.3 3种分子量的海参肽体外抗氧化活性的比较
2.3.1 ABTS+·清除活性
3种不同分子量海参肽ABTS+·清除率见图3。3种分子量海参肽都有ABTS+·清除活性;在质量浓度为1~50 mg/mL范围内,ABTS+·清除能力随着海参肽浓度的升高不断增大;在质量浓度为50~100 mg/mL范围内,ABTS+清除能力随着海参肽浓度的升高增加不明显,曲线趋于平缓;其中分子量小于1 kDa海参肽ABTS+·清除能力最强,分子量1~3 kDa海参肽ABTS+·清除能力次之,分子量大于3 kDa海参肽ABTS+·清除能力最弱。
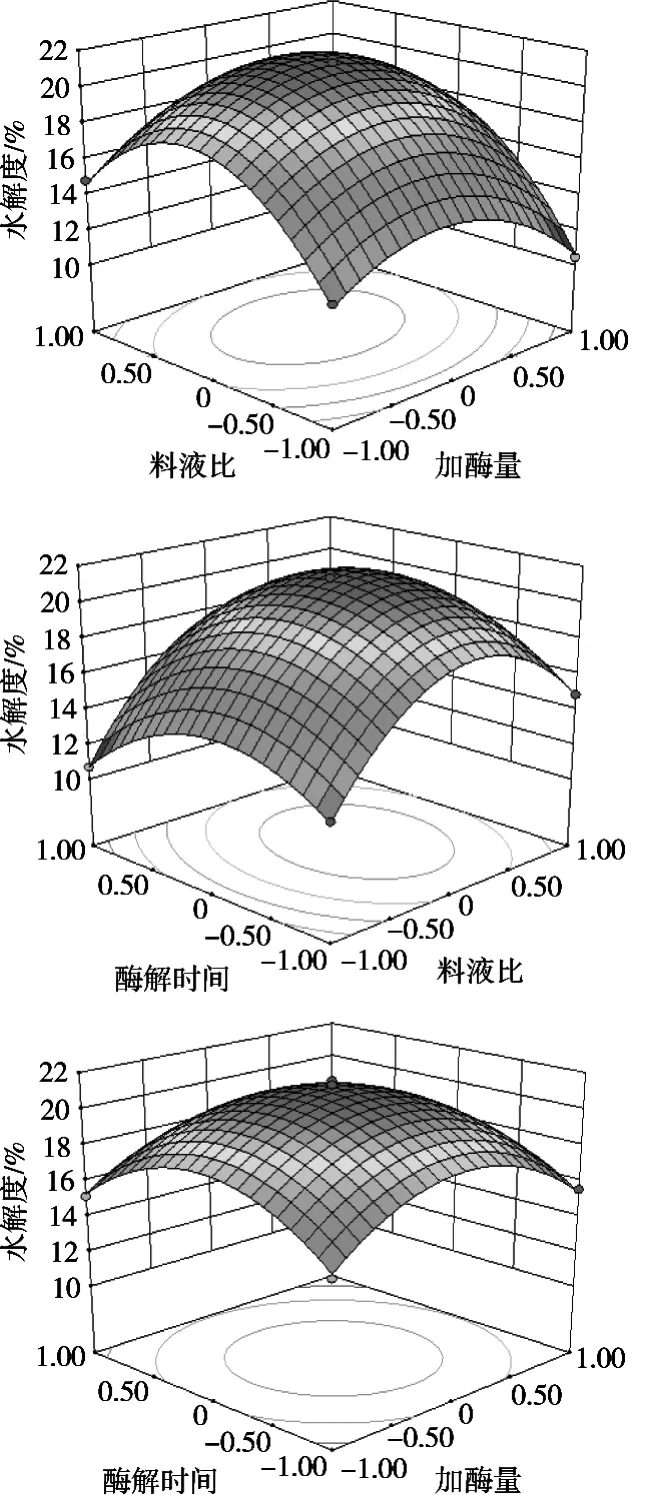
图2 两因素间的交互效应分析

图3 不同分子量海参肽的ABTS+·清除活性
2.3.2 还原力的测定
3种不同分子量海参肽的还原力结果见图4。吸光度越高,还原力越强,反之越弱。从图4可以看出,3种分子量海参肽都有显著还原能力,在质量浓度为0.1~100 mg/mL范围内,还原能力随着海参肽浓度的升高不断增大,其中分子量大于3 kDa海参肽还原能力最强,分子量1~3 kDa海参肽还原能力次之,分子量小于1 kDa海参肽还原能力最弱。
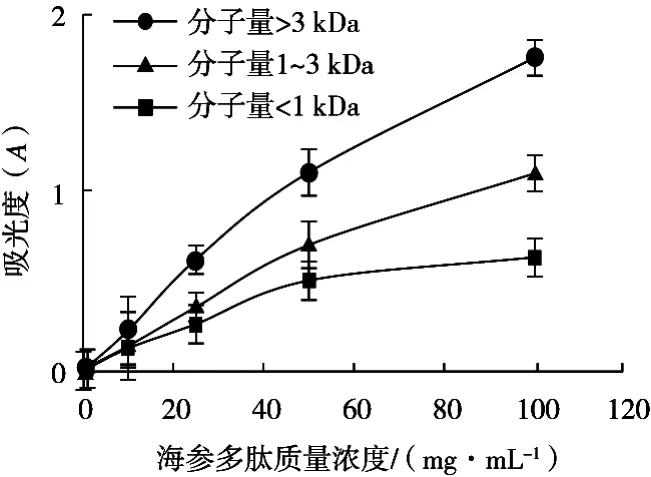
图4 不同分子量海参肽的还原力
同质量浓度(1 mg/mL)下,3种不同分子量海参肽以及维生素C的清除率见表4。分子量小于1 kDa海参肽清除活性最强,1~3 kDa海参肽次之,分子量大于3 kDa海参肽最弱;此外三者清除活性均低于维生素C。
表4 清除率

表4 清除率
?
2.3.4 DPPH·清除活性
3种不同分子量海参肽DPPH·清除率见图5。3种分子量海参肽都具有DPPH·清除活性。在质量浓度为1~100 mg/mL范围内,DPPH·清除能力随着肽浓度的升高不断增大。其中分子量大于3 kDa海参肽DPPH·清除能力最强,分子量1~3 kDa海参肽次之,分子量小于1 kDa海参肽最弱。
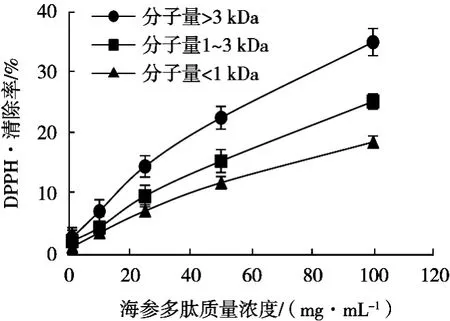
图5 不同分子量海参肽的DPPH·清除活性
3 结论
为获得多肽含量高的海参蛋白酶解液,试验研究了复合蛋白酶、木瓜蛋白酶、水产蛋白酶、中性蛋白酶、风味蛋白酶、胰蛋白酶和碱性蛋白酶水解法对海参蛋白的水解能力,最后确定以复合蛋白酶为最佳用酶。又以料液比、加酶量、酶解时间为试验因素,水解度为响应值,通过响应面法对提取工艺进行优化,分析得出海参蛋白酶解最佳条件为加酶量0.79%、料液比1:5.35(g/mL)、酶解时间3.93 h,在此条件下,海参蛋白水解度为21.38%。通过超滤分别得到分子量大于3 kDa,1~3 kDa和小于1 kDa 3种海参肽,冷冻干燥后,在ABTS+·清除能力、还原能力、DPPH·清除能力、清除能力4种体系下比较三者体外抗氧化能力。结果显示,分子量小于1 kDa海参肽对ABTS+·、清除活性最高,1~3 kDa海参肽次之,大于3 kDa海参肽最弱;分子量大于3 kDa海参肽还原能力以及对DPPH·清除活性最强。此次研究结果为利用海参资源开发具有抗氧化功效功能食品提供了理论依据。

