经食管实时三维超声心动图评价房性心律失常对二尖瓣结构和功能的影响
盛 哲,史学功,赵 韧,金朝龙,肖 洁,张定欣
由心房导致的心动频率和节律的异常称为房性心律失常,包括房性期前收缩(房早)、心房颤动(房颤)、心房扑动(房扑)、房性心动过速(房速)等,其中以房颤在临床上最为多见,具有较高的致残率和致死率[1]。经导管射频消融术(radiofrequency catheter ablation,RFCA)治疗房性心律失常已得到临床上的广泛认可。
早期,经胸超声心动图(transthoracic echocardiography,TTE)检查难以清晰显示二尖瓣的精确结构。近年来,经食管实时三维超声心动图(real-time three-dimensional transesophageal echocardiography,RT-3D-TEE)技术迅猛发展,快速、实时地显示二尖瓣空间立体结构成为现实。该研究旨在通过RT-3D-TEE技术对房性心律失常患者的二尖瓣进行定量分析,以此评价房性心律失常对二尖瓣结构和功能的影响。
1 材料与方法
1.1 病例资料入选2017年3~12月因房性心律失常来安徽医科大学第一附属医院拟行RFCA的患者46例,其中男28例,女18例,年龄36~77(59.83±10.06)岁。根据术前标准十二导联心电图,46例患者中阵发性房颤23例、持续性房颤9例、房扑4例、混合型房性心律失常(合并两种或两种以上的房性心律失常)10例。另选取性别、年龄相匹配的20例窦性心律者为正常对照组,其中男12例,女8例,年龄19~76(56.20±15.52)岁。记录患者的身高、体质量、病程、基础疾病、用药史等信息。排除标准为先天性心脏病、心脏瓣膜病、严重的心衰和心律失常、急性心肌梗死以及食管狭窄等无法完成TEE检查者。
1.2 仪器与方法Philips IE33超声成像仪、经胸探头S5-1(频率为1.7~3.4 MHz)、经食管三维探头X7-2t(频率为2~7 MHz)。二尖瓣定量分析可通过Qlab 9.0 二尖瓣量化(mitral valve quantification,MVQ)脱机分析软件来实现[2]。
1.3 研究方法
1.3.1TTE检查 于胸骨旁左室长轴切面获取左房前后径(left atrium anterior-posterior diameter,Lad),M型超声计算出左室射血分数(left ventricular ejection fraction,LVEF)
1.3.2RT-3D-TEE检查 术前禁食水,知情同意后,口服1%利多卡因胶浆,接心电监护,将前端涂抹耦合剂的X7-2t探头插入距门齿30~40 cm处,调整探头至清晰的食管中段左心室长轴切面,评估二尖瓣返流情况,再通过实时三维局部放大(three-dimensional ZOOM,3D ZOOM)选择包括二尖瓣环、前后叶和主动脉瓣环在内的感兴趣区域,获取连续5个心动周期的三维数据,存盘分析。
1.3.3脱机分析 Qlab 9.0 MVQ软件:① 将原始图像调整至与图1方位一致,可同时暴露二尖瓣和主动脉瓣。② 选取时相并标记二尖瓣环、主动脉瓣环及二尖瓣最低点的位置。选取舒张早期和收缩末期:舒张早期定义为二尖瓣叶开放早期,瓣叶清晰,无回声失落的时刻;收缩末期定义为心电图上T波终点对应二尖瓣叶闭合程度最大的时刻。③ 逐一标记同一时相不同角度所对应的二尖瓣环的位置。④ 标记二尖瓣叶内、外联合和瓣叶分区的位置。⑤ 逐帧描记同一时相二尖瓣叶的轨迹。完成以上步骤获得二尖瓣3D模型,逐一计算瓣环前外侧至后内侧直径(anterolateral to posteromedial diameter,DAlPm)、瓣环前后径(anterior to posterior diameter,DAP)、瓣环高度(height,H)、瓣环周长(three dimensional circumference,C3D)、瓣环投影面积(two dimensional area,A2D)、主动脉瓣口与二尖瓣环平面夹角(nonplanarity angle,NPA)、对合面积及对合指数。根据何怡华 等[3]和韩建成 等[4]的早期研究,二尖瓣对合面积需采用间接计算的方法。计算公式为:二尖瓣对合面积=舒张早期的二尖瓣面积-收缩末期的二尖瓣面积。为了校正个体间体表面积和瓣叶大小的差异,又引入对合指数的概念,其计算公式为:二尖瓣对合指数=[(舒张早期的二尖瓣面积-收缩末期的二尖瓣面积)/舒张早期的二尖瓣面积]×100%。
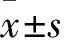

图1 MVQ定量分析示意图
A:收缩末期;b:舒张早期;A:前方;P:后方;AL:二尖瓣前外侧联合;PM:后内侧联合;AO:主动脉根部
2 结果
2.1 房性心律失常组与窦性心律组临床基线资料和二尖瓣各参数比较房性心律失常组患者46例,窦性心律对照组20例,两组在性别、年龄、体质量指数(body mass index,BMI)、体表面积(body surface area,BSA)以及是否合并糖尿病、高血压病、高脂血症等方面的差异无统计学意义。见表1。房性心律失常组患者出现轻度以上二尖瓣返流25例,相比窦性心律组(1例)差异有统计学意义。此外,房性心律失常组患者使用倍他乐克和阿司匹林的比例显著高于窦性心律组。房性心律失常组和窦性心律组二尖瓣各参数比较见表2。与窦性心律组相比,房性心律失常组患者的Lad、DAlPm、DAP、C3D、A2D、H均显著增加(P<0.001),对合指数显著降低(P<0.05),而两组患者对合面积、LVEF、NPA的差异无统计学意义(P>0.05)。

表1 患者临床基线资料比较

表2 两组间二尖瓣各参数比较


表3 逐步线性回归分析患者二尖瓣各参数与对合指数的相关性

表4 对合指数相关性分析


表5 逐步线性回归分析患者各临床因素与二尖瓣对合指数的相关性

图2 各房性心律失常组间二尖瓣相关参数比较

表6 二项Logistic回归分析分析患者各临床因素与二尖瓣对合指数的相关性

表7 二项Logistic回归分析患者各临床因素及二尖瓣对合指数对患者二尖瓣返流的影响
3 讨论
二尖瓣亦称为二尖瓣装置,包括瓣环、瓣叶、瓣下腱索和乳头肌[5],各部分结构完好,紧密配合,是保证其功能正常运转的前提。正常人二尖瓣叶分前、后两叶,瓣环亦分为与之对应的前、后瓣环。前瓣环结构致密,后瓣环较为疏松。在完整的心动周期中,二尖瓣环始终保持外低内高的“马鞍形”结构,其形态对二尖瓣功能有着重要作用。
房性心律失常时,心房肌正常的电活动消失,在电重构与解剖重构[6]的作用下,左房扩大。由于二尖瓣后瓣环与左房后壁相延续,后瓣环结构疏松的特质将导致其向左房扩大的方向延伸,引起瓣环扩张。正常情况下,二尖瓣前、后叶的总面积约为瓣环面积的1.4倍[7],以保证充分闭合,杜绝返流发生。当瓣环扩大时,前、后叶间距被拉大,瓣叶的有效对合面积和对合高度将减小,导致收缩期心房侧的返流。本研究中对合指数与返流程度有明显相关,既往研究[8]中有过相关报道。对合指数可作为评价二尖瓣叶对合功能的指标之一[9],本研究中房性心律失常组患者出现对合指数下降,提示瓣叶功能的改变可能与心律失常有关。
同时,本研究并未发现不同类型房性心律失常患者的二尖瓣对合指数有显著差异,且线性回归和二项Logistic回归均未发现患者病程长短对二尖瓣结构和返流有显著影响。前者考虑为以下原因:房性心律失常并不直接导致瓣叶功能的改变,而是通过引起左房、瓣环大小的改变,进而引起瓣叶相应的变化,故各组间差异不明显。既往研究[10-11]表明:房颤患者,随着病程的进展,二尖瓣返流程度亦相应增大,本研究中房颤患者构成较少,其他如房早、房扑、房速等较房颤对心房的重构较轻,其对应的二尖瓣结构改变可能处于代偿期,可扩大样本量进一步研究以明确。另外,本研究未能收集患者的既往治疗史,而该方面的因素可能对病程的作用产生影响,导致病程与二尖瓣结构功能的改变不相关。
本研究还表明性别与二尖瓣对合指数相关,女性对合指数更差。同时,比较窦性心律组中男性和女性的对合指数,差异无统计意义[(30.77±1.33)%vs(31.81±1.98)%,P=0.200],提示该差异并非先天存在。在房性心律失常患者中,尚缺乏性别对二尖瓣结构功能影响的报道。虽然性别对二尖瓣对合指数有影响,但本研究并未发现性别能够影响二尖瓣返流,说明性别对二尖瓣功能的影响较微弱。
本研究亦存在不足之处:① 房性心律失常分组样本数较少,不同类型的心律失常对二尖瓣结构功能影响的差异未能体现,且入选的多为症状明显的患者,无症状或症状轻微者未能纳入研究;② 本研究中患者的既往治疗史、吸烟饮酒史等影响因素未能规范纳入研究;③ MVQ软件对时相的确定需结合心电图及瓣叶启闭情况,存在主观因素影响。

