慢性肾脏病3~5期非透析患者中性粒细胞与淋巴细胞比值与腹主动脉钙化的相关性研究
吴茜茜,王德光,张 森,张晶晶,郝 丽
心血管事件是慢性肾脏病患者(chronic kidney diseases,CKD)早期死亡的主要原因[1],而血管钙化是CKD患者发生动脉粥样硬化、心肌梗死和心脏骤停等心血管事件的一个重要因素。尽管现在认为高脂血症、高血压、糖尿病、吸烟是CKD患者血管钙化的高危因素,但骨矿物疾病、炎症、氧化应激、营养不良和免疫反应等非传统因素也可导致CKD患者血管钙化发生的风险增加,因此,需要更好的诊断工具来评价CKD患者血管钙化风险[2]。近年来,较多证据表明炎症及炎症细胞因子在血管钙化中起重要作用,如C反应蛋白(C-reactive protein,CRP)、白介素-1β(interleukin-1β,IL-1β)、白介素6(interleukin-6,IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α),而新的生物标志物中性粒细胞与淋巴细胞比值(neutrophil-lymphocyte ratio,NLR)被认为是一种新型炎症指标,在一定程度上反映了机体炎症状态[3],由于操作简便和低成本等特点而成为研究热点。
心血管钙化的评估方法包括颈部血管彩超评估颈动脉斑块、心脏彩超评估心脏瓣膜钙化、CT评估冠状动脉钙化和腹部侧位X线片评估腹主动脉钙化(abdominal aorta calcification,AAC)。改善全球肾脏病预后组织(kidney disease:improving global outcomes,KDIGO)指南指出,用腹部侧位X线片评估CKD患者是否存在钙化,以此代替CT成为基础的检查方法[4]。AAC在CKD患者中较普遍发生,发病率高达68.9%,严重的AAC是重要的心血管疾病和死亡的预测因子[5],故本研究选用腹主动脉钙化反映CKD患者大血管钙化情况。目前NLR在CKD患者血管钙化方面的研究甚少,该研究将探讨NLR与AAC的相关性及对其预测价值,为临床评估CKD患者血管钙化情况提供一个廉价、方便、易测的指标。
1 材料与方法
1.1 病例资料选取2017年10月~2018年5月在安徽医科大学第二附属医院肾内科住院的慢性肾脏病3~5期非透析患者181例。病例排除标准:① 近3个月出现感染、创伤的患者;② 既往半年因原发性肾脏病或系统性疾病使用激素或免疫抑制剂治疗;③ 自身免疫性疾病或血液病;④ 肿瘤。
1.2 研究方法
1.2.1一般资料 收集患者性别、年龄、原发病及既往疾病史、吸烟饮酒史、身高、体质量、血压、药物使用史等人口学资料。
1.2.2实验室指标 记录患者中性粒细胞计数、淋巴细胞计数、超敏C反应蛋白(hypersensitive C reaction,Hs-CRP)、血钙、血磷、血镁、全段甲状旁腺激素(intact parathyroid hormone,iPTH)、白蛋白、血红蛋白(hemoglobin,HB)、血肌酐(serum creatinine,Scr)、尿素氮、尿酸、总胆固醇(total cholesterol,TC)、三酰甘油(triacylglycerol,TG)等实验室检查结果,计算NLR(NLR=中性粒细胞计数/淋巴细胞计数),校正钙公式[4, 6]:Alb<40 g/L时,血清钙以如下公式进行校正:校正钙(mmol/L)=血清总钙(mmol/L)+0.2×[4-Alb(g/L)/10]。并行腹部侧位X线片检查。
1.2.3腹主动脉钙化 所有患者完成腹部侧位X线片检查,包括第11节胸椎~第2节骶椎骨,由放射科有经验的医师盲法阅片,使用Kauppila et al[7]报道的半定量积分法计算腹主动脉钙化积分(AACS),分别按照第1腰椎~第4腰椎平面,腹主动脉前壁、后壁有无钙化及钙化斑块的长度评分:0分:无钙化,1分:钙化范围<1/3的动脉壁长度,2分:钙化范围累及1/3至2/3动脉壁长度,3分:钙化范围>2/3动脉壁长度,以累积各节段的总的AACS(0~24分)评估患者有无腹主动脉钙化情况。
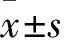
2 结果
2.1 病例资料本研究共纳入CKD3~5期非透析患者181例,年龄22~85(55±14)岁,其中AAC的发生率为34.81%(63例)。男103例(56.9%),其中37例(35.9%)发生AAC;女78例(43.1%),其中26例(33.3%)发生AAC。有151例(83.4%)合并高血压,52例(28.7%)合并糖尿病,22例(12.2%)合并脑血管疾病。原发病包括:高血压肾病57例(31.5%),糖尿病肾病41例(22.7%),慢性肾小球肾炎54例(29.8%),多囊肾4例(2.2%),尿酸性肾病8例(4.4%),梗阻性肾病2例(1.1%),缺血性肾病3例(1.7%),其他不明原因的有12例(6.6%)。
2.2 两组生化指标比较按照有无腹主动脉钙化,将181例CKD3~5期非透析患者分为钙化组(AACS>0)63例与非钙化组(AACS=0)118例。钙化组NLR水平为3.8(2.8,5.3),明显高于非钙化组2.5(1.9,3.2),差异有统计学意义(P<0.001)。且钙化组的Hs-CRP、校正钙、钙磷乘积水平高于非钙化组(P<0.05),白蛋白水平明显低于非钙化组(P<0.05),组间比较差异有统计学意义。钙化组糖尿病患病率(46.0%)高于非钙化组(19.5%),差异有统计学意义(P<0.05);钙化组高血压患病率(88.9%)亦高于非钙化组(80.5%),但差异无统计学意义(P=0.149)。两组患者在血清磷、血肌酐、TC、TG、iPTH、25(OH)D3、磷结合剂使用史等差异无统计学意义(P>0.05)。见表1。
2.3 AAC与各临床资料相关性分析CKD3~5期非透析患者腹主动脉钙化与年龄(rs=0.365,P<0.001)、糖尿病(rs=0.279,P<0.001)、NLR(rs=0.468,P<0.001)、Hs-CRP(rs=0.221,P=0.017)、校正钙(rs=0.174,P=0.045)、BNP(rs=0.272,P=0.006)呈正相关性,与舒张压(rs=-0.186,P=0.014)、钙磷乘积(rs=-0.151,P=0.044)、白蛋白(rs=-0.202,P=0.009)呈负相关性。见表2。
2.4 AAC危险因素的Logistic回归分析以是否发生AAC为因变量,将年龄、糖尿病、吸烟、舒张压、BNP、白蛋白、钙磷乘积、较正钙、NLR、Hs-CRP作为自变量行二项Logistic回归分析,结果显示:高龄(OR=8.898,P=0.008)、高Hs-CRP(OR=5.352,P=0.038)、NLR>3.74(OR=33.734,P=0.019)是腹主动脉钙化的独立危险因素。见表3。
2.5 NLR对AAC诊断效能以AAC为状态变量,以NLR、年龄为检验变量绘制ROC曲线,分别计算NLR、年龄及NLR与年龄联合指标在AAC患者中的ROC曲线下面积。NLR与年龄的曲线下面积分别为0.780(95%CI0.706~0.854,P<0.001)、0.721(95%CI0.641~0.801,P<0.001),NLR与年龄联合指标曲线下面积为0.829(95%CI0.767~0.890,P<0.001),NLR与年龄联合指标的ROC曲线下面积最大。见图1。

表1 腹主动脉钙化组和非钙化组临床资料比较
BMI:体质量指数;WBC:白细胞计数;Ca:血清钙;P:血清磷;ALP:碱性磷酸酶;25(OH)D3:25-羟维生素D3;BNP:心房钠尿肽
3 讨论
在终末期CKD患者中,心血管事件已取代感染变量赋值:舒张压、BNP、白蛋白、钙磷乘积、校正钙为定量变量,是否有糖尿病(是=1,否=0);是否吸烟(是=1,否=0);年龄(<55岁=1,≥55岁=2);N/R(<2.13=1,2.13~3.74=2,>3.74=3);Hs-CRP(≤1.415=1,>1.415=2)成为了首要致死原因,血管钙化被认为是慢性肾脏病患者心血管事件发生及全因死亡率的重要预测因子。其中,平滑肌细胞表型改变及骨相关蛋白的表达在血管钙化中起主要作用,被认为是一种受控的代谢过程,与新骨的形成非常相似[8]。研究[9]显示,至少55%的CKD患者在透析前就已经出现血管钙化,本研究中CKD3~5期非透析患者AAC的发生率为34.8%,故对其进行早期诊断及防治具有重要意义。

表2 腹主动脉钙化和临床指标的相关性分析

表3 腹主动脉钙化影响因素的二分类Logistic分析

图1 CKD3~5期非透析患者中NLR、年龄在腹主动脉钙化中的ROC曲线分析
CKD患者体内普遍存在微炎症状态,与促炎性细胞因子活性上调有关,但其原因尚不完全清楚。当肾功能下降时,晚期糖基化终产物和促氧化剂在体内滞留,有助于激活单核细胞以及刺激炎症反应[10];CKD患者病程中伴随的糖尿病、容量超负荷、脂代谢紊乱等多种因素,都会导致CKD患者体内呈现慢性炎症状态[11]。全身炎症状态和CKD患者血管钙化密切相关,Agharazii et al[12]发现慢性肾脏病大鼠在发生胸主动脉钙化过程中,血管平滑肌细胞(VSMC)向成骨样细胞转分化伴骨形成蛋白-2(BMP-2)和骨钙素表达增加的同时,IL-β、IL-6和TNF-α的表达也明显增加,表明炎症可能参与了血管钙化的发生和发展过程。该研究中钙化组NLR水平明显高于非钙化组,且NLR水平升高是腹主动脉钙化发生的独立危险因素,当NLR大于3.74时,发生AAC的风险是NLR小于2.13的患者的34倍,高NLR水平易发生血管钙化的原因考虑以下方面可能[13]:中性粒细胞释放的基质金属蛋白酶促进细胞外基质释放血管内皮生长因子,加速钙化结节形成;另外中性粒细胞可以释放过量自由基,损伤血管内皮细胞,促进平滑肌细胞表型转变,加速血管钙化形成;淋巴细胞计数减少可促进TNF-α、IL-6等炎症介质产生,而炎症介质对血管钙化有促进作用。
人类平滑肌细胞在单纯复制型衰老过程中伴随着BMP-2、分泌型焦磷酸蛋白(SPP1)等基因(促细胞成骨样转化)表达的增加和基质Gla蛋白(MGP)、骨保护素、核心蛋白聚糖等基因(抑制成骨样转化)的表达减少,证明了衰老本身就是一个成骨样转化过程[14]。本研究结果显示年龄是CKD3~5期非透析患者腹主动脉钙化的独立危险因素,当与NLR联合预测AAC时,其曲线下面积均大于NLR和年龄单独分析时的曲线下面积,说明NLR与年龄的联合指标对AAC的预测价值更大。
既往研究[15]表明,iPTH是CKD患者腹主动脉钙化进展的独立危险因素。iPTH的分泌主要受细胞外钙水平的调节,细胞外钙离子能结合并活化甲状旁腺细胞上的钙敏感受体,导致甲状旁腺素释放减少。CKD患者体内低钙高磷状态,使PTH释放增多,高水平iPTH直接或间接作用于成骨和破骨细胞等,加重骨代谢和矿物质代谢紊乱[16],受损的骨质进一步扰乱血清钙磷和iPTH水平,从而促进CKD患者发生血管钙化。而本研究中,AAC与非AAC组中iPTH水平无明显差异,与既往研究不符,考虑可能与骨化三醇等药物的使用有关。
综上所述,CKD3~5期非透析患者AAC发生率高,NLR、年龄与AAC的发生有关,并对AAC有着较好的预测价值,且NLR与年龄的联合指标对AAC的预测价值更大,因此临床工作中应注意关注患者年龄和NLR水平,充分评估患者血管钙化风险,并依据相应临床结果尽早干预。本研究为横断面研究,无法得出NLR与AAC之间的因果结论,可对CKD患者进行长期随访,进一步评估NLR变化情况与血管钙化进展之间的关系。

