NLRC5抑制自噬促进子宫内膜癌细胞增殖的研究
姚 顺,詹 磊,孙士莹,王文艳,卫 兵
子宫内膜癌(endometrial cancer, EC)作为最常见的女性生殖系统癌症之一,是第六大肿瘤死亡原因,而且EC在年轻女性中的发病率正在上升,流行病学调查显示每年全世界有超过280 000个女性被诊断为EC患者[1]。目前临床上EC的治疗主要包括外科手术、放化疗以及药物治疗,但这些治疗方式疗效均不是很好[2]。NLR家族含CARD结构域5[NOD like receptor (NLR) family, caspase recruitment(CARD) domaincontaining 5,NLRC5],又称MHC I反式激活因子,是2010年新发现的NLRs样受体家族中的受体之一[3]。最新研究[4]发现,NLRC5在肿瘤的发生发展过程中发挥着重要的作用,且NLRC5的水平与肿瘤患者发病率与存活率相关。但NLRC5对EC的作用及其机制尚不清楚。近年来,国内外学者发现,自噬可以参与NLRs的调节过程[5-6]。自噬是近年来新发现的一种程序性细胞死亡形式,是溶酶体介导的细胞内大分子物质及细胞器降解的过程[7]。其过程需要依赖自噬相关蛋白LC3、Beclin1等的参与[8]。大量研究[9]证实自噬与肿瘤之间存在密切的联系而且自噬在肿瘤的治疗中具有潜在作用。但自噬是否参与NLRC5的调节过程目前尚无文献报道。该研究探讨NLRC5是否通过调控自噬在EC细胞中发挥作用,以期为该病的治疗提供新的靶点。
1 材料与方法
1.1 材料
1.1.1细胞系 人子宫内膜腺癌AN3CA细胞株(上海Sigma公司)由安徽医科大学第二附属医院实验室保存,将细胞培养于含10%胎牛血清、含1%青霉素及链霉素的DMEM培养基中(美国Gibico公司),在37 ℃、5%CO2及饱和湿度的恒温培养箱内培养,每2~3 d换液1次。
1.1.2标本收集 收集EC患者手术切除的EC组织标本及门诊病理显示正常的子宫内膜标本各20例,术前均未接受性激素的治疗或辅助放化疗。EC标本20例为实验组,选取病例年龄为45~65(52±5.42)岁,平均年龄52岁。病理类型均为腺癌,手术病理分期为Ⅰ期。正常子宫内膜标本20例作为对照组,且与研究组年龄差异无统计学意义,术前均未接受性激素的治疗。标本在获取知情同意后取自安徽医科大学第二附属医院妇产科临床诊断明确的患者。符合伦理学要求(伦理编号:LLSC20180085)。
1.1.3主要试剂 NLRC5 (ab105411)兔多克隆抗体、Beclin1兔单克隆抗体、LC3B[EPR18709]兔单克隆抗体(美国Abcam公司);ECL发光试剂盒、山羊抗兔二抗、山羊抗小鼠二抗(美国affinity公司);PVDF 膜(上海Biosharp公司);绿色荧光蛋白(green fluorescent protein, GFP)抗体(南京金斯瑞生物科技);CCK-8试剂盒(日本Dojindo公司);GADPH、NLRC5、Beclin1、LC3引物序列(南京金斯瑞生物科技有限公司合成);NLRC5质粒(武汉赛维尔生物科技有限公司构建);免疫组化试剂盒(武汉赛维尔生物科技有限公司);高糖DMEM液体培养基、胎牛血清(美国Gibco公司);PBS(美国Hyclone 公司);jetPRIME®试剂(法国Polyplus-transfection公司);胰蛋白酶、50×TAE 缓冲液、BCA蛋白浓度测定试剂盒、RIPA裂解液、Tris-HCl pH 8.8、Tris-HCl pH 6.8、青霉素、链霉素(上海碧云天公司)。
1.1.4主要仪器 Heraeus CO2恒温培养箱(德国Heraeus公司);FlexCycler多功能PCR仪(德国Jena公司);生物安全柜、电泳仪(上海天能科技有限公司);TS100型倒置显微镜(日本Nikon公司);酶标仪(上海科华实验系统有限公司)。
1.2 方法
1.2.1免疫组化 收集正常子宫内膜组织及EC组织,组织石蜡切片脱蜡后,经微波炉修复表面抗原、3%H2O2封闭内源性过氧化酶、山羊血清封闭,加一抗:NLRC5抗体、Beclin1抗体、LC3抗体,4 ℃过夜,复温后滴加与一抗相应种属的二抗(HRP标记),室温孵育50 min,滴加链亲和素—过氧化物酶溶液,室温孵育10 min,滴加新鲜配制的DAB混合染液,室温避光染色10 min,显微镜下观察颜色。每组标本随机选取若干个目的区域,通过Image-Pro-Plus 6.0分析系统分别计算各组样本中NLRC5、Beclin1、LC3着色阳性面积百分比(%),取均值进行比较。
1.2.2Western blot法检测蛋白表达 RIPA裂解液提取组织及细胞总蛋白,BCA法定量后,按10 μl/孔的量加样、电泳、转膜。转膜结束后,5%脱脂奶粉室温封闭1 h,TBST洗膜3次,每次10 min。孵一抗:各蛋白抗体分别参考抗体说明书进行操作,4 ℃ 孵育过夜,TBST洗膜3次,每次10 min。孵二抗:相应二抗室温孵育1 h,TBST洗膜3次,每次10 min。ECL发光、显影,以β-actin为内参,分析各指标的相对表达量。
1.2.3qRT-PCR法检测mRNA水平 收集转染后的细胞,按TRIzol试剂说明书提取总RNA,测RNA的OD260 mm/OD280 mm比值及浓度,再以RNA为模板逆转录成cDNA。采用SYBR Green试剂盒进行qRT-PCR,每组样本应重复检测3次。GADPH引物序列上游引物:5′-GGTTGAGCAGGTACTTT-3′;下游引物:5′-AGCAAGAGCACAAGAGGAAG-3′。NLRC5引物序列上游引物:5′-CTATCAACTGCCCTTCCACAAT-3′;下游引物:5′-TCTCTATCTGCCCACAGCCTAC-3′。Beclin1引物序列上游引物:5′-AGCACCATGCAGGTGAGCTT-3′;下游引物:5′-TGACACGGTCCAGGATCTTG-3′。LC3引物序列上游引物:5′-AGCAGCATCCAACCAAAATC-3′;下游引物:5′-CTGTGTCCGTTCACCAACAG-3′。以上引物均由南京金斯瑞生物科技有限公司合成。
1.2.4CCK-8试剂盒检测细胞增殖情况 将转染24、48、72 h后的细胞接种在96孔板中(100 μl/孔),每孔2×103个细胞,每组3个复孔,待细胞贴壁后每孔中加10 μl的CCK-8溶液,置于培养箱内继续孵育4 h,用酶标仪测定450 mm处吸光度值测定各组细胞的增殖情况,实验重复3次,以实验测得的均值为实验结果。
1.2.5质粒构建 NLRC5质粒(其序列如下:上游引物:5 -CCGGAATTCCGGATGGCCAGGAAGCTGGA-3,下游引物:5-GGGATCCCGTCACCTGAGTGTCTTCCCA-3)由武汉赛维尔生物科技有限公司构建,经鉴定证实构建成功。
1.2.6细胞转染 当细胞长满时接种于6孔板中,继续培养细胞至汇合度为70%时,使用jetPRIME®转染试剂并参考其说明书进行细胞转染。将2 μg NLRC5质粒稀释至200 μl缓冲液中,通过上下吸管混合。加入4 μl jetPRIME®转染试剂,涡旋10 s,低速离心数秒,在室温孵育10~15 min。取出6孔板,每孔中加入2 ml含10%胎牛血清和1%青霉素及链霉素的DMEM培养基,将转染混合物添加至含10%胎牛血清和1%青霉素及链霉素的DMEM培养基的细胞中。转染后24 h用含10%胎牛血清和1%青霉素及链霉素的DMEM培养基替换转染培养基,于37 ℃、5%CO2培养箱中继续培养至48 h,用于后续检测。
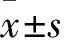
2 结果
2.1 子宫内膜组织与EC组织中NLRC5及自噬因子表达收集EC组织标本和正常子宫内膜标本各20例,免疫组化结果显示,与正常子宫内膜组织相比,NLRC5蛋白在EC组织中表达相对较低,而自噬相关蛋白Beclin1、LC3在EC组织中表达相对较高,见图1。同时Western blot结果分析显示EC组织与正常子宫内膜相比, NLRC5蛋白表达相对较低,而自噬相关蛋白Beclin1、LC3相对较高,见图2,各指标组间差异有统计学意义,见表1。
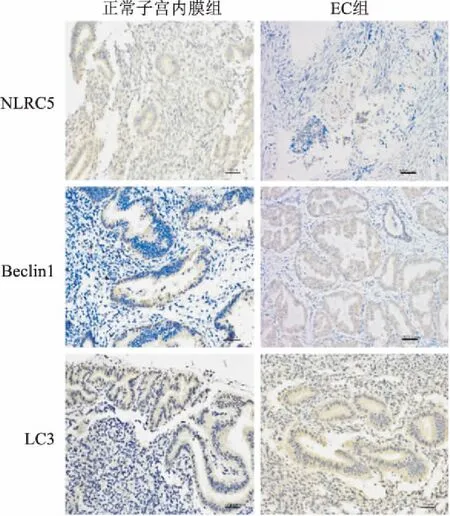
图1 正常子宫内膜组与EC组NLRC5、Beclin1、LC3免疫组化 ×200
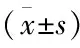
表1 正常子宫内膜组与EC组NLRC5、Beclin1、LC3蛋白表达水平
2.2 NLRC5对AN3CA细胞自噬的作用转染NLRC5质粒后通过qRT-PCR和Western blot检测,转染组与未转染组相比,自噬蛋白Beclin1、LC3的蛋白表达水平降低(图3、4);各指标组间差异有统计学意义(表2、3)。
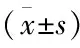
表2 未转染组与转染组NLRC5、Beclin1、LC3蛋白表达水平
2.3 NLRC5对EC细胞(AN3CA)细胞增殖的影响转染NLRC5质粒后,转染24、48、72 h后分别用CCK-8法检测两组细胞的增殖情况,结果显示转染NLRC5质粒组与未转染组相比,转染组细胞增殖明显增加,见图5。各指标组间差异有统计学意义,见表4。
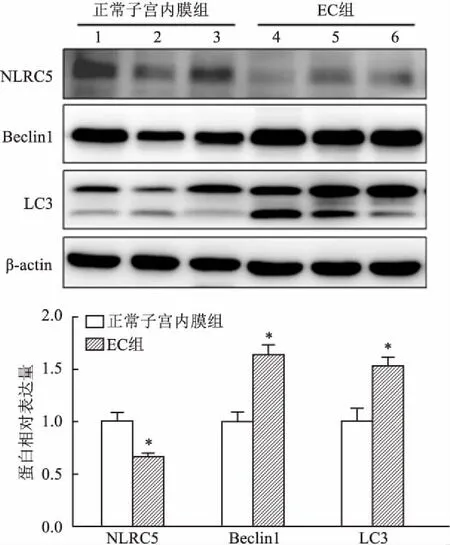
图2 Western blot法检测组织蛋白表达情况
1、2、3:正常子宫内膜标本;4、5、6:EC标本;与正常子宫内膜组比较:*P<0.05
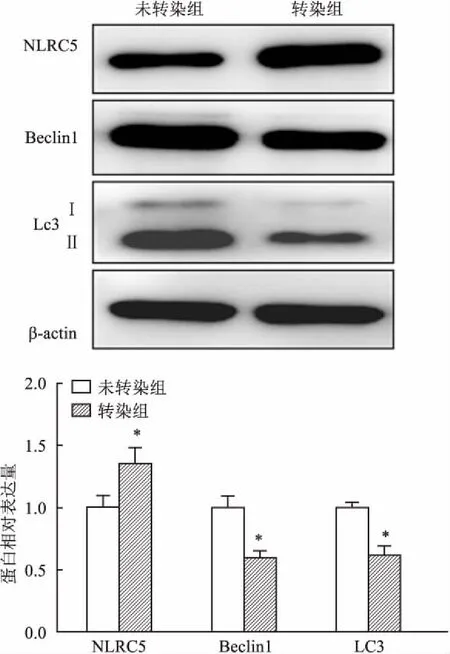
图3 Western blot法检测过表达NLRC5细胞蛋白表达情况
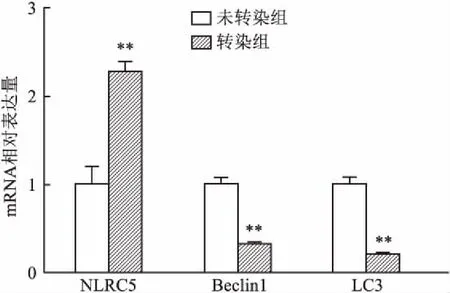
图4 实时定量PCR检测过表达NLRC5细胞中NLRC5、Beclin 1、LC3 mRNA水平
表3 未转染组与转染组NLRC5、Beclin1、LC3 mRNA表达水平

图5 CCK-8检测细胞增殖情况
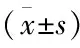
表4 CCK-8检测未转染组与转染组AN3CA细胞活力
2.4 NLRC5促进AN3CA细胞增殖的机制本实验分四组,两组转染组和两组未转染组,其中一组转染组和未转染组在转染NLRC5质粒24 h后加自噬激动剂雷帕霉素(50 nmol/L),继续培养24、48 h后分别用CCK-8法检测4组细胞的增殖情况,结果显示,转染NLRC5质粒组与未转染NLRC5质粒组相比,细胞增殖明显增加(P<0.05);转染NLRC5质粒后同时加雷帕霉素组与只转染NLRC5质粒组相比,细胞自噬水平升高,但细胞增殖明显下降(P<0.05),见图6。转染组与未转染组比较,0、24、48 h的F值分别为17.72、80.73、145.8,与转染同时加雷帕霉素组比较,24 h、48 h的F值分别为13.06、17.62,各指标组间差异有统计学意义,见表5。
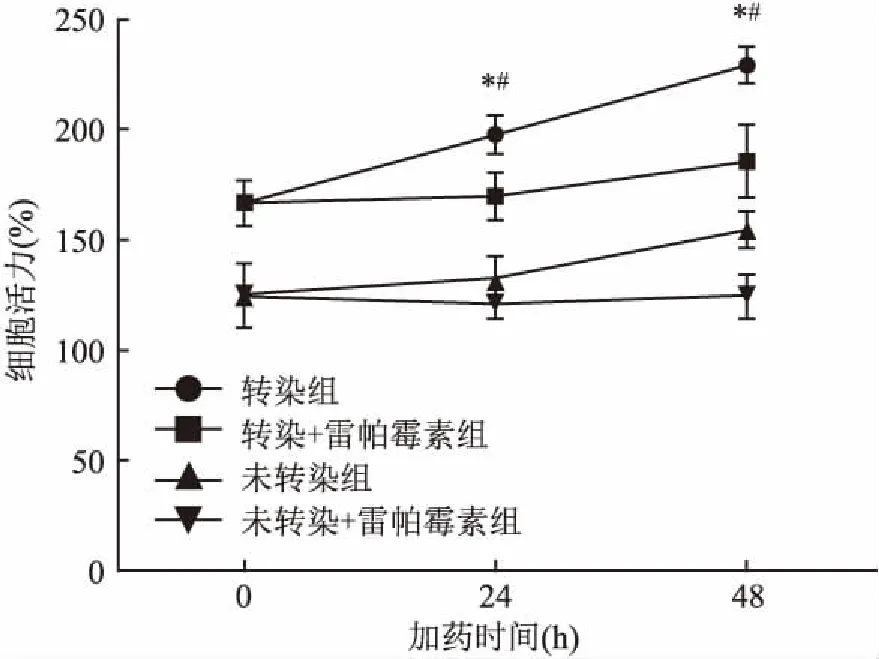
图6 CCK-8检测细胞增殖情况
与未转染组比较:*P<0.05;与转染同时加雷帕霉素组比较:#P<0.05
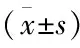
表5 CCK-8检测各组AN3CA细胞活力
与未转染组比较:*P<0.05;与转染+雷帕霉素组比较:#P<0.05
3 讨论
EC是女性生殖系统中常见的三大恶性肿瘤之一,位居女性常见癌症的第六位。据统计,在全球范围内每年有超过20万的EC新增病例,其发病率和死亡率逐年增高,并且呈年轻化趋势,严重危害女性的身心健康[10]。但是,其影响机制尚不明确。
NLRC5是2010年新发现的NLRs样受体家族中的受体之一[3]。NLRC5在多种肿瘤中表达相对偏低,而NLRC5在肝细胞癌、结直肠癌以及脑部肿瘤中相对偏高[11]。Peng et al[12]发现NLRC5可以促进肝癌细胞增殖、迁移和侵袭能力。但是NLRC5是否可能参与EC的发生发展,目前尚不清楚。因此,本实验主要研究NLRC5的表达变化,观察其是否可能参与EC发生发展,并初步探讨其可能的作用机制。为观察NLRC5在EC中的表达,本实验通过收集EC组织和正常子宫内膜组织,免疫组化及Western blot结果显示,与正常子宫内膜组织相比,在EC中,NLRC5蛋白表达是下调的。为了证实NLRC5与EC间的关系,本研究CCK-8结果显示转染NLRC5质粒组与未转染组相比,转染组细胞增殖明显增加。综上所述,NLRC5可能促进EC细胞的增殖,但其如何影响EC细胞增殖,机制尚不明确。
近年来,国内外学者发现,自噬参与NLRs的调节过程[5-6]。自噬是一种保守的溶酶体降解途径,在此过程中细胞内物质被降解和再循环[13]。自噬已被证实对肿瘤的发生发展发挥着重要的作用,但结论仍存在争议,最初认为自噬是肿瘤抑制机制,在乳腺癌、卵巢癌、前列腺癌细胞中自噬抑制肿瘤发生[14]。但是,在肝癌早期阶段,自噬可破坏肿瘤组织以达到抑制肿瘤增殖的作用,当癌细胞剧增达到肿瘤晚期阶段时,自噬降解的受损细胞器又为肿瘤提供营养支持,使癌细胞不断繁殖[15]。因此自噬在癌症中的作用是复杂的,并且受背景条件的影响[13]。本实验免疫组化及Western blot结果显示EC组织与正常子宫内膜组织比较,在EC组织中自噬蛋白Beclin1、LC3的蛋白表达水平上调。那么自噬是否参与NLRC5的调节,目前尚不清楚。为探究NLRC5是否可能通过调控自噬在EC中发挥作用,选择AN3CAEC细胞株作为体外实验的研究对象。通过qRT-PCR和Western blot检测结果显示转染NLRC5质粒组与未转染组相比,自噬蛋白Beclin1、LC3的蛋白表达水平下调。进一步研究该途径如何影响EC的作用,本研究CCK-8检测结果表明转染NLRC5质粒组与未转染NLRC5质粒组相比,细胞增殖明显增加;转染NLRC5质粒后同时加雷帕霉素组与只转染NLRC5质粒组相比,细胞自噬水平升高,但细胞增殖明显下降。以上研究结果表明NLRC5可能通过抑制自噬进而促进EC细胞的增殖。
综上所述,本研究结果表明在EC组织标本中NLRC5的蛋白表达水平下调,而自噬相关蛋白Beclin1、LC3的蛋白表达水平上调;过表达NLRC5后,EC细胞自噬水平下降,但EC细胞增殖升高;相反,过表达NLRC5后,提高自噬水平,细胞增殖反而下降。因此,NLRC5可能通过抑制自噬促进EC细胞增殖,NLRC5可能成为EC治疗的新靶点。

