急性脑梗死病情及预后与血清淀粉样蛋白A、触珠蛋白水平的关系
宋明香 蒋敏海
[摘 要] 目的 探讨血清淀粉样蛋白A(serum amyloid A,SAA)、触珠蛋白(haptoglobin,HP)水平与急性脑梗死病情严重程度及预后的关系。方法 选取急性脑梗死患者574例,检测血清中SAA和HP的水平。采用美国国立卫生研究院卒中量表(national institutes of health stroke scale,NIHSS)評分将脑梗死患者入院时严重程度分为轻度组(2分);探讨SAA、HP水平与脑梗死预后的关系。结果 不同严重程度的脑梗死患者SAA水平有差异,重度组SAA水平高于中度组、轻度组(P<0.05),中度组SAA水平高于轻度组(P0.05)。良好预后组与不良预后组的年龄、吸烟史及SSA水平差异均有统计学意义(均P0.05)。多因素Logistic回归分析显示年龄、吸烟史、SAA水平是急性脑梗死患者3个月预后不良的独立危险因素(均P<0.05)。结论 SAA水平、年龄与吸烟史是急性脑梗死患者3个月预后不良的独立危险因素;SAA水平可以考虑作为急性脑梗死病情严重程度的预测指标。
[关键词] 急性脑梗死;血清淀粉样蛋白A;触珠蛋白;病情严重程度;预后
中图分类号:R743.3
文献标识码:A
文章编号:1009-816X(2019)03-0231-04
[Abstract] Objective To investigate the correlation of serum amyloid A (SAA) and haptoglobin (HP) levels with the severity and prognosis of acute cerebral infarction. Methods 574 patients with acute cerebral infarction were enrolled in the study. The levels of SAA and HP in serum were measured by dual-ray immunoturbidimetry. The National Institutes of Health Stroke Scale (NIHSS) score was used to divided the patients into mild (2 points). The correlation of SAA and Hp levels with prognosis of acute cerebral infarction was investigated. Results The SAA levels of patients with different severity of cerebral infarction were different. The SAA level in the severe group was higher than that in the moderate group and the mild group (P0.05). There was significant difference in age, smoking history and SAA between the good prognosis group and the poor prognosis group (P0.05). Multivariate logistic regression analysis showed that age, smoking history and SAA level are independent risk factors for poor outcome in patients with acute cerebral infarction at 3 months (P< 0.05). Conclusions SAA level, age and smoking history are independent risk factors for poor outcome of patients with acute cerebral infarction at 3 months, and the level of SAA can be used as a predictor of severity of acute cerebral infarction.
[Key words] Acute cerebral infarction; Serum amyloid A; Haptoglobin; Severity; Prognosis
急性脑梗死是脑卒中最常见的类型,约占我国脑卒中的69.6%~70.8%,往往发病突然,具有发病率高、致残率高、复发率高的特点[1,2]。早期评估患者病情严重程度,进行及时合理的治疗,最大程度保护患者的神经功能,降低不良预后,是救治急性脑梗死的根本目标。如何正确评估急性脑梗死病情严重度及可能预后,仍缺乏有效的血清学指标。近年来的研究显示,血清淀粉样蛋白A(SAA)、触珠蛋白(HP)水平与急性脑梗死发生风险及严重程度可能相关[3,4]。本研究选取明确诊断的脑梗死患者,测定血清SAA、HP水平,探究SAA、HP水平与急性脑梗死的病情严重程度以及预后的相关性,以期对患者的病情作出准确的评估,指导治疗。
1 资料与方法
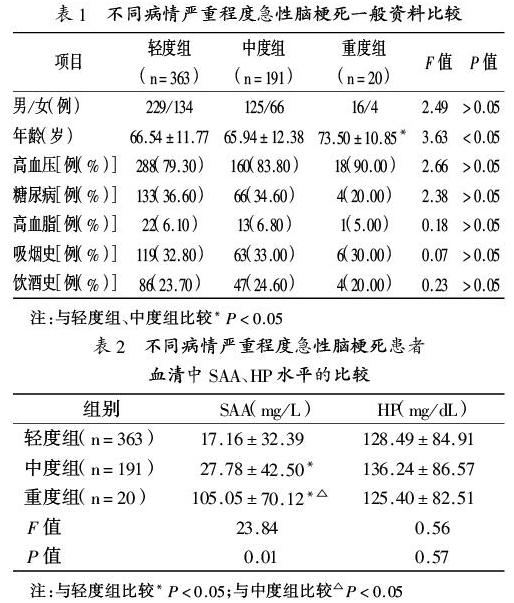
1.1 一般资料:选取2016年1月至2017年4月在本院神经内科住院的急性脑梗死患者574例,均为首次发病,均经过头颅MRI或CT确诊,其中男370例,女204例,年龄26~85岁,平均(66.58±12.00)岁。诊断标准:急性脑梗死的诊断符合《中国急性缺血性脑卒中诊治指南2014》的诊断标准,并经头颅MRI或CT证实责任病灶。所有患者均按照指南行规范化常规治疗。排除标准:(1)溶栓治疗或动脉取栓治疗;(2)脑出血或蛛网膜下腔出血;(3)心源性或其他原因的脑栓塞;(4)自身免疫性疾病、甲状腺功能异常;(5)肝硬化、肾功能不全或其他原因肝肾功能不全;(6)恶性肿瘤、结核,近期感染、创伤、手术。根据NIHSS评分将脑梗死入院时严重程度分为轻度组(<5分)、中度组(5~15分)、重度组(≥16分)[5]。轻度组363例,其中男229例,女134例,年龄30~85岁,平均(66.54±11.77)岁;中度组191例,其中男125例,女66例,年龄26~85岁,平均(65.94±12.38)岁;重度组20例,其中男16例,女4例,年龄45~85岁,平均(73.50±10.85)岁。
1.2 方法:
1.2.1 标本采集及检测方法:所有患者在入院后次日清晨使用EDTA抗凝管抽取空腹静脉血3mL,采用双光径免疫浊度分析仪(无锡市光明浊度仪厂)对血清中SAA和HP水平进行检测。
1.2.2 神经功能缺损程度评估:入院后采集患者基本病史,包括性別、年龄、高血压、糖尿病、高脂血症、吸烟史、饮酒史等。采用NIHSS评分评估急性脑梗死患者入院时病情严重程度。根据NIHSS评分将脑梗死入院时严重程度分为轻度组(<5分)、中度组(5~15分)、重度组(≥16分)[5]。
1.2.3 急性脑梗死预后评估:出院后随访3个月,用mRS评分评估急性脑梗死患者3个月预后,根据mRS评分将患者分为良好预后组(≤2分)和不良预后组(>2分)[6]。所有急性脑梗死患者的mRS评分均由经过统一培训医师收集记录。
1.3 统计学处理:采用SPSS22.0版统计软件,计量资料以(x -±s)表示,多组间比较采用Brown-Forsythe检验,组间两两比较采用非参数检验(独立样本Kruskal-wallis H检验);计数资料以百分率表示,组间比较采用χ2检验。采用单因素分析和多因素Logistic回归分析急性脑梗死患者3个月预后的独立危险因素,P<0.05为差异有统计学意义。
2 结果
2.1 不同病情严重程度急性脑梗死一般资料的比较:见表1。
2.2 不同病情严重程度急性脑梗死患者血清中SAA、HP水平的比较:重度组、中度组、轻度组三组的SAA水平差异有统计学意义(P<0.05),见表2。
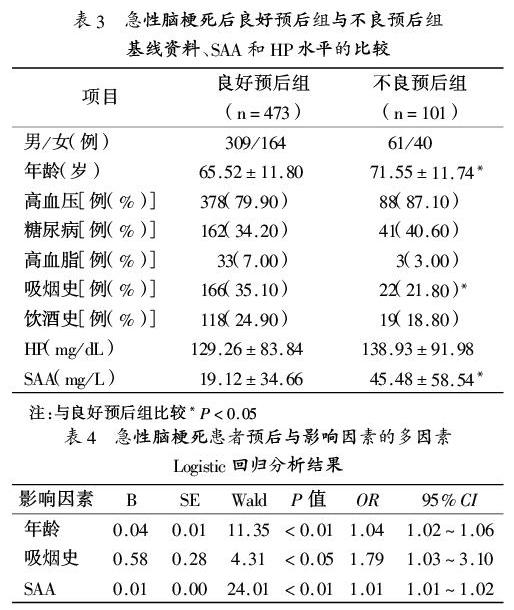
2.3 急性脑梗死良好预后组与不良预后组基线资料、SAA和HP水平的比较:3个月后不良预后组SAA水平明显高于良好预后组,不良预后组平均年龄更大,吸烟可能导致预后不良(均P<0.01),见表3。
2.4 急性脑梗死患者预后与影响因素的多因素Logistic回归分析:以年龄、吸烟史、SAA水平作为自变量,以是否预后不良作为因变量,将上述有意义的因素纳入Logistic回归分析中,结果显示,年龄、吸烟史、SAA水平是急性脑梗死患者3个月预后不良的独立危险因素(均P<0.05),预测值总体百分比83.10%,显示良好的预测效果,见表4。
3 讨论
SAA可以通过替换高密度脂蛋白胆固醇(HDL-C)上的载脂蛋白A-1,形成SAA/HDL-C复合体,导致HDL的结构改变和逆转运胆固醇的功能受损,从而使巨噬细胞中胆固醇的清除率下降,引起胆固醇的累积,促使动脉粥样硬化斑块(atherosclerosis,AS)的形成及进展[7],增加了斑块的不稳定性[3],是导致易损斑块的形成及脑梗死发生的重要原因。SAA还可以作为巨噬细胞合成和分泌细胞因子的信号,导致局部炎症反应增强[8],炎症在AS的发病机制中有根本性的作用。SAA也可以与低密度脂蛋白(LDL)相结合,形成SAA/LDL复合体,诱导内皮细胞黏附因子产生,促使巨噬细胞与血管内膜结合,形成早期动脉粥样硬化斑块[3]。AS是脑卒中的病理生理学基础,炎症反应和氧化应激是动脉粥样硬化发生、发展的重要机制[9]。ICARAS研究[7]通过对1268例患者进行6~9个月连续颈动脉超声检查,发现SAA的炎症参数的变化与6至9个月期间颈动脉狭窄程度的变化相关,证实了炎症与快速进展性颈动脉粥样硬化的形态学特征之间的密切时间相关性,表明SAA可以作为动脉粥样硬化进展及不稳定斑块的标志物,预测脑梗死的发生风险。本研究根据患者入院时的NIHSS评分将患者分为轻度组、中度组、重度组,并测定SAA水平,发现重度组SAA水平高于中度组、轻度组(P<0.05),中度组SAA水平高于轻度组。
Hp是一种急性期血浆蛋白和重要的生理抗氧化剂,与血红蛋白分子结合,形成血红蛋白-触珠蛋白(Hb-Hp)复合物[11]。复合物通过CD163清道夫受体被组织巨噬细胞内吞清除,抑制氧化应激和血管炎症,调节血管健康。在人类中,Hp基因具有三种常见的遗传类型,Hp1-1,Hp1-2和Hp2-2[11,12]。Hp1-1和Hp1-2蛋白可以作为清除氧化还原活性游离血红蛋白的抗炎分子,并可能在动脉粥样硬化斑块内出血(Intraplaque hemorrhage,IPH)部位诱导产生抗炎细胞因子[13]。Hb-HP2-2复合物对组织巨噬细胞的亲和力最低,导致血红蛋白摄取率降低和氧化负荷增加[11,12]。血浆中Hb-HP2-2复合物清除减少,可与高密度脂蛋白结合,复合物的氧化还原活性导致脂蛋白结构调整及功能修饰,抑制了HDL的胆固醇逆向转运能力,引起脂质代谢紊乱,促发动脉粥样硬化及炎症反应[14]。IPH是游离血红蛋白的来源,是导致斑块生长和不稳定,引起诸如中风等不良临床结果的关键因素。Marvasti等[15]对HP不同基因型人群的颈动脉进行MRI检测,随访期为两年,发现Hp2-2基因型的患者颈动脉IPH的患病率显著增高。在本研究中我们未发现HP水平与急性脑梗死病情严重程度及预后具有相关性。可能原因为Hp各型的人群分布存在着明显的种族差异和地域差异[16],本研究未对患者进行HP基因检测。
综述所述,SAA水平不仅可以预测急性脑梗死的发生风险,还可作为脑梗死后病情严重程度及3个月不良预后的有效评估指标,可作为早期诊断、治疗与干预及改善急性脑梗死预后有参考价值的指标之一。仍存在不足之处,比如重度组病例数较少,重度组年龄较轻度组、中度组高,可能对重度组比较结果有影响,后期将纳入更多病例数进一步研究。
参考文献
[1]中华医学会神经病学分会,中华医学会神经病学分会脑血管病学组.中国急性缺血性脑卒中诊治指南2018[J].中华神经科杂志,2018,51(9):666-682.
[2]万薇,邓秋迎.急性脑卒中患者分诊效果的比较[J].国际护理学杂志,2016,35(15):2073-2075.
[3]贾文辉,胡风云,陈文军,等.血清淀粉样蛋白A与大动脉粥样硬化型脑梗死病人颈动脉斑块稳定性的相关性研究[J].中西医结合心脑血管病雜志,2016,14(14):1664-1666.
[4]Brea D, Sobrino T, Blanco M, et al. Usefulness of haptoglobin and serum amyloid A proteins as biomarkers for atherothrombotic ischemic stroke diagnosis confirmation[J]. Atherosclerosis,2009,205(2):561-567.
[5]周发为,杨溢.急性缺血性脑梗死患者缺血修饰清蛋白、超敏C反应蛋白水平及其对预后的价值研究[J].中国全科医学,2016,19(16):1891-1894.
[6]李雪微,张雯,李笑笑,等.急性缺血性卒中病人mRS评分与中医证型的相关性研究[J]. 中西医结合心脑血管病杂志,2018,16(19):2879-2882.
[7]Schillinger M, Exner M, Mlekusch W, et al. Inflammation and carotid artery-risk for atherosclerosis study (ICARAS)[J]. Circulation,2005,111(17):2203-2209.
[8]Kisilevsky R, Manley PN. Acute-phase serum amyloid A: perspectives on its physiological and pathological roles[J]. Amyloid,2012,19(1):5-14.
[9]安建中,洪蕾.动脉粥样硬化成因的分子机制研究进展[J].中国心血管病研究,2018,16(9):778-781.
[10]Rallidis LS, Vikelis M, Panagiotakos DB, et al. Inflammatory markers and in-hospital mortality in acute ischemic stroke[J]. Atherosclerosis,2006,189(1):193-197.
[11]Nielsen MJ, Moestrup SK. Receptor targeting of hemoglobin mediated by the haptoglobins: roles beyond heme scavenging[J]. Blood,2009,114(4):764-771.
[12]Olsson MG, Allhorn M, Bülow L, et al. Pathological conditions involving extracellular hemoglobin: molecular mechanisms, clinical significance, and novel therapeutic opportunities for α(1)-microglobulin[J]. Antioxid. Redox Signal,2012,17(5):813-846.
[13]Levy AP, Hochberg I, Jablonski K, et al. Haptoglobin phenotype is an independent risk factor for cardiovascular disease in individuals with diabetes: the Strong Heart Study[J]. J Am Coll Cardiol,2002,40(11):1984-1990.
[14]Watanabe J, Grijalva V, Hama S, et al. Hemoglobin and its scavenger protein haptoglobin associate with apoA-1-containing particles and influence the inflammatory properties and function of high density lipoprotein[J]. J Biol Chem,2009,284(27):18292-18301.
[15]Marvasti TB, Moody AR, Singh N, et al. Haptoglobin 2-2 genotype is associated with presence and progression of MRI depicted atherosclerotic intraplaque hemorrhage[J]. IJC Heart & Vasculature,2018,18(3):96-100.
[16]李生斌.人类DNA遗传标志[M].北京,人民卫生出版社,2000:35-37.
(收稿日期:2019-2-20)

