miR-145-5p靶向FGF5对缺血/再灌注损伤诱导的神经细胞凋亡和氧化应激的调控作用
闫海清,岳学静,贵永堃,任瑞芳,王昊亮,赵 君,张 平
缺血性脑卒中(ischemic stroke,IS)是全球最具破坏性的神经系统疾病之一,也是全球排名第三的死因。IS可能导致终身残疾。此外,中国每年约有250万人面临中风风险,约100万人可能死于中风或引发的后遗症[1]。脑缺血再灌注(I/R)的特点是最初限制脑的血液供应,然后恢复血流和复氧[2]。然而,IR所致的脑血管功能障碍成为一个严重的临床问题。在I/R过程中,可能导致神经损伤,尤其是发生缺血性中风的患者[3]。导致脑I/R损伤的确切发病机制尚不完全清楚,因此寻找新的有效预防脑I/R损伤的有效措施,对预防IS具有重要意义。大多数成熟的miRNAs通过结合目标mRNAs的3‘-非翻译区(3’-UTR)来改变mRNA的降解或翻译。研究[4]表明,多种miRNAs包括miR-21、miR-200和miR-497可以作为IS潜在的治疗靶点。这些miRNAs似乎通过改变脑缺血损伤后大脑皮层高表达的关键信号元件而参与脑I/R损伤。最近的研究[5]表明miR-145-5p受长链非编码RNA SNHG14调控进而参与脑梗塞的发展,但miR-145-5p下游靶点仍不清楚。FGF5又称巢蛋白(Nestin),是小鼠拟胚体外胚层主要的标志蛋白,是胚胎发育和神经发育中的重要蛋白[6]。该研究采用氧-葡萄糖剥夺/复氧(oxygen-glucose deprivation and reoxygenation,OGD/R)细胞模型作为脑I/R损伤的体外模型。在使用miR-145-5p抑制剂后,检测FGF5和其他相关蛋白介导的神经凋亡和氧化应激损伤的差异,有助于更好地理解脑I/R损伤,并将有助于制定新的改善I/R损伤临床治疗的策略。
1 材料与方法
1.1 细胞培养小鼠海马细胞系HT22来源于中国科学院(上海),在含10%胎牛血清、青霉素100 U/ml和链霉素100 μg/ml的高糖DMEM(美国Gibco公司)中培养。
1.2 OGD/R建立脑缺血/再灌注损伤细胞模型HT22细胞在37 ℃、5% CO2的无氧培养皿(美国赛默飞世尔公司)中培养,用无糖DMEM诱导培养HT22海马神经元,加1%O2、94%N2和5%CO2在37 ℃诱导缺氧缺糖(OGD)模拟局部缺血。OGD处理3 h后,用新鲜的正常培养基代替培养基,在通常条件下(95%空气和5% CO2,37 ℃),复氧12 h和24 h。对照组细胞不受OGD/R处理。
1.3 流式细胞术6孔板上接种HT22海马神经细胞,密度为2×105个/孔。按上述OGD/R方法处理细胞 6、12、24 h。收集待测细胞,4 ℃ PBS清洗3次,用1×Annexin V 结合溶液重悬细胞,制成密度约1×106个/ml的细胞悬液。取100 μl细胞悬液,然后用5 μl Annexin V-FITC,5 μl碘化丙啶(propidium iodide,PI)进行室温避光双染15 min,加入400 μl 1×Annexin V结合溶液。最后利用流式细胞仪对染色的细胞进行检测。完成检测后,用BD FACSuite 软件作图,并统计Q2+Q4区凋亡细胞的数目。
1.4 Western blotHT22细胞处理同上,用RIPA裂解缓冲液(上海碧云天生物技术研究所)裂解细胞,并用BCA试剂盒定量(上海碧云天生物技术研究所)。40 μg 总蛋白在10%的SDS-PAGE中进行电泳分离,转移至PVDF膜(美国Millipore公司)。用封闭液(5%脱脂牛奶TBST)室温孵育2 h,然后分别加入一抗在4 ℃过夜。次日,TBST清洗3次,然后,在室温下与HRP 偶联的二抗孵育1.5 h,最后,用ECL观察印迹并使用化学发光doc XRS成像系统检测印迹并拍照。并用Image J软件统计灰度值计算相对表达量。GAPDH作为内参。
1.5 氧化应激标志物检测细胞损伤是通过测量氧化应激标志物来测定的。简而言之,HT22细胞处理同上。丙二醛(MDA)、超氧化物歧化酶(SOD)和活性氧(ROS)测定试剂盒均采用商品化(南京建成生物技术研究所)MDA试剂盒、SOD试剂盒测定。乳酸脱氢酶(LDH)活性用LDH细胞毒性检测试剂盒(上海碧云天生物制剂有限公司)测定。按照说明书进行标准操作。MDA浓度表示为mmol/ml;SOD活性表示为U/ml;LDH活性表示为U/L。
1.6 荧光素酶报告实验将含有预测miR-145-5p结合位点或突变结合位点的FGF5的3'UTR进行PCR扩增并插入到pMIR-control载体中。在荧光素酶报告基因检测中,使用Lipofectamine 3000将miR-145-5p mimic和pcDNA3.0- FGF5野生型或突变型报告质粒转染到293T细胞。转染48 h后,采用双荧光素酶报告试验系统(美国Promega公司)按照制造商的说明测定荧光素酶活性。
1.7 细胞转染小干扰RNA (siRNA)靶向FGF5和对照siRNA购自上海Genechem公司,序列见表1。miR-145-5p inhibitor序列(CAGGTCAAAAGGGTCCTTAGGGA)由广州锐博生物有限公司合成。将上述小RNA插入pcDNA3.0质粒待转染。将HT 22细胞接种到六孔板,密度1×104细胞/ml每孔。正常条件培养24 h后,siFGF5和对照用脂质体3000转染到HT22细胞。挑选FGF5表达量低的细胞株,进行后续实验。
1.8 实时定量聚合酶链反应(qRT-PCR)使用TRIzol试剂(美国Invitrogen公司)从细胞中提取总RNA。用SuperScript逆转录酶试剂盒(南京诺唯赞生物科技有限公司)将等量的RNA反转录至cDNA。然后用SYBR Green PCR Master Mix (Vazyme)在Fast Real-time PCR 7300系统(美国赛默飞世尔公司)中分析miR-145-5p的mRNA水平。U6作为内参。结果采用2-ΔΔCt方法分析。

表1 基因序列
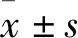
2 结果
2.1 OGD/R处理诱导神经细胞凋亡如图1A所示,流式检测凋亡细胞实验表明,与未进行OGD/R处理组(Normoxia组)比较(12.3%±2.1),OGD/R处理6 h、12 h、24 h组凋亡细胞(Q2+Q4)明显增加,凋亡率增加,分别为:(21.6%±2.6)%、(32.8%±3.2)%、(43.9%±3.8)%,差异有统计学意义(F=293.05,P<0.001)。Western blot检测抗凋亡蛋白Bcl-2,其表达量随OGD/R处理时间增加而减少,差异有统计学意义(F=54.06,P<0.001)。相反,凋亡蛋白Bax、caspase-3/9表达量随OGD/R处理时间增加而增加,差异有统计学意义(F=32.11,P<0.00;F=11.25,P<0.001;F=14.34,P<0.001)。说明随着OGD/R处理时间增加,HT22神经细胞凋亡被诱导,呈时间依赖特点。
2.2 OGD/R处理增加氧化应激水平如图2A所示,细胞上清LDH含量随OGD/R处理时间增加而增加(F=225.60,P<0.001),说明OGD/R处理诱导损伤导致细胞膜破裂释放LDH。ROS和MDA含量随OGD/R处理时间增加而增加,SOD明显减少,差异有统计学意义(F=300.51,P<0.001;F=218.79,P<0.001;F=535.28,P<0.001),见表2。说明OGD/R处理诱导HT22细胞产生严重氧化应激。
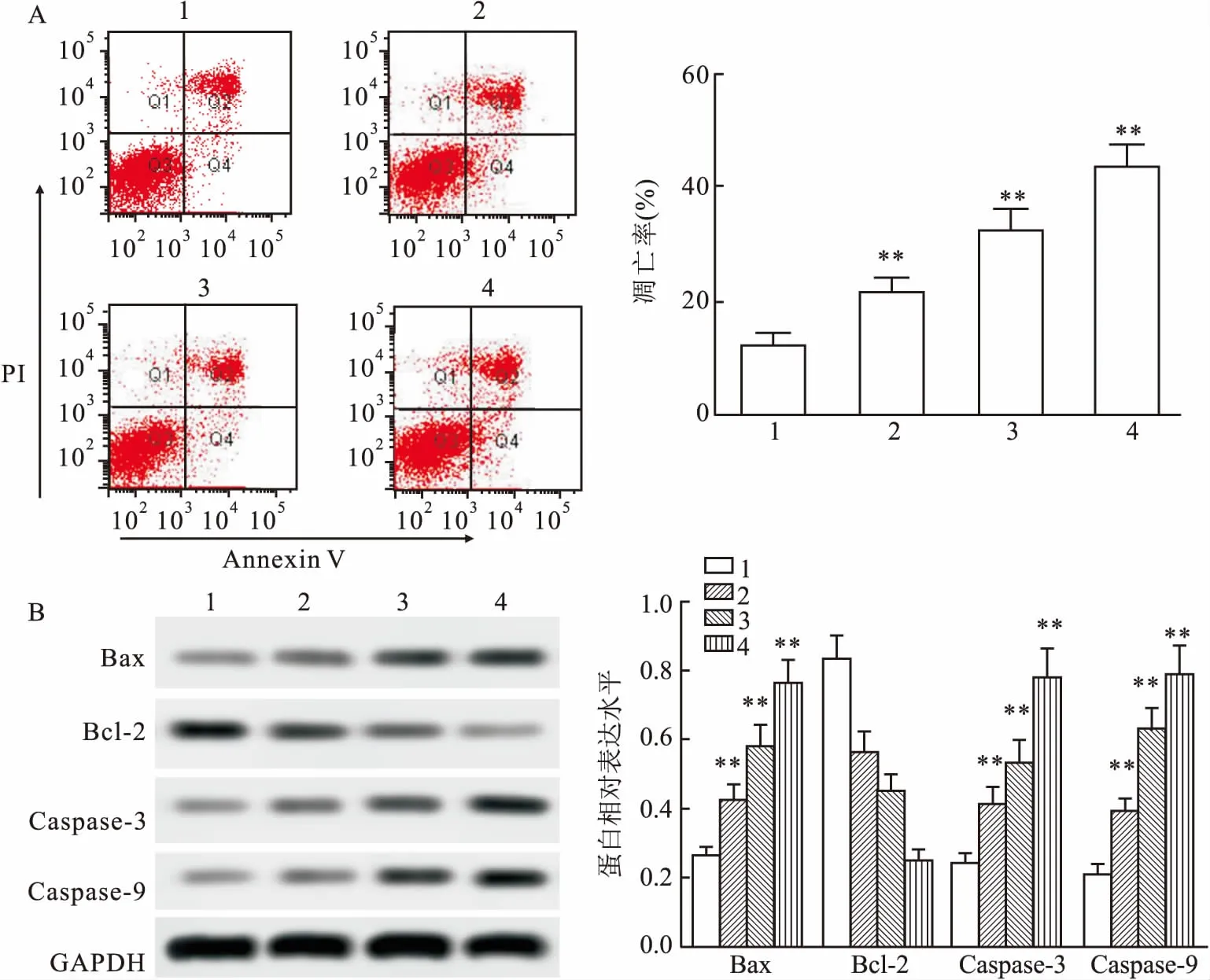
图1 OGD/R处理诱导神经细胞凋亡
A:流式检测细胞凋亡;B:WB检测凋亡相关蛋白表达;1:Normoxia组;2:OGD/R 6 h组;3:OGD/R 12 h组;4:OGD/R 24 h组;与Normoxia组比较:**P<0.01
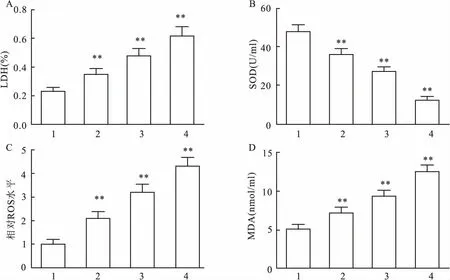
图2 OGD/R处理增加氧化应激水平
A:LDH含量;B:SOD含量;C: ROS含量;D:MDA含量;1:Normoxia组;2:OGD/R 6 h组;3:OGD/R 12 h组;4:OGD/R 24 h组;与Normoxia组比较:**P<0.01
2.3 OGD/R处理增加miR-145-5p表达量如图3A所示,与(Normoxia组)相比,OGD/R处理6 h、12 h、24 h组miR-145-5p表达量依次明显增加,差异有统计学意义(F=77.18,P<0.001)。如图3B所示,miR-145-5p inhibitor 可以降低OGD/R处理组miR-145-5p表达量,反面证明OGD/R处理诱导miR-145-5p表达量增加。说明miR-145-5p高表达与缺血再灌注损伤呈正相关性。
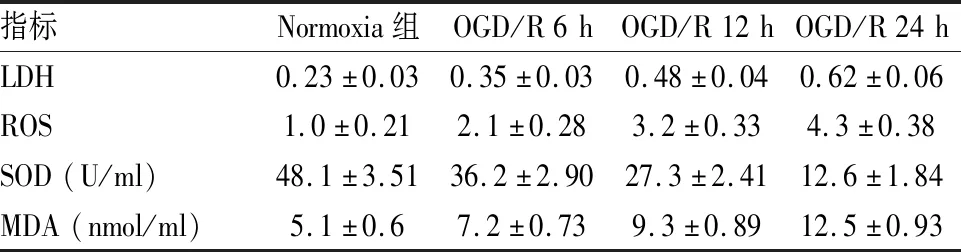
表2 氧化应激标志物水平
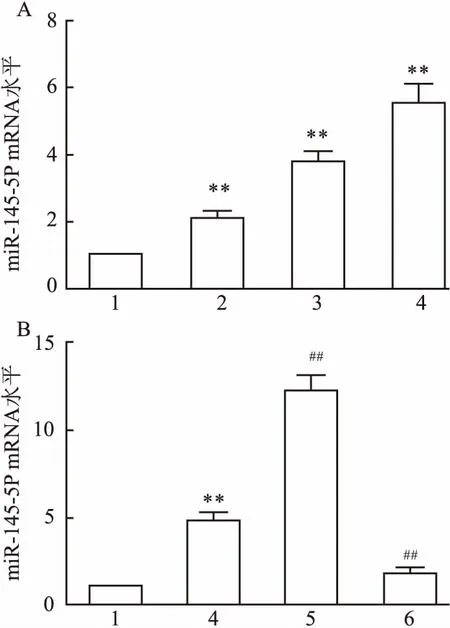
图3 OGD/R处理增加miR-145-5p表达量
A、B:miR-145-5p mRNA水平;与Normoxia组比较:**P<0.01;1:Normoxia组;2:OGD/R 6 h组;3:OGD/R 12 h组;4:OGD/R 24 h组;5:miR-145-5p mimic;6:miR-145-5p inhibitor;与OGD/R 24 h组比较:##P<0.01
2.4 miR-145-5p靶向负向调控FGF5表达如图4A所示,为了验证miR-145-5p与FGF5是否有靶向关系,本文采用使用 TargetScan 6.2进行了生物信息学分析,发现miR-145-5p与FGF5的3’-UTR有互补序列。荧光素酶报告实验表明, miR-145-5p降低了wt FGF5 3’-UTR转染细胞的荧光素酶活性,差异有统计学意义(F=36.31,P<0.001),但在细胞转染Mut FGF5 3’-UTR的细胞中荧光素酶活性没有降低。如图4B所示,与OGD/R相比,miR-145-5p inhibitor 明显上调FGF5表达,而siFGF5 明显下调FGF5表达差异有统计学意义(F=19.47,P<0.001)。结果表明,miR-145-5p通过直接结合FGF5的3’-UTR负调控FGF5基因的表达。
2.5 miR-145-5p inhibitor 减轻OGD/R诱导的HT22凋亡转染FGF5 siRNA和/或miR-145-5p inhibitor的HT22细胞进行OGD/R 24 h 处理。检测细胞凋亡情况如图5A所示:与OGD/R处理组相比,miR-145-5p inhibitor明显降低细胞凋亡率,FGF5siRNA明显增加细胞凋亡率,共转染相互抵消诱导(FGF5 siRNA)或抑制凋亡(miR-145-5p inhibitor)的能力,差异有统计学意义(F=75.05,P<0.001;F=15.29,P<0.001)。检测凋亡相关蛋白(图5B)进一步证实miR-145-5p inhibitor 减轻OGD/R诱导的HT22凋亡,FGF5 siRNA增加OGD/R诱导的HT22凋亡。
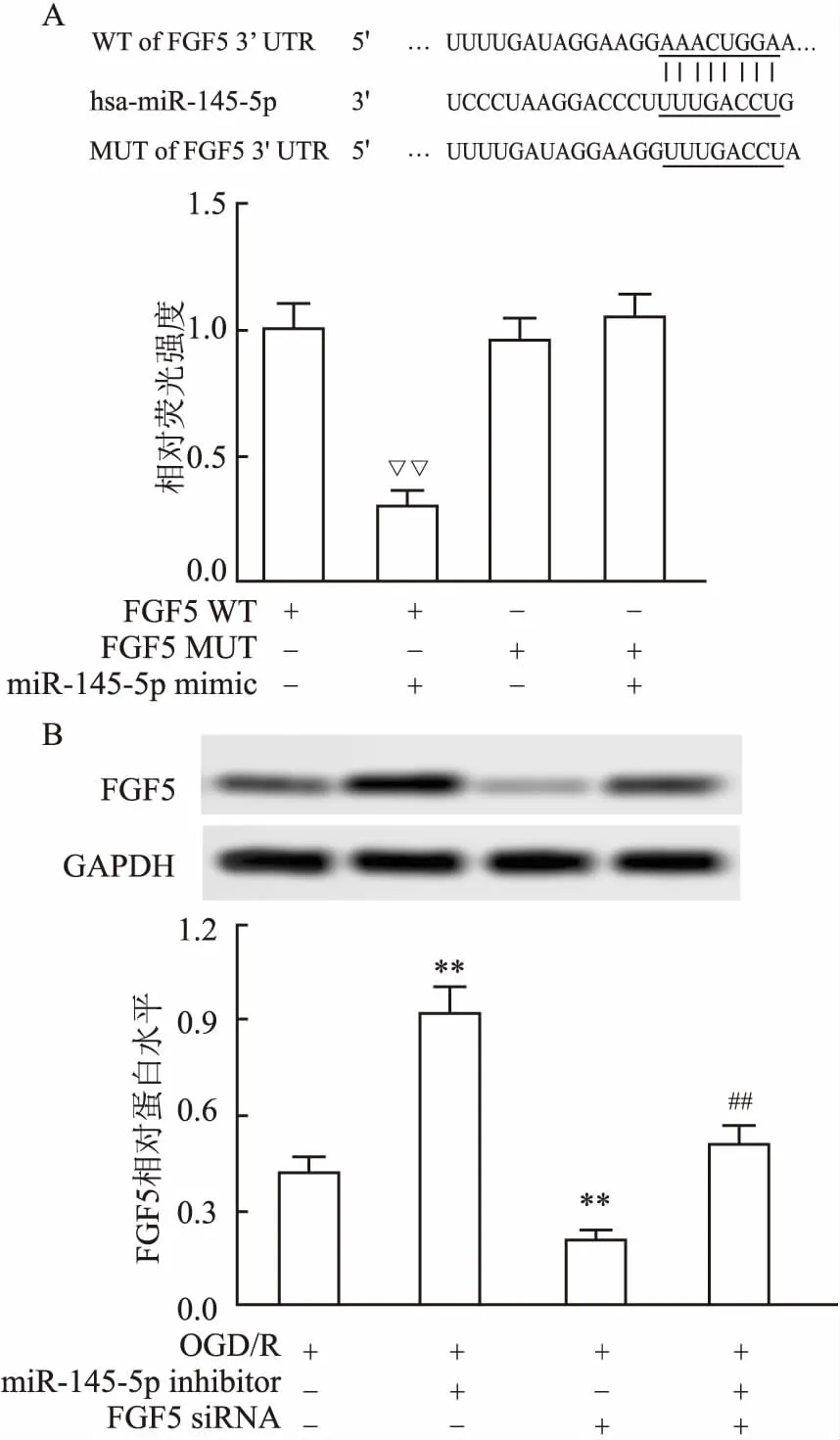
图4 miR-145-5p靶向负向调控FGF5表达
A:荧光素酶实验检测FGF5与miR-145-5p靶向关系;与FGF5 WT比较:▽▽P<0.01;B:FGF5蛋白表达;与OGD/R比较:**P<0.01;与OGD/R+ FGF5 siRNA比较:##P<0.01
2.6 miR-145-5p inhibitor 减轻OGD/R诱导的氧化应激损伤转染FGF5 siRNA和/或miR-145-5p inhibitor的HT22细胞进行OGD/R 24 h 处理。检测细胞氧化应激损伤情况如图6所示:miR-145-5p inhibitor 减轻OGD/R诱导的氧化应激损伤。与OGD/R处理组相比,miR-145-5p inhibitor 明显降低OGD/R诱导的细胞外LDH含量、ROS含量和MDA含量,FGF5 siRNA明显增加细细胞外LDH含量、ROS含量和MDA含量,差异有统计学意义(F=13.97,P<0.001;F=42.79,P<0.001;F=62.86,P<0.001);相反,miR-145-5p inhibitor 明显增加OGD/R诱导的SOD含量,FGF5 siRNA明显减少OGD/R诱导的SOD含量(F=103.55,P<0.001);共转染相互抵消诱导(FGF5 siRNA)或抑制氧化应激损伤(miR-145-5p inhibitor)的能力。
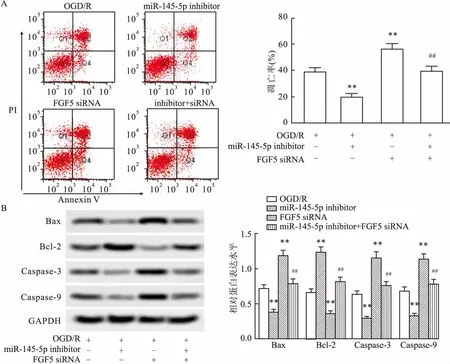
图5 miR-145-5p inhibitor 减轻OGD/R诱导的HT22凋亡
A:流式检测细胞凋亡;B: Western blot检测凋亡相关蛋白表达; 与OGD/R比较:**P<0.01;与OGD/R+ FGF5 siRNA比较:##P<0.01
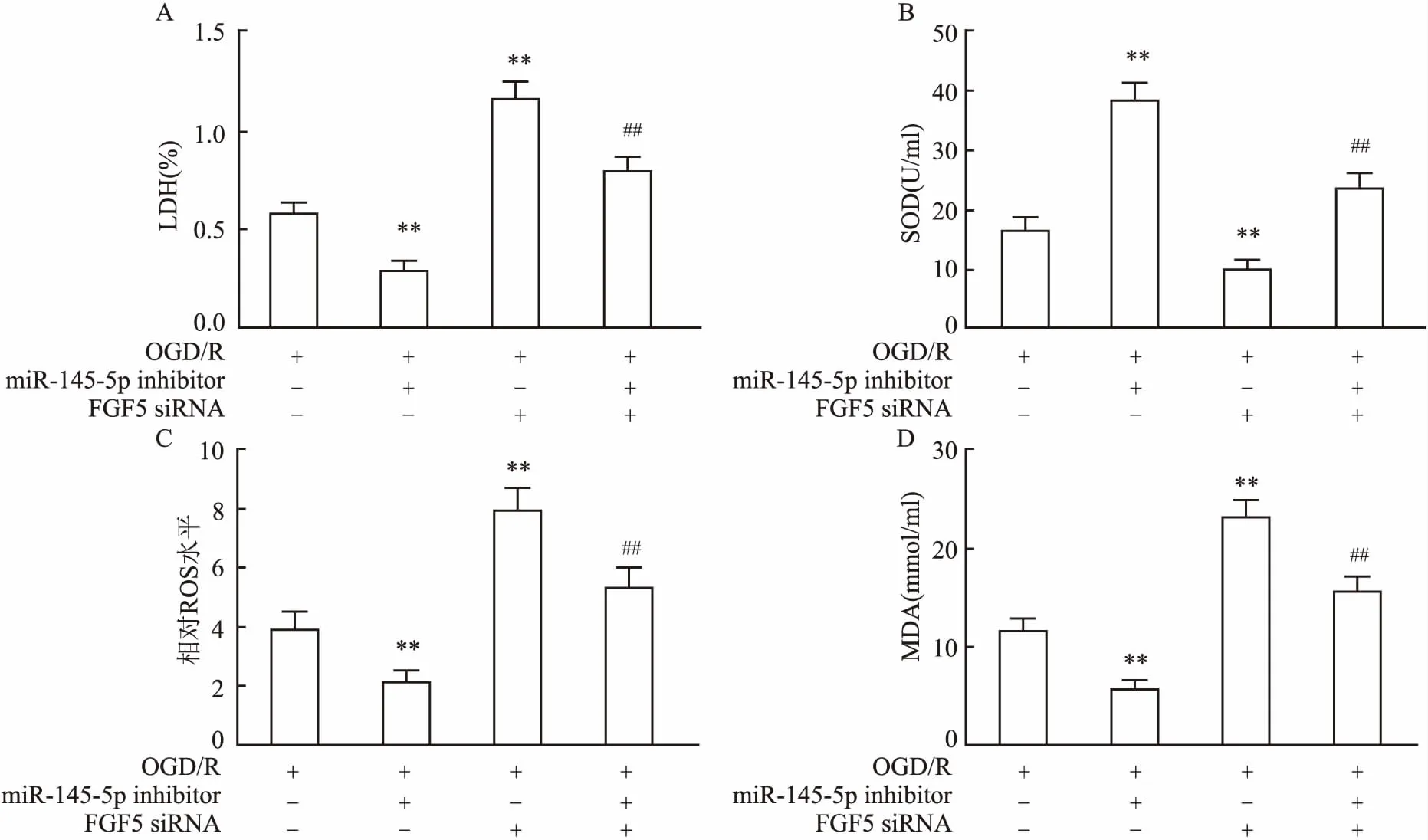
图6 miR-145-5p inhibitor 减轻OGD/R诱导的氧化应激损伤
3 讨论
I/R损伤是休克、中风或手术麻醉引起的严重的副反应[7]。I/R损伤除了导致组织损伤和功能障碍之外,还引起多种生物学变化,包括兴奋性毒性、细胞凋亡、钙超载和神经炎症[8]。尽管许多研究者致力于I/R的改善,但脑I/R损伤的复杂病理机制在很大程度上是未知的,因此严重阻碍临床有效治疗的发展。因此,寻求潜在、有前景的干预目标对开发治疗脑I/R损伤的有效治疗方案至关重要。根据前人研究结果,miR-145-5p有许多功能。例如,mir-145-5p靶向骨保素,加剧了由胶原诱发的关节炎的骨质流失[9];下调mir-145-5p增强了人类卵母细胞的成熟细胞活力[10];相反,基于它的损伤细胞的作用,在所种癌症中mir-145-5p其抗癌作用,包括抑制癌细胞增殖,转移,促进凋亡等[11]。基于上述研究,mir-145-5p可能在神经元细胞中起破坏作用。本文研究表明,在OGD/R诱导的脑I/R细胞模型中,mir-145-5p表达增强,且与处理时间呈正相关。本研究多组证据表明,mir-145-5p inhibitor可以抑制OGD/R诱导的HT22细胞凋亡和氧化应激损伤。
FGF5是纤维母细胞生长因子(FGF)家族的成员。FGF5基因与头发生长表型连锁[12]。最近研究发现,FGF5作为MiR-188-5p的靶点,在肝癌中起致癌作用[13]。FGF5参与血压,肝纤维化的调控[14]。此外,FGF5被报道具有促进人类扁桃体源性间充质干细胞增殖的作用[15]。与上述研究结果一致,本文研究结果表明在OGD/R诱导的HT22中,FGF5表达减少。同时本文证明了FGF5是mir-145-5p的下游靶点。mir-145-5p通过抑制FGF5表达从而增加OGD/R环境下HT22细胞的凋亡和损伤。这一结论可以被mir-145-5p inhibitor 和FGF5 siRNA的反作用证明。mir-145-5p inhibitor 转染HT22细胞后,FGF5蛋白表达增加,细胞凋亡和氧化应激损伤得到改善。而FGF5 siRNA转染HT22细胞后,结果完全相反。进一步说明mir-145-5p靶向FGF5调节I/R损伤诱导的细胞凋亡和氧化应激损伤。
本研究显示,mir-145-5p诱导细胞凋亡和氧化应激损伤是通过直接靶向结合FGF5基因,mir-145-5p直接绑定到3’UTR区域。在OGD/R体外细胞I/R模型中,增加FGF5表达(mir-145-5p inhibitor)可减少细胞凋亡和氧化应激损伤,而共同转染FGF5 siRNA 可回救减少的细胞凋亡和氧化应激损伤。结果表明,FGF5是mir-145-5p调控的关键分子。本文研究结果证实,mir-145-5p可能是I/R治疗的靶点,增加FGF5表达可能是有效的治疗策略。

