EZH2抑制剂DZNep对NK/T淋巴瘤细胞增殖、凋亡及细胞周期的影响
张 梓,夏莎莎,夏瑞祥
人NK/T淋巴瘤是一种特殊类型的非霍奇金淋巴瘤,以鼻和面部中线部位破坏为主要表现,且有明显的地域和种族易感性,多发于亚洲及南美洲,具有侵袭性高、预后差、复发率高等特点[1]。果蝇Zeste基因增强子人类同源物2(enhancer of zeste homolog 2, EZH2)是多梳抑制复合体2(polycomb repressive complex 2, PRC2)中的核心亚基,具有组蛋白甲基化酶活性,能催化组蛋白H3第27位赖氨酸三甲基化(trimethylation of histone H3 lysine27, H3K27me3),在表观遗传学水平调控基因的表达[2]。而EZH2抑制剂DZNep (3-deazaneplanocin)作为EZH2蛋白的靶向抑制剂,能抑制EZH2的组蛋白甲基化酶活性,并能降解EZH2蛋白[3]。最新研究证实,EZH2在NK/T淋巴瘤组织中表达显著增高,且与肿瘤细胞的异常增殖密切相关[4]。目前,在对NK/T淋巴瘤的研究中,针对EZH2的靶向治疗鲜有报道,据此,该研究拟用EZH2抑制剂DZNep作用人NK/T淋巴瘤细胞株SNK-6,观察其对EZH2蛋白水平的影响以及对SNK-6细胞增殖、凋亡及细胞周期的影响,进而为该肿瘤的靶向治疗提供一定的参考。
1 材料与方法
1.1 材料
1.1.1细胞系 人NK/T淋巴瘤细胞SNK-6细胞株购自上海信裕生物科技有限公司。
1.1.2药品与主要试剂 DZNep购自美国APExBIO公司,以DMSO溶解储存备用;RPMI 1640培养液、胎牛血清购自美国HyClone公司;CCK-8试剂盒购自上海碧云天生物技术有限公司;Annexin V/PI细胞凋亡检测试剂盒、PI染色细胞周期检测试剂盒均购自上海贝博公司;兔抗人EZH2、Cleaved PARP单克隆抗体均购自美国Cell Signaling Technology公司;兔抗人Cleaved Caspase-3抗体购自英国Abcam公司;兔抗人β-actin抗体、辣根过氧化物酶标记的羊抗兔IgG均购自武汉塞维尔科技有限公司。
1.2 方法
1.2.1细胞培养 将NK/T淋巴瘤细胞株SNK-6置于含10%胎牛血清及100 U/ml青霉素和100 μg/ml链霉素的RPMI 1640培养液中,在37 ℃、5% CO2、饱和湿度培养箱中培养,细胞呈悬浮生长,每2~3 d换液并传代,取处于对数生长期的细胞进行实验。
1.2.2CCK-8法检测细胞增殖 将SNK-6细胞以每孔5×103个细胞的密度接种于96孔板中,用不同浓度(0.2、0.5、1、2、5 μmol/L)DZNep处理细胞,同时设对照组(不加药物,加入等量DMSO)及空白组(只含培养液,无细胞),每组设3个复孔,培养24、48、72 h后,加入CCK-8溶液,在培养箱孵育2 h后,用酶标仪测出波长为450 nm的吸光度(A450)值。实验重复3次,取平均值,根据公式计算细胞增殖抑制率(%)=[1-(A加药组-A空白组)/(A对照组-A空白组)]×100%,以药物浓度为横轴,细胞增殖抑制率为纵轴,绘制细胞生长曲线。
1.2.3PI染色流式细胞术检测细胞周期 将细胞以1×106/ml的浓度接种于6孔板中,用不同浓度(0.2、1、5 μmol/L)DZNep处理细胞,并设立对照组(不加药物,加入等量DMSO),培养48 h后,离心(1 500 r/min,5 min)收集细胞,冷PBS洗涤2次,用500 μl PBS重悬细胞,滴加5 ml冷乙醇4 ℃固定过夜,离心(2 000 r/min,10 min)收集细胞,冷PBS 洗涤2次,用500 μl冷PBS重悬细胞后加入Rnase A溶液20 μl,37 ℃水浴30 min,离心(2 000 r/min,10 min)收集细胞,加入400 μl PI染液重悬细胞,4 ℃避光孵育30 min,立即用流式细胞仪(BD FACSVerse)检测细胞周期,用FlowJo软件分析细胞周期百分比。
1.2.4Annexin V/PI双染流式细胞术检测细胞凋亡 将细胞以2×105/ml的浓度接种于6孔板中,用不同浓度(0.2、1、5 μmol/L)DZNep处理细胞,并设立对照组(不加药物,加入等量DMSO),培养48 h后,离心(1 000 r/min,4 ℃,5 min)收集细胞,冷PBS洗涤2次,用400 μl×Annexin V结合液悬浮细胞,密度大约为1×106/ml,加入5 μl Annexin V-FITC染色液,4 ℃避光孵育15 min,加入10 μl PI染色液,4 ℃避光孵育5 min,立即用流式细胞仪(BD FACSVerse)检测细胞凋亡率,用FlowJo软件分析凋亡率。
1.2.5Western blot检测 收集不同浓度DZNep处理48 h后的SNK-6细胞,用全细胞蛋白提取试剂盒提取总蛋白,用BCA蛋白定量试剂盒定量,加入上样缓冲液,行SDS-PAGE凝胶电泳后转至PVDF 膜上,使用5%脱脂奶粉封闭液室温封闭2 h,TBST溶液速洗几次,加入EZH2、Cleaved Caspase-3、Cleaved PARP及β-actin一抗(1 ∶1 000稀释)4 ℃ 孵育过夜,次日用TBST溶液洗3次,加入二抗(1 ∶10 000稀释)室温孵育2 h,TBST溶液洗3次,ECL化学发光法曝光、显影,用ImageJ分析软件分析各条带灰度值,目的蛋白的相对表达量以目的蛋白/内参β-actin的灰度值表示。
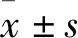
2 结果
2.1 DZNep能抑制SNK-6细胞增殖不同浓度(0.2、0.5、1、2、5 μmol/L)DZNep分别处理SNK-6细胞24、48、72 h后,细胞增殖均受到不同程度抑制,各加药组与对照组比较差异均有统计学意义(F=192.869、1 469.000、3 210.000,P<0.01),且DZNep对SNK-6细胞株的增殖抑制作用存在时间-剂量依赖关系,见表1、图1。
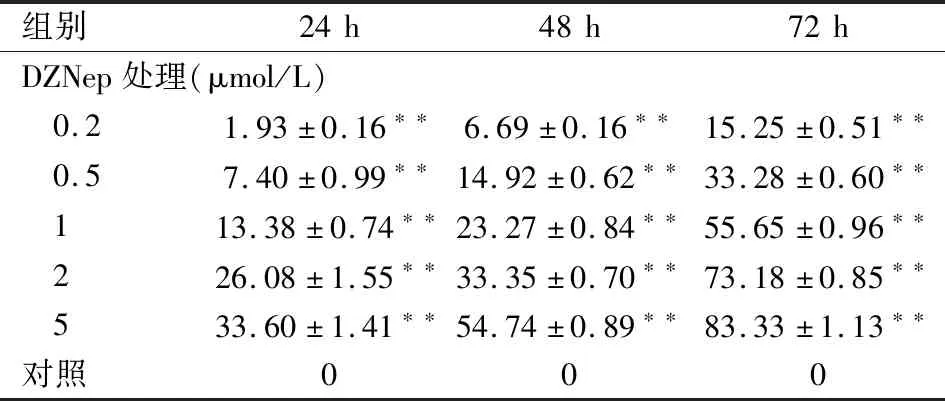
表1 CCK-8法检测各组细胞增殖抑制率(%,n=3)
与对照组比较:**P<0.01
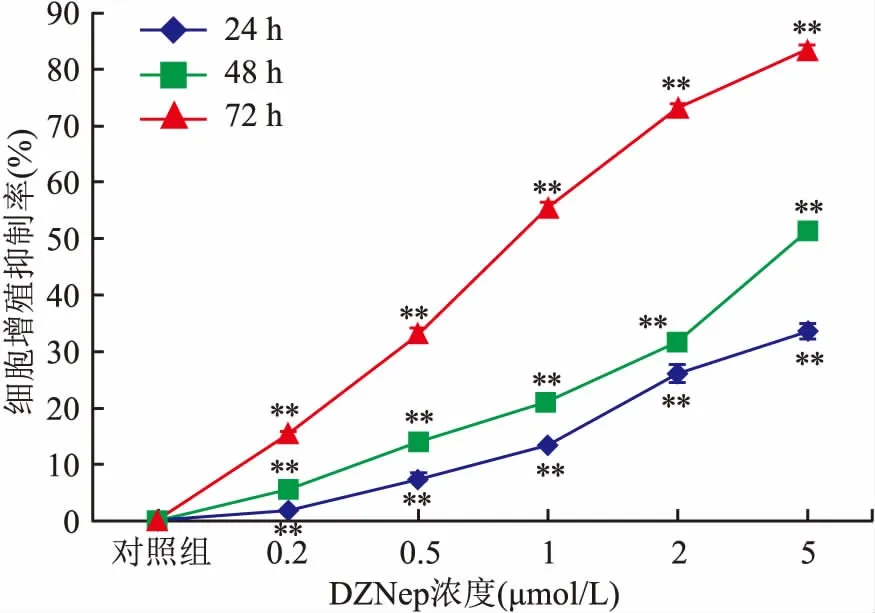
图1 DZNep抑制 SNK-6细胞的增殖
2.2 DZNep能诱导SNK-6细胞发生G1/S期阻滞不同浓度(0.2、1、5 μmol/L)DZNep处理SNK-6细胞48 h后,统计得G1期细胞百分比分别为(41.25±1.76)%、(46.40±2.03)%、(54.78±1.18)%,S期细胞百分比分别为(52.47±0.68)%、(41.67±1.28)%、(36.70±1.54)%,对照组G1期和S期细胞百分比分别为(33.40±1.69)%、(60.21±0.82)%,各加药组与对照组比较,G1期细胞百分比升高,差异有统计学意义(F=56.296,P<0.01),S期细胞百分比下降,差异有统计学意义(F=175.098,P<0.01),且均具有剂量依赖性,见图2。
2.3 DZNep能诱导SNK-6细胞发生凋亡不同浓度(0.2、1、5 μmol/L)DZNep处理SNK-6细胞48 h后,统计得细胞凋亡率分别为(15.09±0.89%)、(23.37±1.11)%、(47.54±1.61)%,对照组细胞凋亡率为(4.42±0.34)%,各加药组与对照组比较,细胞凋亡率明显升高,差异有统计学意义(F=566.955,P<0.01),且随着药物浓度升高,细胞凋亡率逐渐增加,呈剂量依赖性,见图3。
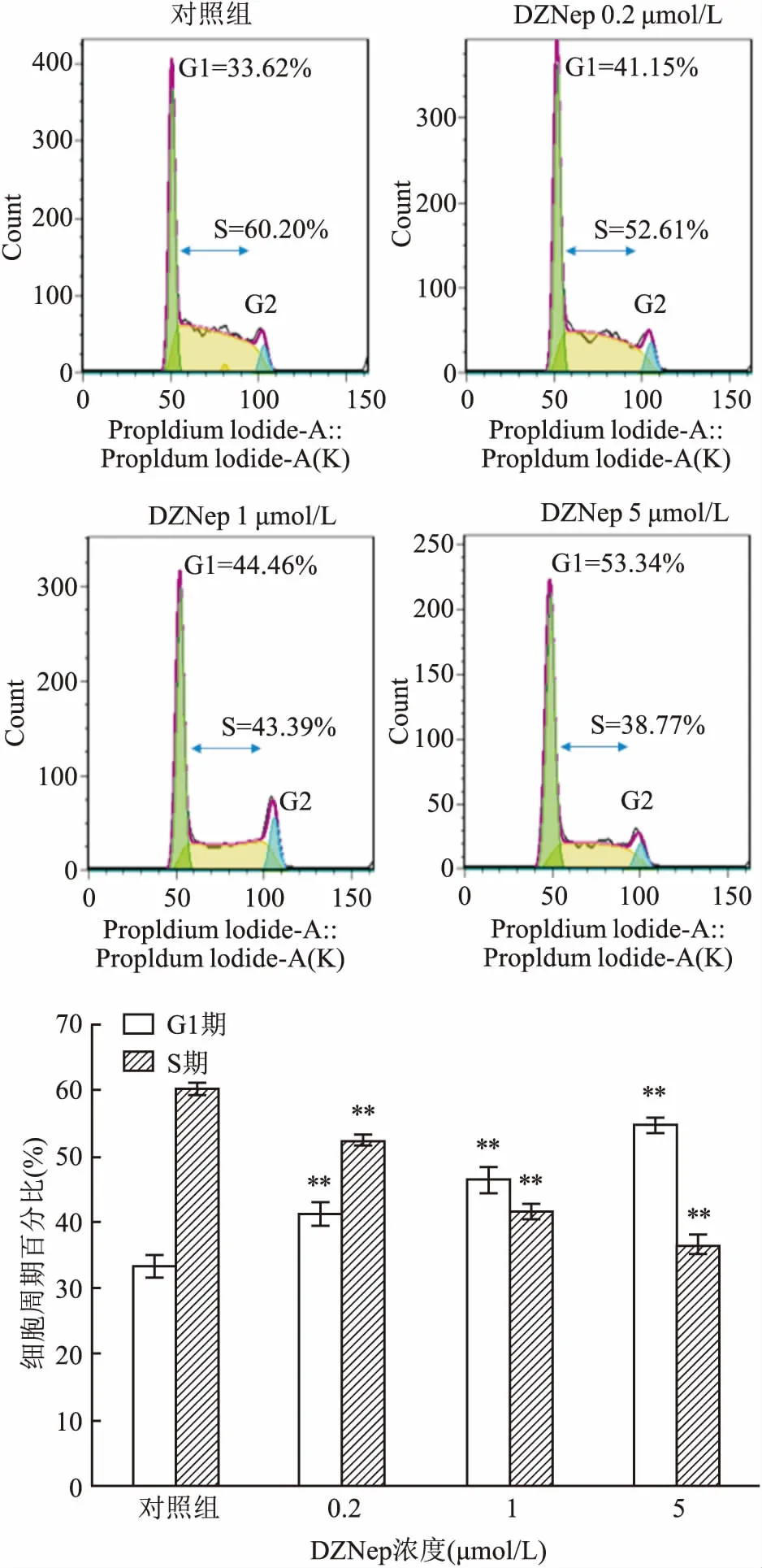
图2 DZNep诱导SNK-6细胞 G1/S期阻滞
2.4 DZNep降解EZH2蛋白并诱导Cleaved Caspase-3及Cleaved PARP的产生不同浓度(0.2、1、5 μmol/L)DZNep处理SNK-6细胞48 h后,EZH2蛋白水平呈下降趋势,与对照组相比,差异有统计学意义(F=7 457.000,P<0.01);Cleaved Caspase-3蛋白的相对表达量逐渐上升,与对照组比较,差异有统计学意义(F=893.251,P<0.01);Cleaved PARP蛋白的相对表达量逐渐上升,与对照组比较,差异有统计学意义(F=1 118.000,P<0.01),且均具有剂量依赖性,见图4。
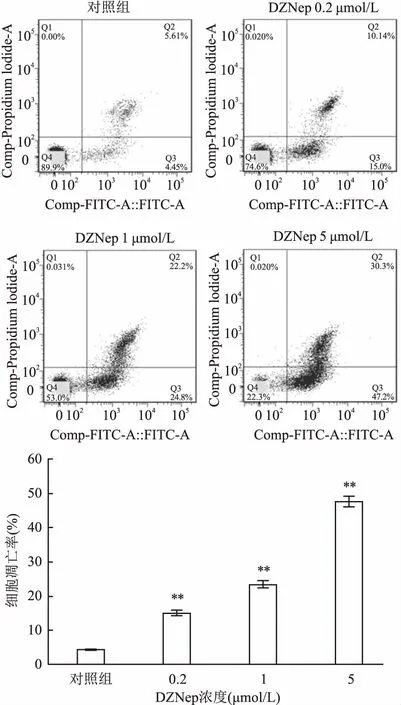
图3 DZNep诱导SNK-6细胞发生凋亡
3 讨论
NK/T淋巴瘤具有恶性度高、侵袭性强,预后不佳等特点,其发病机制尚不完全清楚,现已知与EB病毒感染密切相关,因多原发于鼻腔,故又称鼻型NK/T淋巴瘤。该病以血管中心性浸润为特点,并伴有明显的血管损伤和组织坏死。治疗上,早期以局部放疗为主,晚期以全身化疗为主,化疗方案可选择以左旋门冬酰胺酶为主的联合化疗方案,高危和复发难治的患者则可考虑自体或异基因造血干细胞移植治疗,但目前国际上仍无明确有效的治疗方案[5]。故进一步探究其发病机制以及寻求新的治疗思路尤为重要。
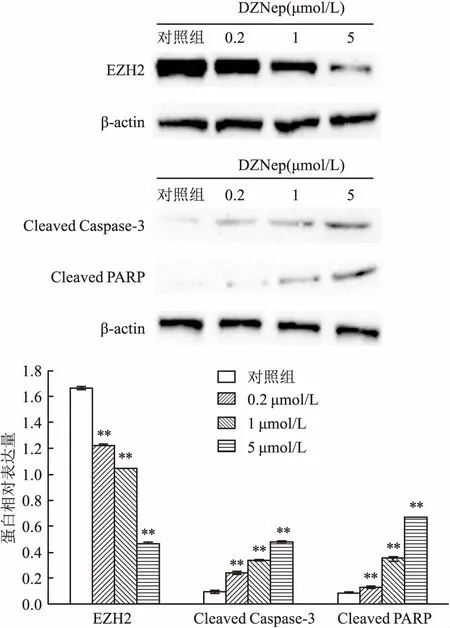
图4 DZNep降解EZH2蛋白并诱导Cleaved
EZH2基因位于染色体7q35~36上,包含20个外显子和19个内含子, EZH2蛋白由746个氨基酸构成,具有组蛋白甲基化酶的活性,EZH2催化的组蛋白甲基化常与其他表观遗传学修饰,如DNA甲基化、组蛋白去乙酰化等相关联,共同发挥致癌作用[2]。近年来,研究[6-7]显示EZH2在前列腺癌、乳腺癌等多种肿瘤中存在表达异常,且与肿瘤的发生、发展、预后以及耐药性密切相关,其作用机制复杂多样,具有特异性。在NK/T淋巴瘤中也存在EZH2表达上调的现象,但其并不是通过经典的H3K27me3途径发挥致癌作用,而是作为转录激活因子结合到Cyclin D1的启动子上,直接激活Cyclin D1的表达,进而导致肿瘤细胞的异常增殖[4]。本课题组前期研究[8]显示干扰EZH2基因可以增强NK/T淋巴瘤的化疗敏感性。
DZNep是一种3-去氮腺苷的环戊醇类似物,它是第一个被发现的EZH2抑制剂。DZNep能有效抑制S-腺苷同型半胱氨酸水解酶(S-adenosyl-L-homocysteine hydrolase,SAHH)水解S-腺苷同型半胱氨酸(S-adenosyl-L-homocysteine,SAH),引起细胞内SAH的积聚,并抑制S-腺苷甲硫氨酸(S-adenosyl-L-methionine,SAM)依赖的组蛋白甲基转移酶活性,同时,DZNep能诱导EZH2的降解[3]。目前,在对前列腺癌、乳腺癌、胃癌等多种肿瘤的体外实验[9-11]显示,DZNep能通过干扰组蛋白修饰及miRNA等多种途径抑制肿瘤细胞的增殖、侵袭和转移。
本实验选择用EZH2抑制剂DZNep作用于SNK-6细胞株,观察其对细胞增殖、凋亡及细胞周期的影响。DZNep在0.2~5 μmol/L的范围内可有效抑制SNK-6细胞株的增殖,并存在时间-剂量依赖性。同时,DZNep能诱导G1/S期阻滞,细胞周期是指细胞从一次分裂结束到下一次分裂完成的全过程,包括分裂期和分裂间期两个部分,分裂间期又包括DNA合成前期(G1期),DNA合成期(S期)和DNA合成后期(G2期)。G1/S期转换是指细胞由DNA复制前的物质、能量准备阶段进入DNA复制阶段,G1/S期转换失控是癌变的关键步骤[12]。本实验结果表明DZNep能通过阻滞G1/S期转换来抑制细胞异常增殖。细胞凋亡是细胞生理性的自发死亡,受多种基因和信号通路的严密调控,诱导细胞凋亡是肿瘤治疗中的重要策略。本实验运用Annexin V/PI双染流式细胞术证明DZNep能有效诱导SNK-6细胞发生凋亡。同时,Western blot结果显示,随着药物剂量的增加,Cleaved Caspase-3和Cleaved PARP水平呈上升趋势。Cleaved Caspase-3是Caspase-3的激活形式,Caspase-3作为凋亡执行的关键蛋白,正常情况下以无活性酶原的形式存在于胞质中,当凋亡启动时,Caspase-3被剪辑激活成Cleaved Caspase-3,而PARP作为Cleaved Caspase-3的底物,又被进一步剪辑成Cleaved PARP。PARP具有DNA修复酶的功能,剪辑后的PARP丧失了DNA修复能力,促进了凋亡的发生。Cleaved Caspase-3和Cleaved PARP作为凋亡发生的分子标志,其表达量的增加再次表明DZNep能诱导凋亡的发生。除此之外,随着DZNep浓度的增加,EZH2蛋白水平呈下降趋势,证明DZNep能有效降解EZH2蛋白。
以上实验结果初步表明,DZNep能降解EZH2蛋白,并在体外抑制SNK-6细胞的增殖、诱导G1/S期阻滞、诱导凋亡发生并促进Cleaved Caspase-3、Cleaved PARP的产生。该结果为NK/T淋巴瘤的靶向治疗提供了一定的参考,此后需完善其相关分子机制及上下游信号通路的研究,同时可进一步探究DZNep与常规化疗药物的联合应用效果,为NK/T淋巴瘤的治疗提供更多的思路。

