褪黑素对高糖刺激系膜细胞NF-κB与TGF-β/Smad3通路的影响
马 玉 ,杨雯雯,范 哲,吴永贵,夏玲玲
糖尿病肾病(diabetic nephropathy, DN)是糖尿病最严重和最常见的并发症之一。肾小球肥大、基底膜增厚和多种细胞外基质沉积是DN的病理学基础,最终导致肾小球和肾间质纤维化[1]。大量研究发现系膜细胞(mesangial cells, MCs)中核因子-κB(nuclear factor-κB,NF-κB)在DN炎症及纤维化的进展中发挥关键作用[2-3]。转化生长因子-β1(transforming growth factor-β1,TGF-β1)可激活其下游Smad3途径诱导细胞外基质Ⅳ型胶原(collagenⅣ,Col Ⅳ)和纤连蛋白(fibronectin,Fn)分泌增加,导致肾脏纤维化[4-5]。褪黑素(melatonin, MT)是由松果体产生的吲哚,具有抗氧化和抗炎的特性。研究[6]显示MT可以抑制肾脏炎症发挥肾脏保护作用;另有研究[7]证实MT通过抑制NF-κB信号通路从而降低炎症的产生。该研究旨在探讨在MCs中MT是否通过NF-κB及TGF-β/Smad3通路抑制纤维化因子的产生,为DN的治疗提供新的思路。
1 材料与方法
1.1 实验材料MCs SV40 MES13细胞株购自中国科学院上海生命科学研究院细胞资源中心;MT、甘露醇、高糖购自美国sigma公司;DMEM1.0培养基、胎牛血清、青链霉素混合液购自美国Thermo Scientific公司;BCA蛋白测定试剂盒购自上海碧云天生物工程研究所;CCK-8试剂盒和SYBR Green PCR试剂盒购自南京诺唯赞生物科技有限公司;小鼠Col Ⅳ和Fn 酶联免疫吸附法(ELISA)试剂盒购自武汉华美生物科技有限公司;兔抗NF-κBp65单克隆抗体、鼠抗核因子κB抑制因子(inhibitor of NF-κB,IκB)单克隆抗体、鼠抗p-IκB单克隆抗体购自美国Cell Signaling公司,兔抗Smad3多克隆抗体和兔抗p-Smad3多克隆抗体购自美国Abcam公司,兔抗Col Ⅳ多克隆抗体、兔抗Fn多克隆抗体和小鼠抗β-actin单克隆抗体购自武汉三鹰生物技术公司。
1.2 实验方法
1.2.1细胞培养 将液氮中冻存的系膜细胞取出,在37 ℃的水浴锅中迅速融化,转移至10 ml的离心管中,加5~6 ml培养液吹打混匀,1 000 r/min离心10 min,弃上清,加5 ml培养液吹打重悬后,接种至含10%胎牛血清、1%青链霉素的DMEM1.0的培养基中常规培养。
1.2.2实验分组 将细胞分为:甘露醇对照组,正常对照组(糖浓度为5 mmol/L),正常对照+MT组,高糖组(糖浓度为25 mmol/L),高糖+10 μmol/L MT组,高糖+100 μmol/L MT组,高糖+1 000 μmol/L MT组。
1.2.3CCK-8检测细胞活性 将浓度为1×105个/ml细胞悬液接种于96孔板,每孔加入100 μl,无细胞组和空白对照组加单纯培养基100 μl,37 ℃培养24 h。弃去培养基,按实验分组加入不同刺激药物,培养基其它成分与正常对照组相同,培养24 h后,按照CCK-8试剂盒说明书检测系膜细胞活性情况。
1.2.45-乙炔基-2′-脱氧尿苷(5-ethynyl-2′-deoxyuridine,EdU)检测细胞增殖 将浓度为1×104个/ml细胞悬液接种于6孔板,常规培养。按照实验分组加药刺激后,继续培养24 h,加入2×EdU 工作液,孵育30 min,弃去培养液,加入4%多聚甲醛细胞固定液,孵育15 min,弃去细胞固定液,含 3% BSA 的 PBS漂洗2次,加入PBST,室温孵育 20 min,每孔加入100 μl iClick 反应液,避光,室温孵育30 min, 1 × Hoechst 33342 染色液避光染色15 min,封片,激光共聚焦显微镜(LSM880,购自德国卡尔蔡司)拍照观察。
1.2.5激光共聚焦检测NF-κBp65核转移及Col Ⅳ和Fn的表达 将适宜浓度的细胞悬液加入装有盖玻片的6孔板中,常规培养。按照实验分组每组加入不同刺激物,继续培养24 h,4%多聚甲醛固定5 min,0.5% TRItonx-100孵育15 min,5%驴血清4 ℃封闭2 h,加入兔抗NF-κBp65、兔抗Col Ⅳ及兔抗Fn的一抗4 ℃孵育过夜,PBS漂洗3遍,每遍5 min,然后加入荧光二抗,常温避光孵育2 h,DAPI染液染核10 min,封片,激光共聚焦显微镜观察采像。
1.2.6ELISA检测细胞因子表达水平 收集各组细胞上清液,按照各ELISA试剂盒说明书进行。
1.2.7qRT-PCR检测细胞因子mRNA表达水平 收集各组细胞,采用TRIzol法提取各组细胞mRNA,加入4 μl 5 × HiScript Ⅱ qRT SuperMix、1 μg模板RNA、RNase free ddH2O配制成20 μl混合液,逆转录条件第一步50 ℃、 15 min,第二步8 ℃、5 s,合成cDNA。按SYBR Green PCR试剂盒检测Col Ⅳ和Fn mRNA表达,引物序列见表1。加入10 μl 2 × AceQ qPCR SYBR Green Master Mix、0.4 μl Primer1(10 μmol/L)、0.4 μl Primer2(10 μmol/L )、0.4 μl 50×ROX Reference Dye 2、2 μl DNA模板、ddH2O配制成20 μl混合液,按第一步95 ℃、5 min,1个循环;第二步95 ℃、10 s,60 ℃、30 s,40个循环;第三步95 ℃、15 s,60 ℃、60 s,95 ℃、15 s,1个循环的条件进行反应。以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)GAPDH作为内参,用2-ΔΔCT法计算。

表1 qRT-PCR引物序列表
1.2.8Western blot检测细胞蛋白表达 收集各组细胞,提取总蛋白,BCA试剂盒检测蛋白浓度,加上样缓冲液煮沸10 min后,取40 μg蛋白上样,经8%~12%SDS-PAGE凝胶电泳,湿电转至硝酸纤维膜上,丽春红显色,5%脱脂牛奶-PBST溶液4 ℃封闭2 h,分别加入Col Ⅳ(1 ∶500)、Fn(1 ∶1 000)、TGF-β1(1 ∶1 000)、Smad3(1 ∶1 000)、p-Smad3(1 ∶1 000)、IκB(1 ∶1 000)、p-IκB(1 ∶1 000)、β-actin(1 ∶35 000),4 ℃过夜,PBST洗3次,每次10 min,加入对应二抗(1 ∶10 000),室温孵育45 min,洗膜,显影。采用β-actin作为内参,系统软件Image-J进行灰度分析。
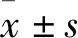
2 结果
2.1 CCK-8检测各组MCs活性与正常对照组相比,高糖组、高糖+1 μmol/L MT组、高糖+10 μmol/L MT组、高糖+100 μmol/L MT组、高糖+1 000 μmol/L MT组MCs活性未受影响(P>0.05);高糖+10 000 μmol/L MT组MCs的活性降低(F=53.010,P<0.05)。见图1。
2.2 EdU检测各组MCs增殖情况及激光共聚焦检测NF-κBp65亚基入核在MCs增殖检测中,与正常对照组比较,甘露醇对照组和正常对照+MT组的红色荧光表达无差异,高糖组红色荧光表达明显增强;与高糖组相比,高糖+10 μmol/L MT组、高糖+100 μmol/L MT组、高糖+1 000 μmol/L MT组红色荧光强度均下降,其中MT干预组的荧光下降程度与MT浓度呈正相关。在NF-κBp65入核检测中,与正常对照组相比,高糖组NF-κBp65的绿色荧光显著增强,且入核明显增多;与高糖组比较,高糖+10 μmol/LMT组、高糖+100 μmol/L MT组、高糖+1 000 μmol/L MT组NF-κBp65绿色荧光强度及入核均呈浓度依赖性降低。见图2。
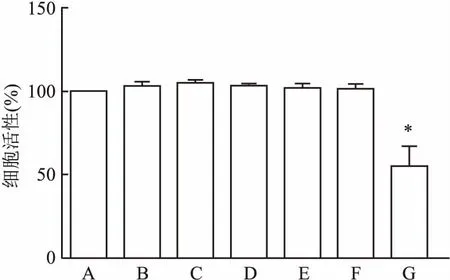
图1 MT对高糖刺激MCs活性的影响
A:正常对照组;B:高糖组;C:高糖+1 μmol/L MT组;D:高糖+10 μmol/L MT组;E:高糖+100 μmol/L MT组;F:高糖+1 000 μmol/L MT组;G:高糖+10 000 μmol/L MT组;与正常对照组比较:*P<0.05
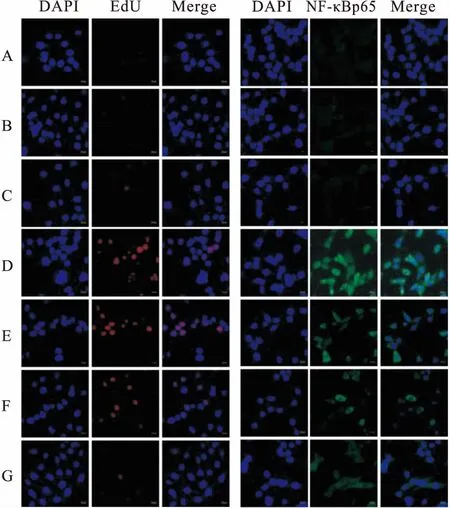
图2 共聚焦显微镜下各组MCs 增殖及
A:甘露醇对照组;B:正常对照组;C:正常对照+MT组;D:高糖组;E:高糖+10 μmol/L MT组;F:高糖+100 μmol/L MT组;G:高糖+1 000 μmol/L MT组
2.3 激光共聚焦检测各组MCs Col Ⅳ、Fn的表达与正常对照组比较,甘露醇对照组和正常对照+MT组Col Ⅳ 绿色荧光、Fn红色荧光强度无差异,高糖组荧光强度明显增强;与高糖组相比,高糖+10 μmol/L MT组、高糖+100 μmol/L MT组、高糖+1 000 μmol/L MT组的荧光强度均下降,其中MT干预组的荧光下降程度与MT浓度呈正相关。见图3。
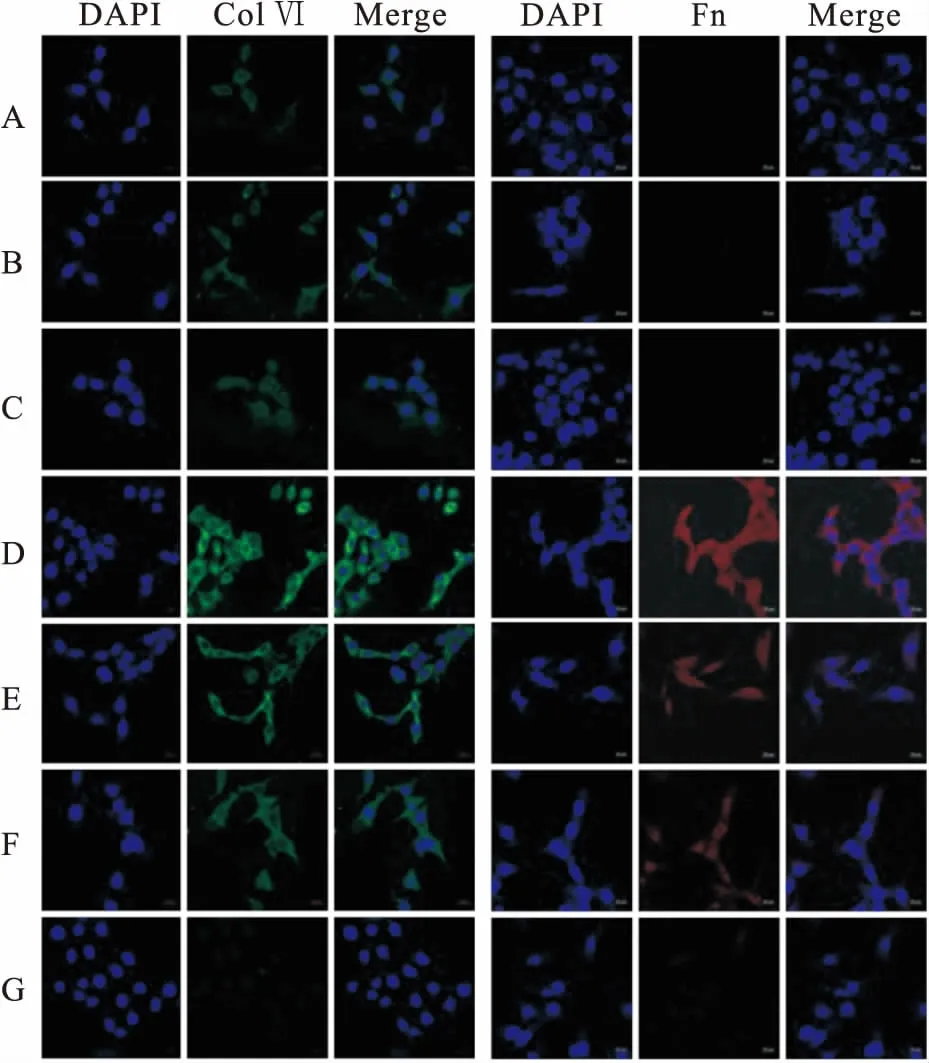
图3 共聚焦显微镜下各组MCs Col Ⅳ、Fn表达情况 ×630
A:甘露醇对照组;B:正常对照组;C:正常对照+MT组;D:高糖组;E:高糖+10 μmol/L MT组;F:高糖+100 μmol/L MT组;G:高糖+1 000 μmol/L MT组
2.4 ELISA检测各组MCs上清液中Col Ⅳ、Fn表达水平与正常对照组比较,甘露醇对照组和正常对照+MT组收取的培养基上清液中所含Col Ⅳ和Fn水平差异无统计学意义,高糖组纤维化因子Col Ⅳ和Fn水平明显上升(P<0.05);与高糖组相比,高糖+10 μmol/L MT组Col Ⅳ水平降低,但差异无统计学意义,高糖+100 μmol/L MT组、高糖+1 000 μmol/L MT组Col Ⅳ水平均明显降低,其降低程度与MT浓度呈正相关,差异有统计学意义(P<0.05);与高糖组相比,高糖+10 μmol/L MT组、高糖+100 μmol/L MT组、高糖+1 000 μmol/L MT组Fn水平均显著下降,其降低程度与MT浓度呈正相关,差异有统计学意义(FCol Ⅳ= 60.438,FFn=2 074.666,P<0.05)。见表2。
2.5 qRT-PCR检测各组MCs Col Ⅳ和Fn mRNA表达变化与正常对照组比较,甘露醇对照组和正常对照+MT组Col Ⅳ和Fn mRNA转录表达差异无统计学意义,高糖组Col Ⅳ和Fn mRNA表达明显增加(P<0.05);与高糖组相比,高糖+10 μmol/L MT
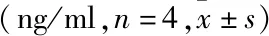
表2 各组上清液中Col Ⅳ、Fn含量
A:甘露醇对照组;B:正常对照组;C:正常对照+MT组;D:高糖组;E:高糖+10 μmol/L MT组;F:高糖+100 μmol/L MT组;G:高糖+1 000 μmol/L MT组;与正常对照组比较:*P<0.05;与高糖组比较:#P<0.05
组、高糖+100 μmol/L MT组、高糖+1 000 μmol/L MT组mRNA转录均明显降低,其降低程度与MT浓度呈正相关,差异有统计学意义(FCol Ⅳ=61.011,FFn=16.287,P<0.05)。见图4。
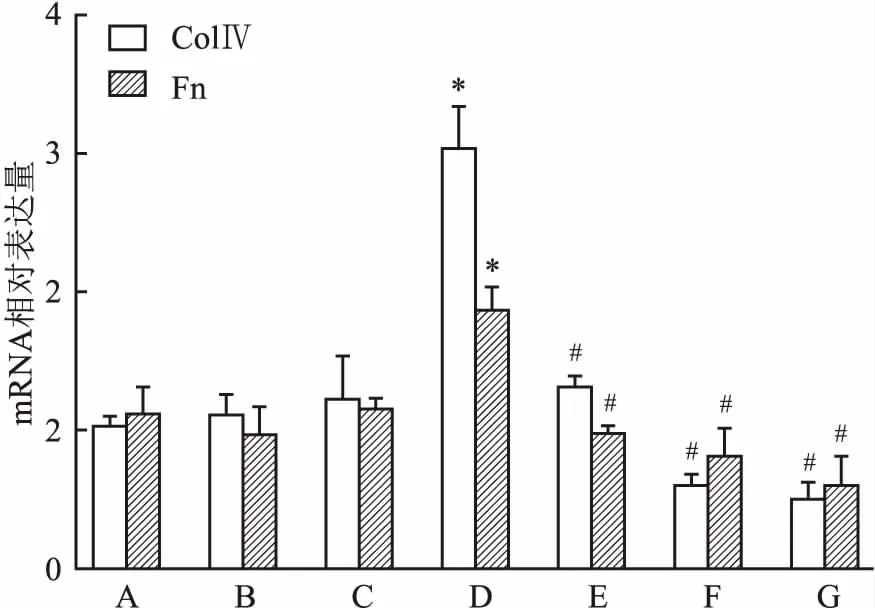
图4 qRT-PCR检测各组MCs Col Ⅳ、Fn mRNA表达
A:甘露醇对照组;B:正常对照组;C:正常对照+MT组;D:高糖组;E:高糖+10 μmol/L MT组;F:高糖+100 μmol/L MT组;G:高糖+1 000 μmol/L MT组;与正常对照组比较:*P<0.05;与高糖组比较:#P<0.05
2.6 Western blot检测各组MCs Col Ⅳ、Fn、p-IκB/IκB、TGF-β1、p-Smad3/Smad3蛋白表达与正常对照组比较,甘露醇对照组和正常对照+MT组Col Ⅳ、Fn、p-IκB/IκB、TGF-β1、p-Smad3/Smad3蛋白表达无统计学意义,高糖组各蛋白表达明显增强(P<0.05);高糖+10 μmol/L MT组、高糖+100 μmol/L MT组、高糖+1 000 μmol/L MT组各蛋白表达与高糖组相比均降低,其降低程度与MT浓度呈正相关,差异有统计学意义(FCol Ⅳ=231.419,FFn=403.166,Fp-IκB/IκB=785.722,FTGF-β1=107.384,Fp-Smad3/Smad3=178.465,P<0.05)。见图5、6、7。
3 讨论
DN是糖尿病患者死亡的主要原因,它是一种原发性慢性微血管病变,微炎症和随后的细胞外基质增加是DN进展的主要途径[5, 8]。MCs作为肾脏重要组成细胞之一,具有收缩、吞噬、增殖、合成系膜基质和胶原的功能。高血糖是DN发生的启动因素,越来越多的研究[3, 9]表明,高糖刺激可以诱导MCs分泌Col Ⅳ和Fn增加,引起肾脏纤维化。本实验采用高糖刺激MCs,模拟糖尿病高糖微环境,结果显示,与正常糖浓度对照组相比,高糖组MCs增殖明显上调,促纤维化细胞因子 TGF-β1及细胞外基质Col Ⅳ和Fn表达明显增强。
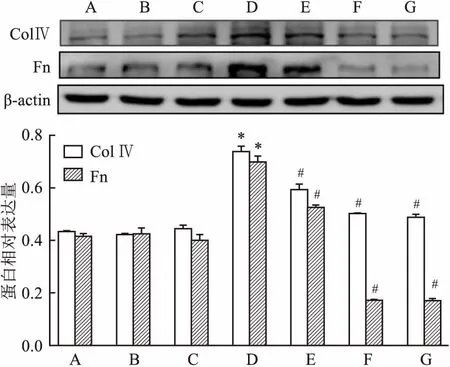
图5 Western blot检测各组MCs Col Ⅳ、Fn 蛋白表达
A:甘露醇对照组;B:正常对照组;C:正常对照+MT组;D:高糖组;E:高糖+10 μmol/L MT组;F:高糖+100 μmol/L MT组;G:高糖+1 000 μmol/L MT组;与正常对照组比较:*P<0.05;与高糖组比较:#P<0.05
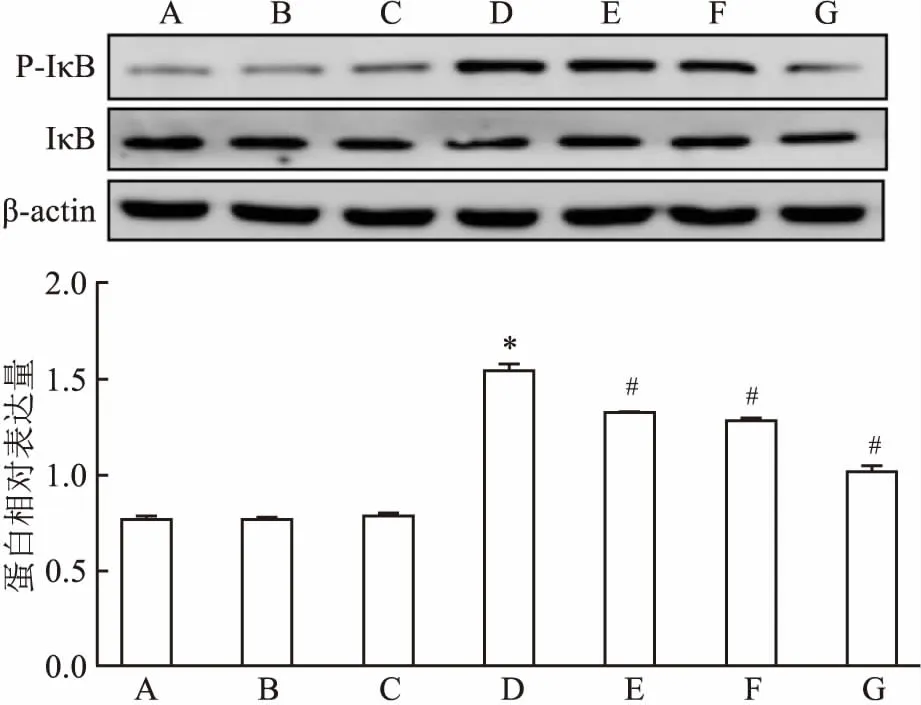
图6 Western blot检测各组MCs p-IκB/IκB蛋白表达
A:甘露醇对照组;B:正常对照组;C:正常对照+MT组;D:高糖组;E:高糖+10 μmol/L MT组;F:高糖+100 μmol/L MT组;G:高糖+1 000 μmol/L MT组;与正常对照组比较:*P<0.05;与高糖组比较:#P<0.05
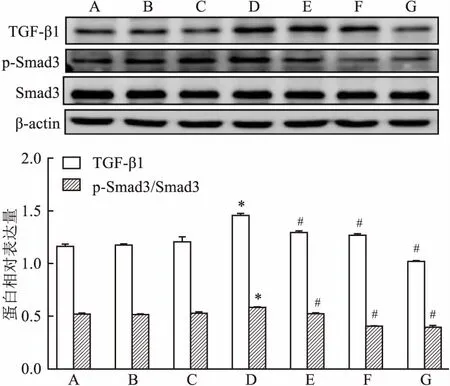
图7 Western blot检测各组MCs TGF-β1、
A:甘露醇对照组;B:正常对照组;C:正常对照+MT组;D:高糖组;E:高糖+10 μmol/L MT组;F:高糖+100 μmol/L MT组;G:高糖+1 000 μmol/L MT组;与正常对照组比较:*P<0.05;与高糖组比较:#P<0.05
NF-κB在炎症的发生发展中发挥重要作用。未受刺激时,NF-κB游离存在胞质中,一旦受到刺激,NF-κB 便移位于细胞核中并促进多种炎症因子如肿瘤坏死因子、白细胞介素1β和单核细胞趋化因子1的释放,并且促进促纤维化因子TGF-β1的产生[2,10]。TGF-β/Smad3信号通路是参与胶原产生的关键信号通路之一,促纤维化因子TGF-β1的激活以及细胞外基质Col Ⅳ和Fn的产生,导致肾小球系膜基质积聚,肾小管间质硬化[11]。既往研究[4, 12]显示,抑制TGF-β/Smad3信号通路可以预防肾纤维化。在本实验中,通过激光共聚焦显微镜观察到,高糖组的NF-κBp65荧光强度明显增强,入核明显增加;Western bolt显示p-IκB/IκB蛋白表达显著升高,TGF-β1和p-Smad3/Smad3的蛋白表达也明显上调。可以推测出高糖刺激可以增强NF-κBp65入核,并且激活TGF-β/Smad3信号通路使MCs外基质Col Ⅳ和Fn的分泌明显增加。
MT主要由松果体产生,前期研究[13-14]显示MT具有抗氧化,抗炎和抗细胞凋亡等多种药理活性。近期研究[14]表明MT对DN具有保护作用,但具体的保护机制仍是不明确的。本实验采用高糖模拟糖尿病微环境,刺激MCs,观察到MT对高糖刺激的MCs的增殖起到抑制作用,抑制 NF-κBp65入核,减少促纤维化因子TGF-β1、细胞外基质Col Ⅳ和Fn的合成分泌,这些证实了MT具有抗纤维化作用;同时观察到MT对正常糖浓度下MCs的增殖、NF-κBp65入核、TGF-β/Smad3信号通路及Col Ⅳ和Fn的分泌无影响,由此可以推测MT是通过抑制高糖刺激下NF-κBp65入核及TGF-β/Smad3信号通路上调抑制MCs分泌Col Ⅳ和Fn。
综上所述,高糖刺激可以导致MCs增殖,并且诱导MCs的NF-κBp65入核及TGF-β/Smad3信号通路激活,从而促进Col Ⅳ和Fn的分泌;MT可以抑制高糖诱导的MCs增殖,并且通过干预MCs 的NF-κBp65核转位及TGF-β/Smad3信号通路上调从而降低高糖引起的Col Ⅳ和Fn的分泌。本研究参考了大量国内外文献,发现系膜的增生及Col Ⅳ和Fn的分泌可引起糖尿病肾病肾脏的纤维化,但机制尚未阐明,此研究深入探讨了相关机制,发现MCs增殖及外基质的分泌可能与NF-κB及TGF-β/Smad3通路相关,MT可通过抑制NF-κB及TGF-β/Smad3信号通路从而减弱高糖刺激下MCs的增殖及外基质的分泌,为DN肾脏纤维化提供了新的思路与视角,但此作用是否同时与其他信号通路有关还需深入研究。

