噬菌体抗体库技术筛选抗VEGF165单克隆抗体
詹明硕,刘方杰,张亚兰
1.北京城市学院 生物医药学部,北京 100083;2.北京天广实生物技术股份有限公司,北京 100176
据世界卫生组织下属的国际癌症研究机构(InternationalAgency forResearch on Cancer,IARC)最新公布的全球癌症数据报告估计,2018年全球癌症新病例增至1810万例,死亡病例增至960万例。由此可见,癌症发病率逐年升高,已成为影响人类健康及减少寿命的第一大因素。目前,以单克隆抗体为代表的抗体疗法成效显著,随着新的单克隆抗体靶点的发现,有近百种单克隆抗体作为治疗型药物被批准上市,广泛应用于当前疾病的治疗中。
恶性肿瘤的生长迁移依赖于血管形成。血管内皮生长因子(vascular endothelial growth factor,VEGF)是高度特异性的促血管内皮细胞生长因子,在肿瘤生长中发挥重要作用。根据不同的剪切方式,VEGF-A分为5种亚型,即VEGF121、VEGF145、VEGF165、VEGF189和 VEGF206,其中VEGF165是VEGF-A最重要的同源单体,在细胞内含量最多,分裂原性也最强。VEGF主要通过与细胞表面的VEGF受体2(VEGFR2)结合,激活VEGFR2,产生一系列级联反应,诱导多种细胞内通路调控,内皮细胞分裂、存活、萌发和迁移[1]。肿瘤细胞通过大量表达VEGF,利用VEGF/VEGFR通路,以血管为主的脉管大量生长,为肿瘤生长提供了氧气和营养物质。通过研发新型抗体药物与VEGFR竞争性结合VEGF,可以阻断VEGF/VEGFR信号通路,减少血管形成,进而影响细胞分裂、迁移,发挥抗肿瘤的功效。
噬菌体展示技术广泛应用于抗体筛选,在全人源抗体、小分子抗体、高特异性抗体等研发中发挥了巨大优势,已发展成为抗体药物研发的重要技术手段[2]。表面展示和免疫动物是目前常用的2种方法。免疫动物接种在抗体研发中曾发挥重要作用,但是针对有毒抗原及半抗原的单克隆抗体制备则呈现明显缺陷和不足[3]。相比杂交瘤免疫小鼠较为复杂的方法制备单克隆抗体,噬菌体展示完全在体外进行,具有制备周期短、筛选范围广等优点。1985年,Smith[4]发明了噬菌体展示技术,在噬菌体外壳表面展示蛋白质,噬菌体内部则包含了对应蛋白的编码基因,其价值体现在可使基因型和表型建立直接联系,通过这种方式,大量蛋白质可以在体外被筛选和扩增。其后,McCafferty等[5]将噬菌体展示技术用于抗体进化,以生产新的药物。
本研究中,我们利用噬菌体展示技术从抗体库中筛选出抗VEGF165的单克隆抗体VG2。一系列的功能研究显示,VG2抗体具有较高的亲和力,能够阻断VEGF/VEGFR信号通路,并能够抑制VEGF诱导的人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVEC)增殖。
1 材料与方法
1.1 材料
293E细胞株、载体pX、辅助噬菌体M13KO7均由本实验室保存;感受态大肠杆菌DH5α购自北京擎科新业生物技术有限公司;限制性内切酶购自NEB公司;胶回收试剂盒、质粒提取试剂盒购自天根生化科技(北京)有限公司;ELISA二抗、重组人源蛋白VEGF165购自北京义翘神州生物技术股份有限公司;抗人抗体购自Sigma公司;引物由上海捷瑞生物技术股份有限公司合成。
1.2 噬菌体抗体库的制备
取30 μL合成抗体库甘油菌,接种至50 mL 2×YT CG培养基,37℃、220 r/min振荡培养约3 h至菌液D600nm为0.6~0.8,吸取10 mL培养液至50 mL离心管中,加入20 μL辅助噬菌体M13KO7混匀,37℃静置 30 min,37℃、220 r/min振荡培养30 min,6000 r/min离心 15 min,弃上清,沉淀重悬于含50 mL 2×YT CK培养基的锥形瓶中,30℃、220 r/min振荡过夜,将过夜菌转至50 mL离心管,4℃、4200 r/min离心 15 min,取 10 mL PEG/NaCl加40 mL上清液至新的离心管中混匀,冰浴1 h,4℃、4000 r/min离心20 min,弃上清,噬菌体重悬于5 mL含20%甘油的PBS中,即得到纯净的噬菌体悬液。
1.3 噬菌体抗体库的亲和淘选
取2支免疫管,紫外灯下灭菌15 min;用无菌PBS将VEGF165稀释至终浓度为1 mg/mL,加500 μL 溶液至免疫管中,同时加 500 μL 无菌PBS至另一支免疫管,设置阴性对照,4℃包被过夜;向免疫管中加入4%脱脂奶粉,室温孵育1 h,同时用4%脱脂奶粉封闭噬菌体抗体库1 h;弃封闭液,分别向2支管中加入500 μL封闭后的抗体库,混匀,室温孵育1 h;用PBST振荡洗涤免疫管20次,再用PBS振荡洗涤5次,每次振荡2.5 min;向免疫管中加入500 μL Gly-HCl(pH2.2)洗脱噬菌体 10 min;用 35 μL Tris-HCl(pH8.8)中和洗脱后的噬菌体,重复洗脱1次。
复苏接种大肠杆菌TG1,待菌液D600nm为0.6~0.8时取10 mL菌液,加入530 μL噬菌体洗脱液侵染,混匀,37℃静置30 min,37℃、220 r/min振荡30 min,4000 r/min离心15 min,弃上清,重悬菌体并涂布于2块2×YT CG平板,37℃过夜培养,将菌落从平板上刮下,加20%甘油冻存备用。
1.4 ELISA筛选阳性克隆
挑取单克隆菌株,接种于每孔含1 mL 2×YT CG培养基的96孔深孔板,37℃、220 r/min振荡过夜后,转接至900 μL 2×YT CG培养基,37℃、220 r/min振荡培养至D600nm为0.6~0.8,每孔加入100 μL辅助噬菌体M13KO7,混匀,37℃静置 30 min,37℃、220 r/min 振荡 30 min,25℃、1800 r/min 离心 15 min,弃上清,用 600 μL 2×YT CK培养基重悬沉淀,30℃、220 r/min振荡过夜,离心收取上清,ELISA鉴定阳性克隆,交由测序公司进一步鉴定。
1.5 ELISA检测噬菌体-抗体的结合能力
将测序正确的菌株接种至2×YT CG培养基中,37℃、220 r/min振荡培养至D600nm为0.6~0.8,向培养液中加入M13KO7进行感染并制备纯净的噬菌体-抗体蛋白;用PBS包被抗原VEGF165,4℃过夜,PBST洗板3次,拍干;每孔加250 μL 4%脱脂奶粉-PBST,37℃封闭1 h;加入系列梯度稀释的噬菌体-抗体蛋白,100 μL/孔,37℃孵育 1 h;PBST洗板后,加入HRP标记的抗M13单抗(1∶5000稀释),100 μL/孔,37℃孵育1 h;PBST洗板3次,加 TMB 显色液,100 μL/孔,室温显色;用0.1 mol/L H2SO4终止显色;测定D450nm值,用Graph-Pad Prism软件分析数据。
1.6 pXH和pXL重组质粒的构建
以测序正确的阳性克隆质粒为模板,利用特异上下游引物,PCR扩增2条序列(反应条件:98℃预变性 30 s,按照 98℃ 30 s、55℃ 30 s、72℃ 30 s循环25次,72℃延伸2 min,4℃保持约30 min),产物经琼脂糖凝胶电泳鉴定,胶回收,用限制性内切酶NheⅠ和SalⅠ酶切,回收目的片段亚克隆至pXH和pXL载体,连接产物转化大肠杆菌DH5α感受态细胞。
1.7 VG2抗体的表达及纯化
将测序正确的阳性单克隆菌株pXH-VG2VH和pXL-VG2VL分别接种至100 mL 2×YT A培养基中,37℃、220 r/min振荡培养过夜,4℃、8000 r/min离心15 min,弃上清,用大提试剂盒提取质粒用于转染。2种质粒按1∶1混合,同时取3倍质粒体积的转染试剂PEI缓慢加至5 mL FreeStyle F17细胞培养基中,室温静置15 min,混合液转入45 mL 293E细胞(1.6×106/mL),37℃、相对湿度80%、125 r/min培养6~7 d,4000 r/min离心20 min,收集上清,过滤后通过纯化仪Protein A层析柱进行纯化。
1.8 ELISA鉴定VG2抗体的结合活性
用 PBS稀释抗原 VEGF165至 1 μg/mL,加入96孔ELISA板中,4℃包被过夜;PBST洗板3次,拍干,每孔加250 μL 4%脱脂奶粉-PBST,37℃封闭1 h;将VG2从1 μg/mL开始进行1/3梯度稀释,共设置10个稀释梯度,并将稀释液加至96孔板,100 μL/孔,37℃孵育 1 h;PBST 洗板后,向 96孔板中加入HRP标记的鼠抗人Fc单抗(1∶5000稀释),100 μL/孔,37℃孵育1 h;PBST洗板3次,加TMB 显色液,100 μL/孔,室温显色;用 0.1 mol/LH2SO4终止显色;测定D450nm值,用GraphPad Prism软件分析数据。
1.9 竞争ELISA鉴定VG2抗体的功能
用 PBS稀释抗原 VEGF165至 1 μg/mL,加入96孔ELISA板中,4℃包被过夜;PBST洗板3次,拍干,每孔加250 μL 4%脱脂奶粉-PBST,37℃封闭1 h;将VG2与VEGFR从摩尔比100∶1开始进行1/3梯度稀释,共设置10个稀释梯度,将稀释液加至96孔板,100 μL/孔,37℃孵育1 h;PBST洗板,向96孔板中加入HRP标记的抗His标签鼠单抗(1∶2000稀释),100 μL/孔,37℃孵育 1 h;PBST洗板3次,加TMB显色液,100 μL/孔,室温显色;用0.1 mol/L H2SO4终止显色;测定D450nm值,用GraphPad Prism软件分析数据。
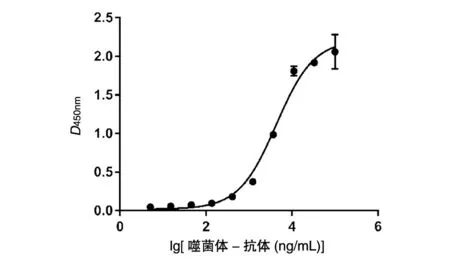
图1 ELISA检测噬菌体-抗体结合曲线
1.10 BIAcore法检测VG2抗体的亲和力
用胺基偶联法将小鼠anti-human FC段抗体偶联至CM5芯片表面,将1 μg/mL VG2抗体流经芯片表面,保证捕获约200响应值(response unit,RU)的抗体;用HBS-EP缓冲液稀释VEGF165至不同浓度(3、1、0.33、0.11、0.037、0.012、0.004 μg/mL),并将不同浓度的VEGF165流经固定相表面;采用3 mol/L MgCl2溶液对芯片进行再生,用BIAcore 8K Evaluation Software进行拟合,获得VG2抗体的KD值。
1.11 HUVEC增殖抑制检测VG2抗体的功能
将生长状态良好的HUVEC接种至96孔细胞培养板中,5×103/孔,在 37℃、5%CO2培养箱中培养 16~24 h;用 EBM-2 基础培养基将 320 μg/mL的VG2抗体进行1/2系列稀释,共设置7个浓度梯度;将100 ng/mL的VEGF165溶液等体积加入VG2抗体稀释液中,轻轻混匀,37℃孵育0.5 h;每孔加入100 μL不同浓度的VG2和VEGF165混合液,5%CO2培养箱中继续培养72 h;每孔加入20 μL CCK8溶液(轻拍混匀),37℃孵育约2.5 h,取出培养板,检测D450nm值。
2 结果
2.1 抗体库的筛选
以VEGF165为抗原,从噬菌体抗体库中筛选抗VEGF的单克隆抗体。1轮亲和淘选后,从平板上随机挑取168个克隆,加入辅助噬菌体,获得展示单一抗体的噬菌体克隆。ELISA初步检测噬菌体-抗体与VEGF165的结合能力,共获得125个阳性克隆,阳性率为74%。挑选阳性克隆进行序列测定,获得1个抗体序列,命名为VG2。
制备高纯度的噬菌体-VG2,梯度稀释ELISA检测噬菌体-VG2与VEGF165的结合能力。将噬菌体-VG2从100 μg/mL开始进行1/3系列梯度稀释,然后与VEGF165结合。anti-M13(HRP标记)二抗检测噬菌体-抗体与VEGF165的结合情况。实验结果显示,噬菌体-VG2能与VEGF165结合,呈剂量依赖关系。
2.2 VG2抗体表达载体构建
以噬菌体抗体库筛出的VG2质粒为模板,用上下游特异引物分别扩增轻链可变区(VL)和重链可变区(VH)片段,产物经琼脂糖凝胶电泳鉴定,结果如图2,所得目的条带约350 bp,条带清晰且大小与预期相符。经SalⅠ/NheⅠ双酶切,轻链与重链分别克隆至pXL和pXH载体,经序列测定,VG2全抗体表达载体构建成功。
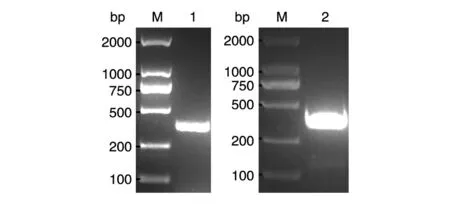
图2 VL、VH扩增产物的电泳鉴定
2.3 VG2抗体的表达和纯化
将测序正确的克隆进行质粒大提,转染293E细胞表达VG2抗体,再经Protein A层析柱纯化获得VG2抗体。SDS-PAGE鉴定抗体纯度,结果如图3,还原电泳条件下VG2抗体重链和轻链的相对分子质量分别约 50×103和 25×103,与理论值一致。非还原电泳条件下,在相对分子质量约180×103处出现一条条带,与预期一致。VG2样品条带清晰无杂带,抗体纯化后的纯度达95%以上。
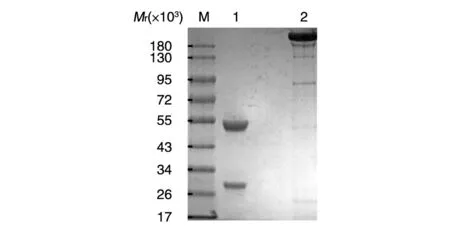
图3 SDS-PAGE鉴定VG2抗体
2.4 VG2抗体与VEGF165结合能力检测
利用梯度稀释ELISA检测VG2抗体与VEGF165的结合能力。将VG2抗体进行1/3梯度稀释,然后与VEGF165结合,采用鼠抗人单克隆抗体(HRP标记)检测二者的结合情况。结果表明VG2抗体能与VEGF165结合,呈剂量依赖关系。经GraphPad Prism绘制抗原抗体结合曲线(图4),VG2抗体与VEGF165抗原结合的半数效应浓度(EC50)为6.455 ng/mL。
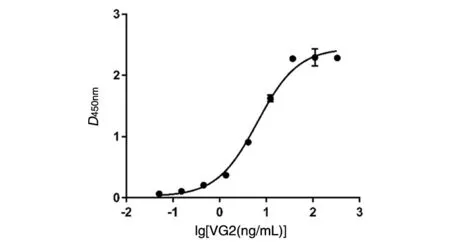
图4 ELISA检测全抗体结合曲线
2.5 竞争ELISA检测VG2抗体的功能
ELISA检测VG2阻断VEGF165与VEGFR结合的能力。将VG2抗体进行1/3梯度稀释,然后与VEGFR混合,将混合液加入包被VEGF165的ELISA板中,用抗His标签鼠单抗(HRP标记)检测VG2抗体的抑制能力。结果表明,VG2抗体能够抑制VEGF165与VEGFR的结合,且呈剂量依赖关系。GraphPad Prism绘制竞争抑制曲线(图5),VG2抗体的半数抑制浓度(IC50)为1.470 μg/mL。

图5 竞争ELISA检测全抗体结合曲线
2.6 BIAcore检测VG2抗体的亲和力
采用表面等离子体共振(surface plasmon resonance,SPR)检测VG2抗体的亲和力。将VG2抗体捕获至CM5芯片表面,然后将不同浓度的VEGF165蛋白流经芯片表面,用Biacore Evaluation Software进行拟合,获得VG2抗体的KD值。结果表明,VG2抗体与VEGF165蛋白有很强的结合能力,KD=0.56 nmol/L(图6)。

图6 Biacore检测VG2抗体的亲和力
2.7 HUVEC增殖抑制检测VG2抗体的功能
HUVEC主要用于研究血管生成相关功能实验。VEGF165作用于HUVEC,可引起该细胞的增殖,因此可以利用该模型评价VG2抗体的功能。将HUVEC接种于细胞培养板中,过夜培养,向细胞中加入不同浓度的VG2抗体与VEGF165混合液,在5%CO2培养箱中继续培养72 h,用CCK8法检测HUVEC的增殖水平。结果显示,VG2抗体能够阻断VEGF诱导的HUVEC的增殖,IC50=76.6 μg/mL(图7)。
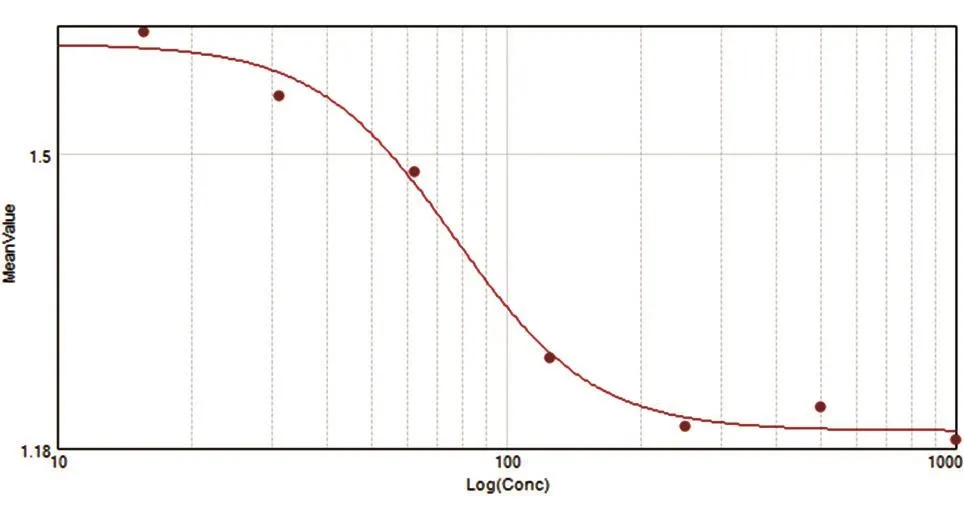
图7 HUVEC增殖抑制曲线
3 讨论
本研究成功地筛选出靶向VEGF165的全人源单克隆抗体VG2并制备了该抗体。功能实验表明,该抗体具有较高的亲和力,能阻断VEGF/VEGFR2的结合,抑制HUVEC的增殖,为肿瘤治疗提供基于该靶点的候选抗体药物。
建库之初选择常规PCR方法,预先混合体系,扩增scFv,电泳条带偏暗,扩增量较低。为使scFv的装配更加高效,维持原VH与VL的比例,而把添加引物的时机选择在2~3轮循环之后,改进后产量大幅提升。通过点突变得到的合成库的库容相较天然库的数量级小了很多,但应用性更强,小范围较大概率地筛选出有亲和力的抗体序列,节省了多轮筛选的时间。此外,库容的丰度与大小也应取决于抗体基因片段的多样、载体的质量及转化细胞的质量和数量,如抗体重链和轻链的独立克隆可使文库中的组合多样性最大化。
已有研究表明,肿瘤细胞主要通过VEGF/VEGFR通路,在肿瘤内部产生大量血管,为肿瘤生长提供氧气和营养物质。根据目前已发现的通路机制,针对VEGF靶点研制的常见抗体药物有贝伐单抗(Bevacizumab)、雷珠单抗(Ranibizumab)、雷莫卢单抗(Ramucirumab)、阿柏西普(Aflibercept)、康柏西普(Conbercept)等。其中单克隆抗体药物贝伐单抗(商品名Avastin)是由罗氏子公司基因泰克(Genetech)研制的一种重组人源化单克隆抗体,也是最早用于临床的血管生成抑制剂,于2004年被美国食品药品管理局(FDA)批准用于治疗转移性结直肠癌,后逐渐用于治疗转移性结直肠癌、非鳞状非小细胞肺癌、复发性胶质母细胞瘤、宫颈癌、卵巢癌、乳腺癌等多种类型的癌症及特定眼病[6-9]。
有多种文献报道,抗VEGF药物与其他药物的联用对增强药效有一定帮助,作用机理更为复杂,有待进一步探究。多种药物配合使用以达到预期治疗效果是未来的方向,随着VEGF/VEGFR通路机制的渐渐清晰,利用计算机更加精准地辅助药物设计、预测抗体结构,将会有更多的抗体药物面世,为患者带来希望。

