亚甲基蓝与DNA链结合的太赫兹光谱研究
李早霞,衣文索,颜识涵,王化斌
(1.长春理工大学 光电工程学院,长春 130022;2.中国科学院重庆绿色智能技术研究院,重庆 400714)
脱氧核糖核酸(DNA)是由两条链(由核苷酸组成)组成的分子,它们彼此缠绕以形成双螺旋结构,携带着生物生长、发育和繁殖的遗传指令。目前生物体内与药物作用的三种主要靶向分子分别为酶、受体及核酸,其中以酶和受体为靶的药物设计开始较早,而以核酸为靶的药物研究则起步较晚[1]。研究DNA与药物小分子之间的相互作用将有助于理解某些药物分子对DNA复制及转录的影响[2];有助于阐明一些致癌物质或者一些抗肿瘤、抗病毒药物的作用机制,帮助人们了解某些疾病的发病机制和药物的治病机理;有助于发现和筛选新型小分子药物。
目前,已经有许多技术用于研究小分子与DNA之间的相互作用,如光谱方法、电泳和电化学方法、核磁共振技术和微量热法等[3]。其中光谱方法如荧光光谱、红外光谱、拉曼光谱等作为物理方法,具有良好的应用前景。这些技术的开发和发展促进了新药的发现,并在临床治疗的研究和应用方面取得了很大进展。但荧光光谱需要标记分子,可能会导致观察到的现象中包含非目标分子信息[4];而红外光谱主要反应官能团的信息,对分子整体构象变化不敏感,不适用于非共价键结合模式;拉曼光谱由于需要激光激发,极易导致被测样品的损坏,影响测试的准确性[5]。因此,不断研究新型检测技术是发展药物开发的必要手段。开发快速、灵敏的技术来研究DNA和药物之间的相互作用,可以为进一步加快药物开发的过程提供技术支持。
基于飞秒脉冲激光的太赫兹时域光谱检测技术能够做到对待测对象高灵敏、无损伤的检测。太赫兹波通常是指频率范围在0.1THz~10THz内的电磁波,其在电磁波波谱中介于微波和红外辐射之间,处于由电子学向光子学过渡的区域。很多生物大分子的振动和转动能级以及晶体中晶格的振动吸收均对应于太赫兹波段。药物小分子与DNA相互作用的主要作用模式之一是非共价键结合,太赫兹光谱能够表征非共价键作用,包括分子内和分子间的振动和转动能级、氢键和范德华力[6],所以太赫兹光谱在检测小分子药物方面具有很大潜力。在被测对象的不同状态和反应过程中,通过分析太赫兹波段内独特指纹特征的变化,可以研究化学和生物分子、化合物的构象和结构动力学信息。
亚甲基蓝(MB)已被证明通过非共价键作用与DNA发生强烈相互作用[7]。MB首先由Heinrich Caro于1876年制备,它是一种化学式为C16H18N3SCl的杂环芳香族化合物,已被广泛用于生物和化学领域[8]。实验以亚甲基蓝为例,测试了其单组分及与双链DNA(来源于玉米基因组DNA)及单链DNA(来源于鲑鱼精)物理混合和溶解结晶的太赫兹光谱。当MB与双螺旋DNA以溶解结晶的方式结合后,水合MB的特征吸收峰消失;而简单的物理混合则不会造成这一现象。MB水合物光谱中太赫兹特征吸收峰的保留或消失表明了物理或化学变化的差异。以此可以确定药物小分子与DNA是否发生了相互作用。
1 实验
1.1 样品制备
亚甲基蓝水合物(CAS号7220-79-3)和单链DNA(CAS号438545-06-3)购自Aladdin(中国上海)。实验中其它所用溶剂均购自SCR(中国上海)。快速DNA提取试剂盒购自天根生化科技(北京)有限公司。亚甲基蓝水合物及无水合物参照报道的重结晶方法制备[8]。双链DNA来源于参照标准方案从玉米叶组织中纯化的基因组DNA。物理混合物的获得是通过使用涡旋混合器在玻璃小瓶中以质量比为1∶1的比例轻轻混合。溶解结晶是通过在不同材料比例的H2O水溶液中37℃重结晶,随后在室温和高湿环境下暴露24小时以上。然后使用手动压片机压制直径为15.0mm,厚度为约1.0mm的样品进行测量。
1.2 太赫兹光谱仪
太赫兹时域光谱技术(Terahertz time-domain spectroscope,THz-TDS)是利用太赫兹脉冲在样品表面发生反射或透射过样品后所产生的太赫兹时域信号,然后经过傅里叶变换获得频域上的振幅及相位的变化[9]。
实验使用Picometrix T-ray 5000光纤耦合光谱仪(Advanced Photonix,Inc.,MI,USA)以透射模式进行太赫兹光谱测量。光谱仪使用飞秒激光脉冲和LT-InGaAs光电导天线来生成相干探测时域系统中超短太赫兹脉冲电场。T-ray 5000装置原理图如图1所示,飞秒脉冲激光器发出的激光(中心波长1064nm,重复频率100MHz)经过激光分束镜分为两路,一路为泵浦激光,另一路为探测激光。泵浦激光激发光电导发射天线辐射出太赫兹波,然后太赫兹波经左右对称的一对高阻硅透镜后照射到光电导探测天线。在此过程中,通过光学延迟线改变探测激光和泵浦激光之间的光程差实现时域等效采样而得到完整的太赫兹时域信号[10]。对太赫兹时域波形进行傅里叶变换可以得到该电磁脉冲在频率域的分布。
太赫兹光谱测量环境均在温度21.0±0.4℃,相对湿度<2.0%条件下进行。
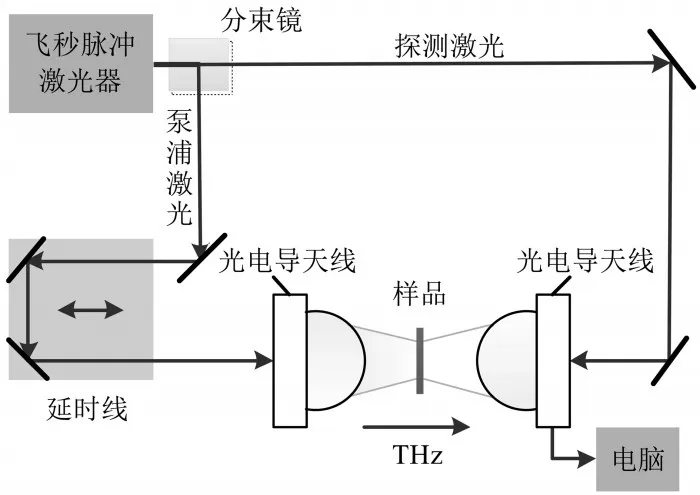
图1 T-ray 5000装置原理图
2 结果与讨论
2.1 亚甲基蓝的太赫兹光谱特征
水合是水分子在物质中存在的一种重要形式,分子的水合常常会引起其物质性质的变化。五水MB及无水MB在0.2~2.0THz的太赫兹吸收光谱显示如图2所示,MB五水合物的太赫兹吸收光谱在位于0.85THz和1.62THz有明显的特征吸收峰;而无水MB在测量光谱范围内则没有发现特征吸收峰。
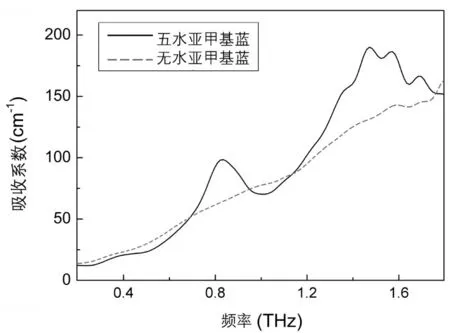
图2 亚甲基蓝的太赫兹光谱特征
结果表明MB五水合物和MB无水合物的太赫兹吸收特征与MB分子的结晶状态及相互作用有关。在咖啡因的太赫兹光谱中也观察到由结晶水变化及分子相互作用改变引起的太赫兹吸收光谱的差异[11]。
2.2 亚甲基蓝与DNA不同结合方式下的太赫兹吸收光谱
小分子药物与DNA的特异性结合,在基因表达的调控过程及很多抗癌药物的体内作用方式的研究中非常重要[1]。为了获得小分子药物MB与DNA不同结合方式下的太赫兹吸收光谱,实验又分别测试了五水MB和DNA在溶解结晶和物理混合状态下的太赫兹光谱,结果如图3所示。溶解结晶的太赫兹吸收光谱失去了0.85THz和1.62THz频率下的特征吸收峰,而在物理混合物和单个组分中均存在这两处频率下的吸收峰。因为物理混合后MB与DNA分子间作用的距离还不足以达到产生非共价键结合,所以保留了各自的特征吸收峰;而溶解能帮助分子间产生非共价键结合,使得表征MB原构象特征的特征吸收峰消失。MB水合物光谱中太赫兹特征吸收峰的保留或消失表明了物理或化学变化的差异。以此可以确定药物小分子与DNA是否发生了相互作用。
有研究表明,单链DNA在分子力学性质、吸收光谱、碱基反应性质等方面都和双链DNA不同[12]。实验又分别对五水MB和单、双链DNA进行了太赫兹光谱检测。图3(a)表明检测MB水合物与单链DNA无论物理混合或是溶解后再结晶,其产物的太赫兹吸收光谱中都包含两个特征吸收峰;图3(b)表明检测MB水合物与双链DNA的物理混合物时,这些太赫兹光谱特征仍然存在。而检测MB水合物与双链DNA结合形成的溶解结晶时,MB水合物太赫兹吸收光谱中的吸收峰消失。物理混合后由于各组分间空间距离不足以引发物质间相互作用,混合物的光谱特征源于各组分各自信息的叠加[13],MB与DNA物理混合同MB水合物的太赫兹特征吸收峰位置基本相同;而溶解可提供各组分发生相互作用的条件,但MB与单链DNA溶解结晶后依然具有同MB水合物相同位置的太赫兹特征吸收峰,说明这个体系内的MB水合物未发生构象变化,而与双链DNA溶解结晶后特征吸收峰消失说明MB同双链DNA发生了反应。溶液中,MB与双链DNA发生非共价键结合[14]。MB与双链DNA两者的相互作用会引发MB水合物构象的变化,使其失去了原本的太赫兹特征吸收峰。
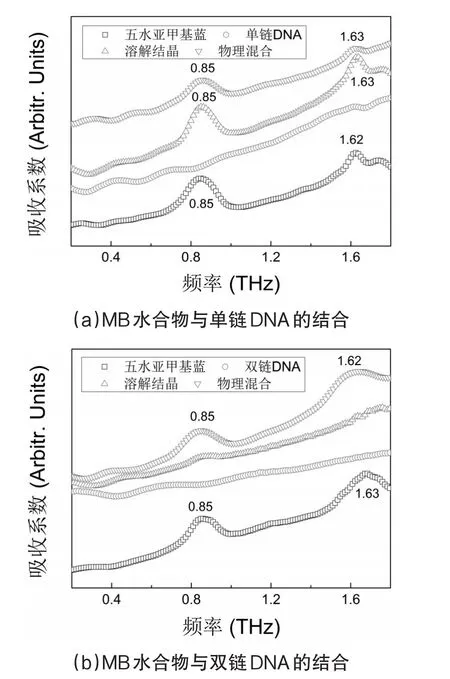
图3 MB水合物与DNA相互作用的太赫兹吸收光谱
众所周知,共结晶是由于两种或多种不同组分分子之间的分子间氢键、非离子键或其他非共价键相互作用而产生的。MB可以与双链DNA相结合,该结果意味着形成的共结晶改变了MB的组成和分子间或分子内的相互作用,这与单亲组分的晶格显著不同。因此,在这些光谱中观察到的特征吸收峰的消失是由于分子间非共价键结合使得MB水合物失去了原有的光谱特征。
2.3 亚甲基蓝与DNA不同浓度结合的太赫兹吸收光谱
太赫兹吸收光谱特征吸收峰振幅的高低可以反应对应物质的量的多少,图4是DNA与MB在1∶1、2∶1、4∶1这三种浓度比例下,对溶解后的析出物的检测结果。

图4 DNA与MB不同浓度比例的结合
图4(a)中是单链DNA与MB不同浓度比例的混合。由图中可以看出,单链DNA与MB以1∶1浓度混合时,太赫兹特征吸收峰的峰值最大,随着DNA与MB浓度比例的增大,相应的特征吸收峰的相对高度明显降低。MB与单链DNA混合降低了检测物中MB的相对含量,使得特征吸收峰降低。图4(b)是双链DNA与MB不同浓度比例的结合,由图3已经知道,MB水合物与双螺旋DNA结合会使其失去特征吸收峰。MB水合物与双螺旋DNA浓度比例在4∶1、2∶1的时候没有特征吸收峰,可以判断MB已反应完全;浓度比例的结合是1∶1的时候还存在一个小的吸收峰,是由于还有部分MB水合物没有结合完,所以留存了部分痕迹。说明这种双链DNA与MB反应完全的浓度比例在1∶1和2∶1之间。
3 结论
通过采用太赫兹吸收光谱法检测亚甲基蓝(MB)与双螺旋DNA之间的相互作用,提供了利用太赫兹光谱检测小分子药物的实例。MB水合物与单链DNA溶解结晶后由于未发生相互作用反应,没有导致MB构象的变化;伴随着与双链DNA溶解结晶后造成的MB构象的变化,MB水合物的太赫兹光谱特征峰消失。说明可以通过监测反应物与产物太赫兹吸收光谱的变化判断小分子药物与DNA是否发生了相互作用,为筛选小分子药物提供了一种无标记检测新方法。

