放线菌LG-9发酵液对棉花黄萎病菌的抑菌活性及防效测定
陈明,穆凯热姆·阿卜来提,刘政,王晓东*
(1 石河子大学农学院/新疆绿洲农业病虫害治理与植保资源利用自治区高校重点实验室,新疆 石河子 832003; 2 新疆农垦科学院植物保护研究所,新疆石河子 832003)
棉花黄萎病是由大丽轮枝菌(VerticilliumdahliaKleb.)引起的土传性维管束系统病害。大丽轮枝菌具有寄主范围广泛、传播速度快、抗逆性强和变异性大等特点[1],该病一旦发生,棉田轻者减产30%左右,重者达到50%以上,甚至绝收[2]。20世纪90年代以来,由于常年连作和秸秆还田等原因[3],新疆棉花黄萎病危害逐年加重。目前,国内外防治棉花黄萎病主要以选育抗病品种、农业防治和化学防治等综合措施[4-6]。选育抗病品种是防治棉花黄萎病最有效的措施之一,但因高抗种质资源缺乏、选育周期长、病菌致病力变异大,棉花抗性极易丧失等原因,致使育种工作进展缓慢[7]。棉花黄萎病属维管束病害,病程较长,且病菌易形成抗逆性很强的微菌核,化学药剂防治效果欠佳[8]。目前,尚无根治棉花黄萎病的理想药剂。生物防治能减少化学药剂的使用,避免环境污染,且对有益微生物无影响,符合现代绿色农业发展的要求,是棉花黄萎病防治的一条较为理想的途径。
国内外学者已研究表明利用真菌[9]、细菌[10]、放线菌[11-12]能较好的拮抗棉花黄萎病菌。其中,放线菌是广泛存在于自然界中的微生物种群,能产生功能多样的次级代谢物质,具有巨大的利用价值,在防治土传真菌病害中有其特有的优势,取得了很好的效果[13]。柳成斌[14]报道拮抗放线菌发酵液可以通过抑制菌落生长、分生孢子萌发来抑制黄萎病菌的生长繁殖,并对棉花黄萎病有很好的田间防治效果。另有研究[15]表明拮抗菌可以诱导大丽轮枝菌超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和多酚氧化酶(PPO)酶活的降低,并使大丽轮枝菌膜脂过度氧化,丙二醛(MDA)含量升高,病原菌质膜的完整性被破坏。拮抗放线菌发酵液对棉花黄萎病菌的抑菌作用及田间防效报道总体上较少。
本实验室前期筛选出一株对棉花黄萎病原菌有抑菌效果的放线菌菌株LG-9,经平板对峙测定,证明菌株LG-9对棉花黄萎病菌具有显著的抑制作用。本研究以放线菌LG-9为对象,测定其发酵粗提液对棉花黄萎病菌菌丝生长、产孢量、孢子萌发和抗氧化相关酶活性的影响,为安全有效防治棉花黄萎病及揭示放线菌LG-9对黄萎病菌的抑菌作用机制提供理论依据。
1 材料与方法
1.1 材料
1.1.1 供试菌株
供试放线菌菌株LG-9和棉花黄萎病菌菌株301-3由石河子大学农学院植物病理实验室提供。
1.1.2 供试培养基
高氏1号培养基:可溶性淀粉20 g、KNO31 g、K2HPO40.5 g、MgSO4·7H2O 0.5 g、NaCl 0.5 g、FeSO4·7H2O 0.01 g、琼脂粉15 g、蒸馏水1 L,pH 7.2。以不加琼脂粉为高氏1号培养液。
小米培养基:小米10 g、葡萄糖10 g、蛋白胨3 g、NaCl 2.5 g、CaCO32.5 g、蒸馏水1 L,pH7.2。
马铃薯琼脂葡萄糖培养基(Potato Dextrose Agar,PDA)、马铃薯琼脂葡萄糖培养液(Potato Dextrose Broth,PDB)和查氏培养液参考方中达[16]方法制备。以上培养基均121 ℃灭菌30 min。
1.1.3 供试棉花种子
棉花品种为新陆早60,由新疆农垦科学院棉花所提供。
1.2 方法
1.2.1 菌株活化及发酵粗提液的制备
将保藏的菌株LG-9接种于高氏1号培养基上,28 ℃活化4 d,挑取菌丝块接种于装有100 mL高氏1号培养液的250 mL三角瓶中,160 r/min、28 ℃振荡培养4 d,制备种子液。按6%的比例接种到装有100 mL小米培养基的250 mL三角瓶中,于160 r/min、28 ℃振荡培养3 d,经1×104r/min离心20 min,取其上清液经无菌微孔滤膜(孔径0.45 μm)过滤,过滤液为发酵粗提液,于4 ℃冰箱中保存备用。用于田间防效试验的LG-9发酵滤液,不经离心和过滤处理。
1.2.2 棉花黄萎病菌孢子悬浮液制备
将棉花黄萎病菌菌株301-3接种到PDA培养平板上,28 ℃培养7 d后,挑取豆粒大小的菌丝块,接种于PDB中,28 ℃、振荡培养3 d后,用4层无菌纱布过滤,在生物显微镜下借助纽鲍尔血球计数板,将棉花黄萎病菌分生孢子液配制成1×108CFU/mL,备用。
1.2.3 发酵粗提液对棉花黄萎病菌菌落生长的影响
将一定量发酵粗提液与冷却至45 ℃左右的PDA培养基充分混匀,发酵粗提液在培养基中稀释终浓度分别为5、25、50、100和250倍,倒入培养皿,每皿25 mL,待培养基晾干后备用。用直径7 mm的无菌打孔器在28 ℃、培养7 d的棉花黄萎病菌菌落边缘打孔,制备菌饼。挑取黄萎菌菌饼置于含有发酵粗提液的PDA平板中央,以含无菌水的PDA平板作为对照,每个处理重复3次。28 ℃培养6、8、10、12、14 d后,采用十字交叉法测量菌落生长量。按如下公式计算菌落生长抑制率:
1.2.4 发酵粗提液对棉花黄萎病菌产孢量的影响
将1.2.3中培养14 d的菌落用7 mm的无菌打孔器沿菌落边缘打孔,将不同处理的10片菌饼放入离心管中,用无菌水清洗菌落表面,定量孢子液为10 mL。借助纽鲍尔血球计数板在生物显微镜下观察,测定分生孢子液的浓度,计算产孢抑制率。以不加发酵粗提液的棉花黄萎病菌培养平板为对照。每个处理重复3次。产孢抑制率计算公式如下:

1.2.5 发酵粗提液对棉花黄萎病菌分生孢子萌发的影响
先将发酵粗提液用PDB分别进行稀释,稀释终浓度为5、25、50、100和250倍,分别吸取100 μL 1×108CFU/mL黄萎病菌孢子悬浮液加入到1 mL稀释液中。然后吸取100 μL不同稀释倍数处理的的孢子悬液放置于无菌凹玻片上,将凹玻片放置于底部置有湿润滤纸的培养皿中,28 ℃恒温培养箱中静置培养18 h,生物显微镜下用纽鲍尔血球计数板随机观察100个孢子,统计萌发孢子数,计算分生孢子萌发抑制率。以分生孢子萌发出的芽管长度超过孢子短直径一半时即判为孢子萌发,否则为未萌发,以不加发酵粗提液的PDB为对照。每个处理重复3次。计算公式如下:
1.2.6 发酵粗提液对棉花黄萎病菌抗氧化功能的影响
1.2.6.1 棉花黄萎病菌预处理
将棉花黄萎病菌菌落用7 mm的无菌打孔器沿边缘打孔,挑取菌饼接种于査氏培养液中,28 ℃、180 r/min恒温振荡培养3 d,每100 mL査氏培养液中接入5 mL黄萎病菌孢子悬浮液,180 r/min,28 ℃培养72 h。离心收集菌体,用0.1 mol/L PBS(pH7.4)清洗3次,转接入含LG-9发酵粗提液5倍稀释液的査氏培养液中继续培养(以添加蒸馏水为对照)。取培养0、6、12、18和24 h的菌液,离心收集菌体,0.1 mol/L PBS清洗3次,-80 ℃冷冻后备用。
1.2.6.2 棉花黄萎病菌酶液的提取
取出冷冻的菌体称重后,加液氮研磨,按重量(g)∶体积(mL)为1∶9的比例加入生理盐水悬浮,制备棉花黄萎病菌粗酶液。
1.2.6.3 测定指标
测定SOD、CAT、PPO和MDA具体试验操作和计算方法采用由南京建成生物工程研究所购买的试剂盒内说明书进行。
菌体粗酶液中蛋白浓度测定:取3支试管,标记为空白管、标准管和测定管,分别加入双蒸水、0.563 g/L蛋白标准品和粗酶液50 μL后,每管加入考马斯亮蓝显色液3 mL,混匀,静置10 min,波长595 nm,双蒸水调零,测定各管吸光度值(ΔA=A测定-A空白;ΔA1=A标准-A空白),按公式计算。粗酶液蛋白浓度(g/L)=ΔA/ΔA1×蛋白标准品浓度。
SOD测定:取2支试管,标记为测定管和对照管,各加入SOD试剂盒提供的试剂1应用液1 mL、试剂2、试剂3和试剂4各0.1 mL,然后测定管加入50 μL粗酶液,对照管加入50 μL双蒸水,旋涡混匀,37 ℃恒温水浴40 min后,测定管和对照管各加入2 mL显色剂,混匀,室温放置10 min,波长550 nm,双蒸水调零,测定各管吸光度值(ΔA=A对照-A测定),按公式计算。SOD活力(U/mgprot)=(ΔA/A对照)/50%×反应体系稀释倍数/粗酶液蛋白浓度(mgprot/mL)。
CAT测定:测定管和对照管各加入CAT试剂盒提供的试剂1(37 ℃预温)1 mL、试剂2 0.1 mL,测定管加入50 μL粗酶液混匀,37 ℃反应1 min后,各管加入试剂3 1 mL,试剂4 0.1 mL,对照管加入50 μL粗酶液,混匀,波长405 nm,双蒸水调零,测定各管吸光度值(ΔA=A对照-A测定),按公式计算。CAT活力(U/mgprot)=ΔA×271×0.33/粗酶液蛋白浓度(mgprot/mL)。
PPO测定:测定管和对照管先后加入PPO试剂盒提供的缓冲液0.6 mL,基质液0.15 mL,测定管加入粗酶液100 μL,对照管加入煮沸处理的粗酶液100 μL,37 ℃恒温反应10 min后,立即90 ℃水浴5 min,取出后流水冷却,1×104r/min,离心10 min,取上清于波长420 nm,双蒸水调零,测定各管吸光度值(ΔA=A测定-A对照),按公式计算。PPO活力(U/mgprot)=ΔA/0.01×0.6×(1/反应液总体积)/反应时间/粗酶液蛋白浓度(mgprot/mL)。
MDA含量测定:取4支试管,标记为标准管、测定管、空白管和对照管,各管加入MDA试剂盒提供的试剂1 100 μL,空白管和标准管分别加入无水乙醇100 μL和10 nmol/mL标准品100 μL,测定管和对照管加入粗酶液100 μL,混匀后,标准管、测定管和空白管各加入试剂2和试剂3 1.5 mL,对照管加入试剂2和50%冰乙酸1.5 mL,旋涡混匀,95 ℃水浴40 min,取出后流水冷却,然后3500 r/min,离心10 min,取上清于波长532 nm,双蒸水调零,测定各管吸光度值(ΔA=A测定-A对照;ΔA2=A标准-A空白),按公式计算。MDA含量(nmol/mgprot)=ΔA/ΔA2×10/粗酶液蛋白浓度(mgprot/mL)。
1.2.7 田间防效测定
1.2.7.1 黄萎病菌麦粒培养物制备
将清洗过的小麦在水里浸泡24 h,使其膨胀,取出放在报纸上30 min晾干,将棉籽壳浸泡30~60 min,和小麦混合均匀,装入培养袋,100 ℃灭菌120 min备用。无菌条件下接种棉花黄萎病菌孢子悬浮液于麦粒培养基中,室温条件下培养1个月。
1.2.7.2 防效试验
放线菌LG-9对棉花黄萎病的田间防效试验于2016年5—10月,在石河子大学试验站进行,播种时间为5月3日。处理组播种前棉种用LG-9发酵粗提液5倍稀释液浸种18 h,对照组棉种用清水浸泡相同时间。播种前将培养好的黄萎病菌麦粒培养物均匀撒入播种行土壤以下5 cm,之后用土覆盖。每个处理播种5 m长,1膜2行,行间距40 cm,株间距10 cm,重复3次,用手点播。当棉苗长至2~3片真叶时,处理组用LG-9培养滤液灌根处理,每株50 mL,1周1次,共3次,对照组用自来水处理。棉田常规水肥管理,直到收获前15 d。播种150 d后剖杆调查棉株发病情况。依据黄萎病在棉花植株上发病情况的分级标准进行调查,0级:正常,横切面无褐色斑点;1级:横切面有零星褐色斑点,所占面积在25%以下;2级:褐色面积占横切面的25~50%;3级:褐色面积占横切面的50~75%;4级:褐色面积占横切面的75%以上,横切面几乎全变褐色。计算公式:
发病率(%)=发病株数/调查株数×100%


1.2.8 数据统计与分析
试验数据利用Microsoft Excel进行处理,采用SASS19.0统计软件中的方差分析程序进行差异显著性分析。比较处理之间的差异采用Duncan氏新复极差法(P<0.05)。
2 结果与分析
2.1 发酵粗提液对棉花黄萎病菌菌落生长的影响
如图1所示,不同稀释倍数的发酵粗提液对大丽轮枝菌菌落生长均有抑制作用,但随着发酵粗提液稀释倍数的增加,抑制率逐渐降低。5倍稀释液抑制作用最强,培养8 d时,菌落生长抑制率最大,为76.77%,培养到第14 d时,抑制率仍可保持在67.36%。250倍稀释液抑制菌落生长效果最差,抑制率不足10%。
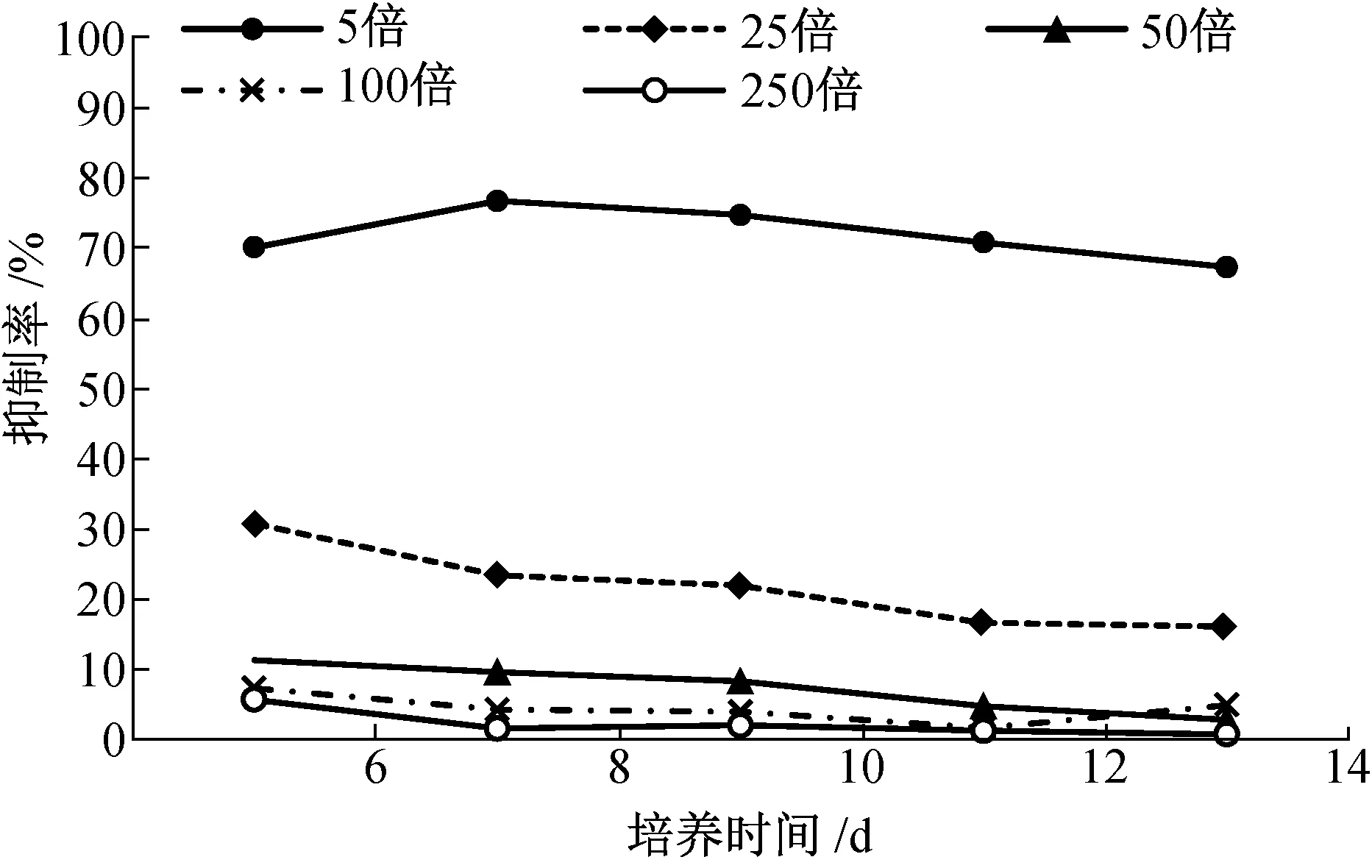
图1 LG-9发酵液对黄萎病菌菌落生长的影响Fig.1 The inhibition effect of the LG-9 fermentation liquid on V.dahliae mycelia growth
2.2 发酵粗提液对棉花黄萎病菌产孢量的影响
由图2可知,不同稀释浓度的放线菌菌株LG-9发酵粗提液均不同程度抑制棉花黄萎病菌产生分生孢子。5倍稀释液对棉花黄萎病菌孢子形成抑制作用最明显,抑制率为84.35%。50倍稀释液抑制率最小,为35.41%,与100倍和250倍发酵粗提液抑制率差异显著。
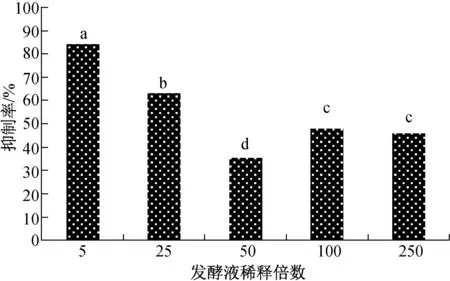
图2 LG-9发酵液对黄萎病菌产孢量的影响Fig.2 The inhibition effect of the LG-9 fermentation liquid on V.dahliae sporulation quantity
2.3 发酵粗提液对棉花黄萎病菌孢子萌发的影响
由图3可知,发酵粗提液随着稀释倍数的增加,对分生孢子萌发的抑制率呈现降低的趋势。5倍稀释液的抑制率最大,为80.00%,250倍稀释液的抑制率最低,为26.15%。由此说明,不同稀释倍数的发酵粗提液均能够对大丽轮枝菌的孢子萌发产生抑制作用。
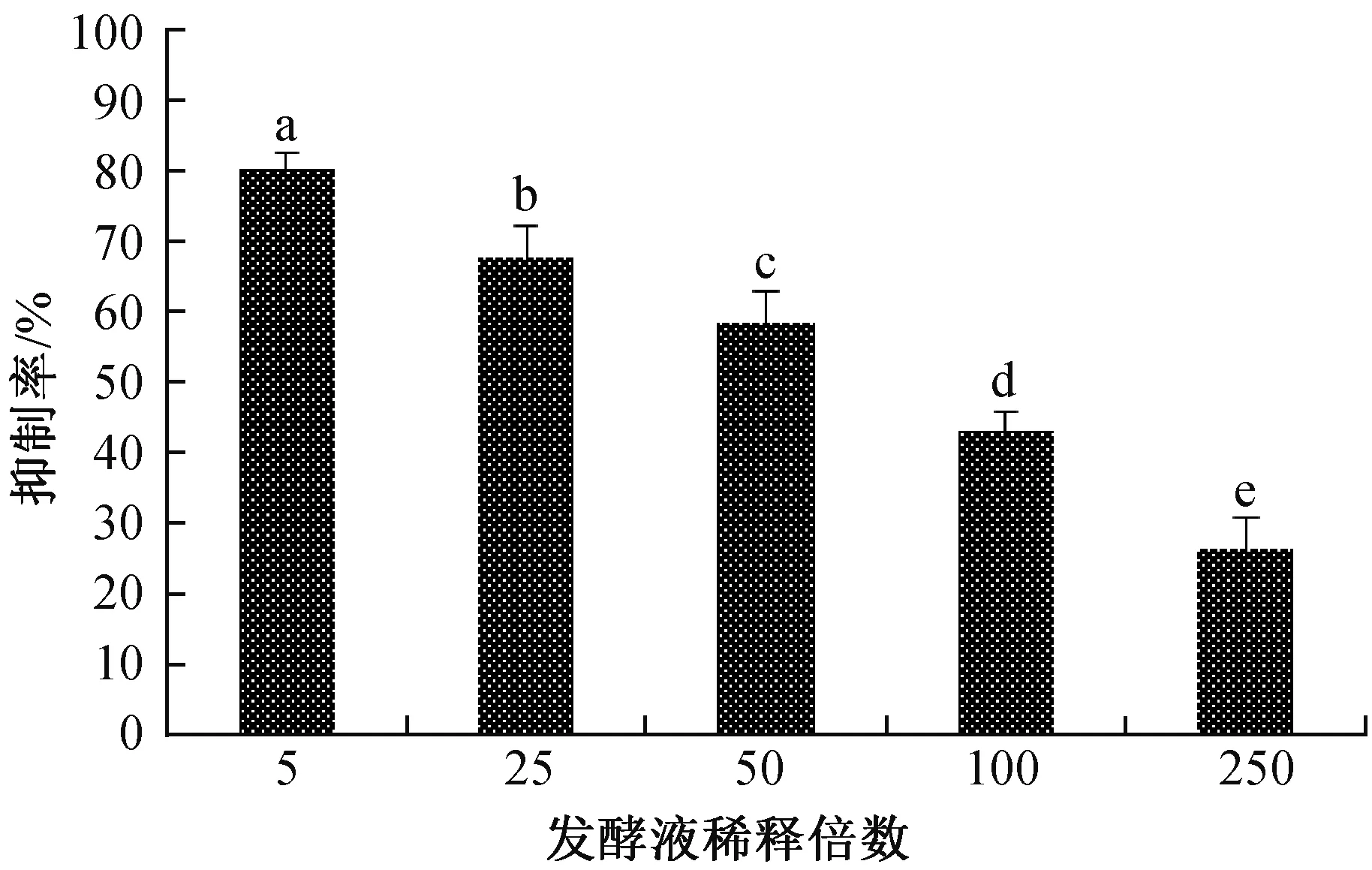
图3 LG-9发酵液对黄萎病菌孢子萌发的影响Fig.3 The inhibition effect of the LG-9 fermentation liquid on the spore germination of V.dahliae
2.4 发酵粗提液对棉花黄萎病菌抗氧化功能的影响
2.4.1 发酵粗提液对棉花黄萎病菌SOD活力的影响
由图4可知,经LG-9发酵粗提液处理棉花黄萎病菌后,除0 h外,各时间点SOD酶活力值均比对照低,且两者间差异显著。在6 h时,棉花黄萎病菌SOD酶活力值最低,处理为0.597 U/mgprot,对照为6.179 U/mgprot。表明LG-9发酵粗提液显著影响棉花黄萎病菌的SOD酶活力。
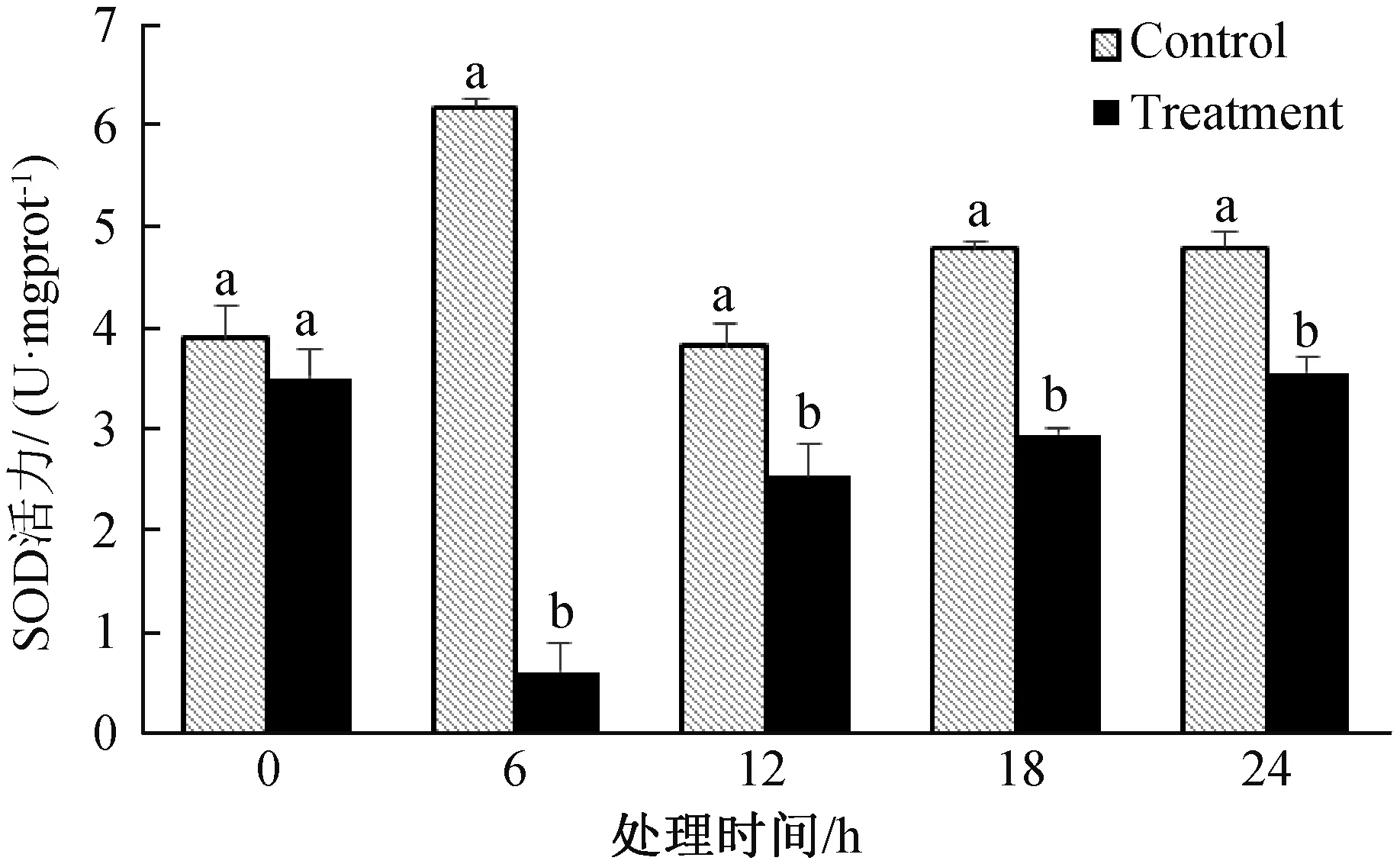
图4 LG-9发酵液对棉花黄萎病菌SOD活力的影响Fig.4 Effect of LG-9 fermentation liquid on SOD activity of V.dahliae
2.4.2 发酵粗提液对棉花黄萎病菌CAT活力的影响
由图5可知,经LG-9发酵粗提液处理棉花黄萎病菌后,随着时间的延长,棉花黄萎病菌CAT酶活力值逐渐下降,18 h后,CAT酶活力值与对照差异显著。24 h时,处理的棉花黄萎病菌CAT酶活力值最低,为0.242 U/mgprot。表明经LG-9发酵粗提液处理棉花黄萎病菌能显著影响其CAT酶的活力。
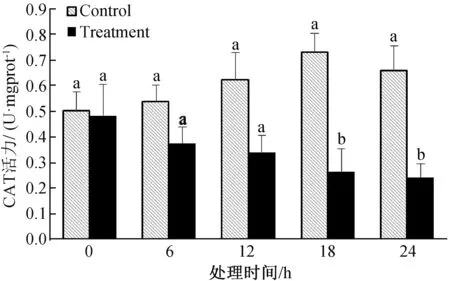
图5 LG-9发酵液对棉花黄萎病菌CAT活力的影响Fig.5 Effect of LG-9 fermentation liquid on CAT activity of V.dahliae
2.4.3 发酵粗提液对棉花黄萎病菌PPO活力的影响
由图6可知,经LG-9发酵粗提液处理棉花黄萎病菌,0~24 h内棉花黄萎病菌PPO酶活力值与对照值略呈正态分布,12 h后,棉花黄萎病菌PPO酶活值随时间延长,呈逐渐下降趋势,且与对照酶活值差异显著。
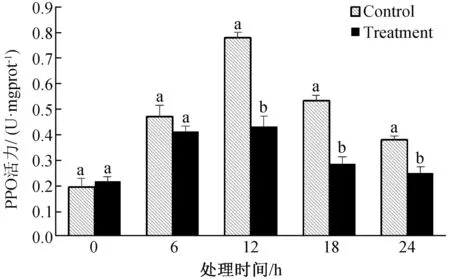
图6 LG-9发酵液对棉花黄萎病菌PPO活力的影响Fig.6 Effect of LG-9 fermentation liquid on PPO activity of V.dahliae
2.4.4 发酵粗提液对棉花黄萎病菌MDA含量的影响
由图7可知,对照组和处理组棉花黄萎病菌培养至6 h,MDA的含量有所增加。12 h后,两组棉花黄萎病菌MDA含量大幅减少,对照组显著低于处理组,18 h后,处理组的MDA含量有所增加,为10.566 nmol/mgprot。表明随着LG-9发酵粗提液处理时间的不同,对棉花黄萎病菌膜系统造成的破坏程度不同。
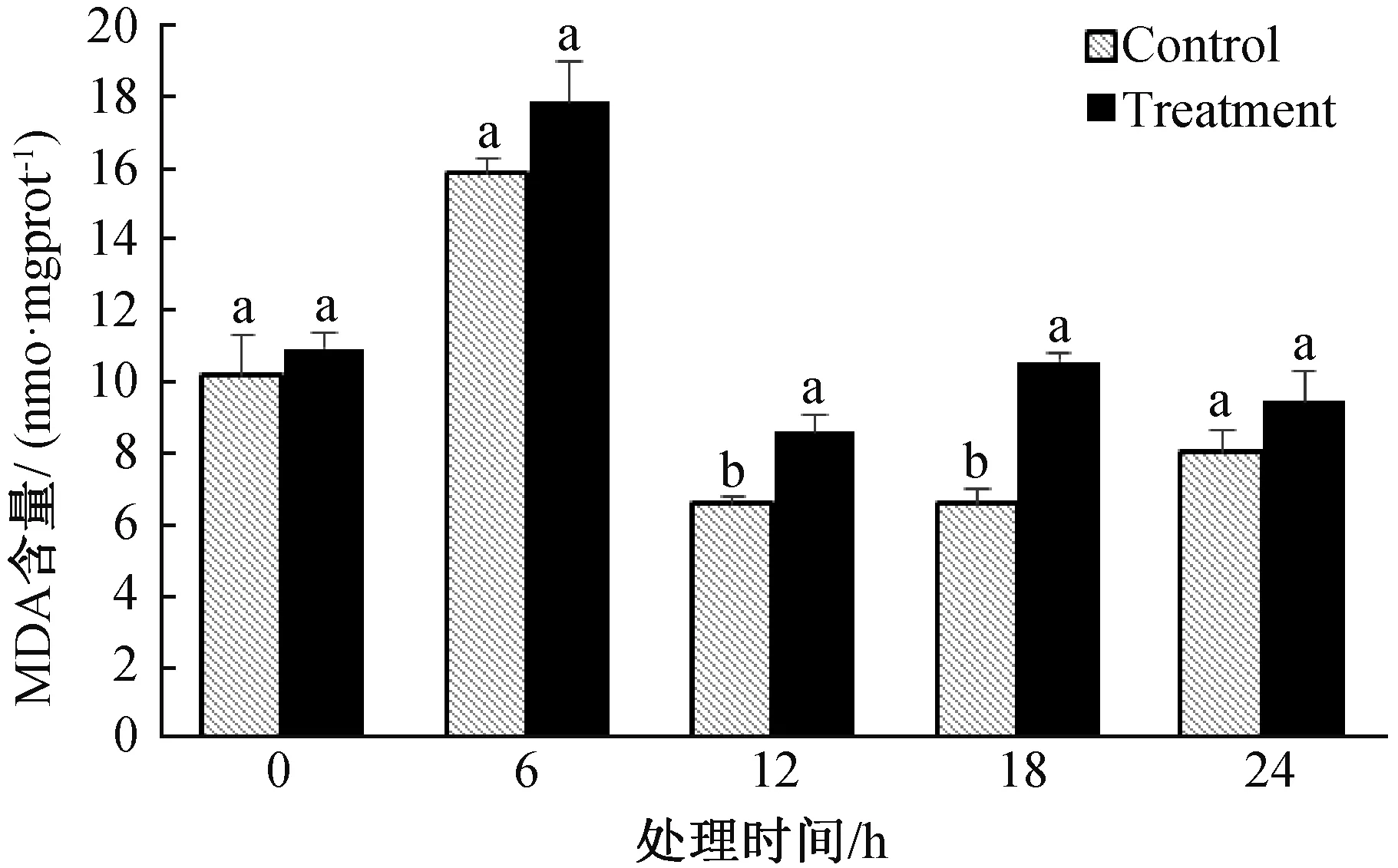
图7 LG-9发酵液对棉花黄萎病菌MDA含量的影响Fig.7 Effect of LG-9 fermentation liquid on MDA content of V.dahliae
2.5 田间防效测定
由表1可知,拮抗菌LG-9对棉花黄萎病有一定生防效果,发酵滤液3次灌根处理,棉株发病率为28.62%,低于对照41.13%,剖杆检查病情指数为12.07,低于对照23.69。在150 d的防效为49.07%。
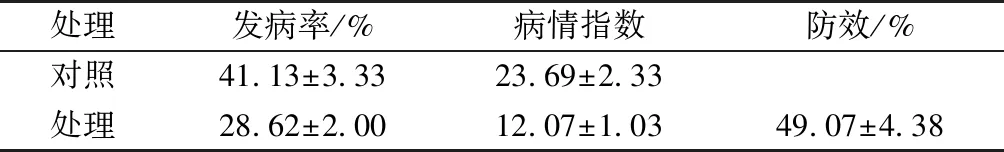
表1 放线菌LG-9防治棉花黄萎病效果测定Tab.1 Biocontrol efficiency of field trials for the control of Verticillium wilt with actinomycetes LG-9
3 结论与讨论
(1)LG-9发酵粗提液对棉花黄萎病菌生长的影响及田间防治效果
本研究结果显示,放线菌菌株LG-9发酵粗提液对棉花黄萎病菌具有显著抑制作用。其中,5倍稀释液抑菌活性最大,对病菌菌丝生长、产孢量和孢子萌发抑制率分别为76.77%、84.35%和80.00%,表明拮抗放线菌菌株LG-9具有控制棉花黄萎病的生防潜力。大丽轮枝菌在土壤中越冬,萌发繁殖后侵染棉株的根尖进入维管束定殖,进而危害整个植株[17]。棉花黄萎病防治困难,主要是因为土壤中的真菌繁殖体和微菌核萌发产生的菌丝能直接侵染棉花的根尖部分,并堵塞维管束组织。Presley等[18]研究发现黄萎病菌侵入棉株后对木质部的侵染主要是由分生孢子介导的,菌丝和分生孢子在侵染植株过程中起着重要的作用。表明对菌丝和分生孢子的抑制活性是拮抗菌对病原菌主要的作用方式之一。柳成宾等[14]筛选出棉花黄萎病菌拮抗放线菌TRM42561,确定其发酵液对棉花黄萎菌菌丝生长抑制率为83.75%,孢子萌发抑制率为68.75%后,进行田间防效试验,发酵液田间灌根处理30 d,通过调查叶片发病情况,得出防效为41.65%。许多研究[19]都是通过叶片发病症状调查棉花黄萎病的发病情况,然而由于环境因素,棉花黄萎病在发病初期症状不易辨别,影响了病害调查的准确性,而且有些棉田在生长末期棉株发病率在80%以上,发病情况更严重[20],通过生长末期解剖棉株茎秆调查能更好反应植株的发病情况。本试验通过解剖茎秆法调查棉株的发病情况,得出放线菌LG-9培养滤液3次灌根处理,到棉株收获时,对棉花黄萎病的防效达到了49.07%,能更好的反映出菌株LG-9的生防效果及防效的持久性。
(2)LG-9发酵粗提液对棉花黄萎病菌抗氧化相关酶活力及膜系统的影响
在非生物胁迫下,SOD、CAT,以及PPO在抵抗外界物质刺激,延缓机体衰老方面发挥重要的作用[21]。MDA是细胞膜脂过氧化的终产物,其含量变化能体现出膜系统的受损情况,细胞中MDA含量增加表明细胞在衰老或遇到逆境时细胞质膜的过氧化程度提高,质膜的完整性被破坏[22]。赵君洁[15]发现芽孢杆菌降低了大丽轮枝菌SOD和CAT酶活力,破坏了大丽轮枝菌的脂膜使MDA含量升高,对大丽轮枝菌产生了抑制作用。本研究中,菌株LG-9发酵粗提液诱导了棉花黄萎病菌抗氧化相关酶SOD、CAT和PPO酶活力的降低及MDA含量的升高,破坏了病菌的膜系统。由此表明对病原菌抗氧化酶的影响和细胞质膜的破坏可能是拮抗菌对棉花黄萎病菌的抑菌作用之一。在联合培养0~24 h期间,由于病菌接种初始阶段为适应期,6~12 h后,随病菌的生长繁殖,对照组孢子活力逐渐增强,抗氧化物酶活力随之增强,而处理组因病菌生长繁殖被抑制,抗氧化酶活性低于对照组。培养后期,可能由于病菌进入衰弱期,对照组和处理组黄萎病菌SOD、CAT、PPO活力均降低。拮抗菌对棉花黄萎病菌抗氧化相关酶活力及膜系统影响的研究对拮抗菌的应用有重要的意义。

