陆地棉GhBFT1基因的克隆、表达及亚细胞定位分析
李研,刘慧,黄先忠
(石河子大学生命科学学院,特色植物基因组学实验室,新疆 石河子832003)
植物的磷脂酰乙醇胺结合蛋白(phosphatidyl ethanolamine-binding proteins,PEBP)基因家族,主要起着促进或抑制开花和控制株型的作用。PEBP家族包含MOTHEROFFTANDTFL1(MFT),FLOWERINGLOCUST(FT),TERMINALFLOWER1(TFL1)3个亚家族[1-3],其中,FT和TFL1两个亚家族都是起源于MFT,BROTHEROFFTANDTFL1(BFT)属于TFL1亚家族,大多数植物PEBP家族蛋白含有保守的真核生物特异性区域[4]。目前的研究[5]认为,PEBP蛋白在细胞核中能与一个碱性亮氨酸拉链的转录因子FD蛋白互作,从而抑制花分生组织基因的表达,起着维持无限生长、抑制开花转变的作用。在动物中PEBP蛋白主要是Raf激酶抑制剂的作用。在很多植物中也发现了PEBP蛋白,例如拟南芥、金鱼草、葡萄、白杨树、豆科植物、大麦、番茄、水稻、玉米。
植物中的TFL1亚家族基因成员大多具有相似的基因结构,均由4个外显子和3个内含子构成[6],这说明该基因家族在进化中基因结构较为保守。保守的磷脂酰乙醇胺结构域是FT/TFL1基因家族成员编码的蛋白所共有,因可在体外结合磷脂酰乙醇胺而得名,在动植物体内广泛存在[7-9]。开花是一个复杂的生理过程,受植物内部遗传基因和外部环境因素的共同诱导和调控,其中与开花有关的基因成为调控成花转变的重要遗传因子。在PEBP家族基因中FT亚家族基因和BFT1所在的TFL1亚家族基因共同调控开花转变,目前很多研究显示FT促进开花,TFL1抑制开花。植物在受到逆境胁迫后通常会提前开花,进入生殖生长阶段,因此逆境下调控开花转变十分重要。BFT能够在拟南芥中调控开花就是一条非常重要的途径,有研究[10]表明拟南芥在正常的条件下进入开花转变阶段时,FT就会与FD相互作用来促进AP1的转录,而受到外源高盐胁迫时,BFT就会与FT相互竞争FD来抑制AP1的转录,从而调控拟南芥的开花时间,这一过程需要更多的BFT蛋白,并且在这种高盐胁迫下,BFT基因介导的FT-FD模型,就可以提供合适的保护机制适应光周期途径并促使植物开花[11]。本研究克隆了GhBFT1基因并对其进行生物信息学分析以及亚细胞定位和表达模式的分析,以期为该基因后续研究奠定基础。
1 材料与方法
1.1 材料
本氏烟草(N.benthamiana),棉花新陆早33号品种的不同组织材料:棉花生长1个月的幼苗时期取根部、茎秆、真叶组织,开花时取花瓣、萼片、雄蕊。胚珠材料的取样时间:开花前3天(-3)、开花当天(0)、和花后1、3、5、8、12、16、20天。
1.2 方法
1.2.1 棉花DNA和RNA的提取
选取陆地棉品种新陆早33成熟叶片为材料,液氮速冻后采用CTAB法进行基因组DNA的提取,使用植物RNA提取试剂盒提取棉花总RNA[12]。
1.2.2 陆地棉GhBFT1基因的克隆
根据全基因组分析获得陆地棉BFT1基因的开放读码框(Open reading frame,ORF),使用Primer Premier5.0软件设计好扩增引物(表1)。ORF扩增引物分别为:KpnI-GhBFT1F和BamH I-GhBFT1R,由华大基因公司合成。以提取棉花的DNA为模板,经1%琼脂糖凝胶电泳分离,将大小正确的启动子DNA 片段以快速琼脂糖凝胶DNA回收试剂盒回收并克隆到中间载体pMD18-T上,之后转化DH5α感受态细胞,提取质粒然后经过酶切鉴定。
1.2.3 陆地棉BFT1基因的生物信息学分析
棉花BFT1基因的查找与分析参照魏艳玲等[13]的方法,用MegAlign程序比对分析,得到基因结构完整的CDS序列,并找到最大ORF。测序结果使用DNAstar软件分析,使用Clustal W和GeneDoc等软件对所获得的蛋白氨基酸序列进行比对分析。利用SWISS-MODEL网站对蛋白质三维结构进行预测。利用NCBI网站中的blastn工具,以拟南芥的BFT/TFL1家族基因成员的氨基酸序列,搜索其他物种基因组上的BFT/TFL1家族基因成员,下载序列后,利用MEGA5.1软件对各物种中的BFT/TFL1家族基因编码的氨基酸序列进行系统进化分析,用Neighbor-Joining法构建进化树,1000次重复。
1.2.4 实时荧光定量PCR分析陆地棉GhBFT1基因的表达情况
根据GhBFT1的ORF序列设计基因表达分析的特异引物GhBFT1-RT-F和GhBFT1-RT-R,内参基因使用棉花的Ubiquitin7(GenBanK登录号为DQ116441)基因,引物名称UBQ7-F和UBQ7-R(表1)。参照郑丽洁等[14]采用qRT-PCR来分析基因表达,分析溶解曲线,检测每份样品的目的基因和UBQ7内参基因的Ct值,每种样品进行3次PCR重复,采用2-ΔCt法分析试验数据,先分别计算出每组的ΔCt=Ct目的基因-Ct内参基因,再根据ΔCt值求出2-ΔCt以及标准误,使用t测验进行差异性检验分析,采用Excel2010软件分析数据和作图。

表1 本研究设计引物名称及信息Tab.1 Primers designed and used in this experiment
1.2.5 植物融合表达载体的构建及烟草的转化
以测序正确的pMD18-T∶GhBFT1质粒为模板,PCR扩增去除终止密码子TGA的GhBFT1基因片段,反应体系和程序参照上面的方法。酶切鉴定正确的质粒经测序分析有无发生碱基的改变,将测序正确质粒经KpnI和BamH I双酶切,回收片段,同时用同样的双酶切带有GFP的pCAMBIA2300载体,回收质粒大片段。将以上回收产物连接,连接产物转化DH5α感受态细胞。将构建好的GFP融合表达载体质粒转化至农杆菌GV3101中。
本氏烟草(N.benthamiana)的瞬时转化,选取生长状态良好的烟草进行农杆菌侵染,转化前浇透水,活化带有基因载体的农杆菌,离心收集菌体。配制好悬浊液,室温静置3 h。侵染时注射器吸取菌液在烟草叶片下表面将菌液注射,3~5 d后切取注射部位在激光共聚焦显微镜下观察。同时以35S∶GFP做为对照。
2 结果与分析
2.1 陆地棉GhBFT1基因的克隆及生物信息学分析
GhBFT1基因cDNA的ORF长约500 bp左右(图1),经克隆测序,分析得出GhBFT1的ORF长度为525 bp,包含起始密码子ATG和终止密码子TGA,比对分析和陆地棉基因组中注释的来自A亚基因组的基因GhBFT1-A,来自D亚基因组的基因GhBFT1-D分别有99.2%和99.6%的相似性(图2)。推测ORF编码174个氨基酸,氨基酸比对分析表明GhBFT1蛋白具有PEBP家族中保守氨基酸位点His88/Asp144 (图3)。使用SWISS-MODEL网站同源建模法构建GhBFT1蛋白三维结构,发现其与TFL1家族蛋白的结构很类似(图4),GhBFT1蛋白含有4个反向平行的肽链形成一个中心β折叠片,还有其他一些无规则卷曲的线性骨架。将GhBFT1的氨基酸序列与其它植物BFT蛋白家族进行比对分析,并将棉花BFT基因与其他物种BFT同源基因的蛋白序列构建系统进化树(图5),可看出,拟南芥、亚麻荠、油菜的BFT基因进化亲缘关系最为接近,而棉花BFT基因与番木瓜(Caricapapaya)、榴莲(Duriozibethinus)、哥伦比亚锦葵(Herraniaumbratica)、可可(Theobromacacao)等的基因进化亲缘关系比较接近。BFT基因所处的TFL1亚家族基因在进化上表现出分支相互交错的现象,没有根据亲缘系各自聚类,且部分单子叶植物和双子叶植物的BFT与TFL1同源基因的进化分支虽各自聚成一类,但没有明显分界线,说明TFL1亚家族基因的进化相对较快、分化更大,这对基因功能进化的多样性具有重要意义。
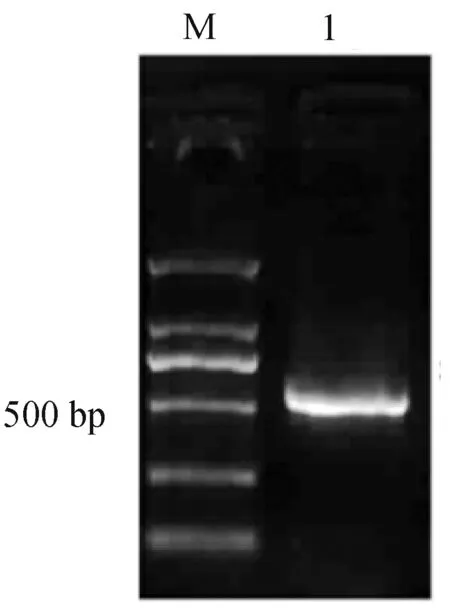
M:DNA分子量marker DL2000图1 GhBFT1基因的PCR扩增Fig.1 The PCR product of GhBFT1 gene
2.2 陆地棉GhBFT1基因的组织表达分析
qRT-PCR实验表明,GhBFT1基因在陆地棉中根、茎、真叶、花瓣、花萼和雄蕊中均有表达(图6A),但不同组织中的相对表达量水平显示出明显差异:GhBFT1基因在花蕊中表达量最高,其次是根,这2个组织中的表达量明显高于其他组织;在叶和花萼中表达量中等;在茎和花瓣中表达量较少,并且表达量差异不显著,说明表达水平相当。组织表达分析表明GhBFT1基因可能在棉花根的发育和花蕊的形成过程中起着更为重要的作用。
虽然GhBFT1基因在棉花根及花蕊中的相对表达水平最为突出,但GhBFT1基因在胚珠和纤维的发育时期也有表达。分析GhBFT1基因在胚珠发育不同时期的表达发现,在开花前3天(-3)以及开花3天(3)后,GhBFT1都处于比较低的表达水平,而在开花当天(0)、花后1天(1)表达水平都相对较高,开花后基因表达逐渐降低(图6B),说明GhBFT1基因可能在根和雄蕊发育过程中具有重要作用,同时参与了棉花纤维发育及胚珠发育。

图3 GhBFT1基因编码的氨基酸的序列比对分析Fig.3 The amino acids alignment of GhBFT1 gene
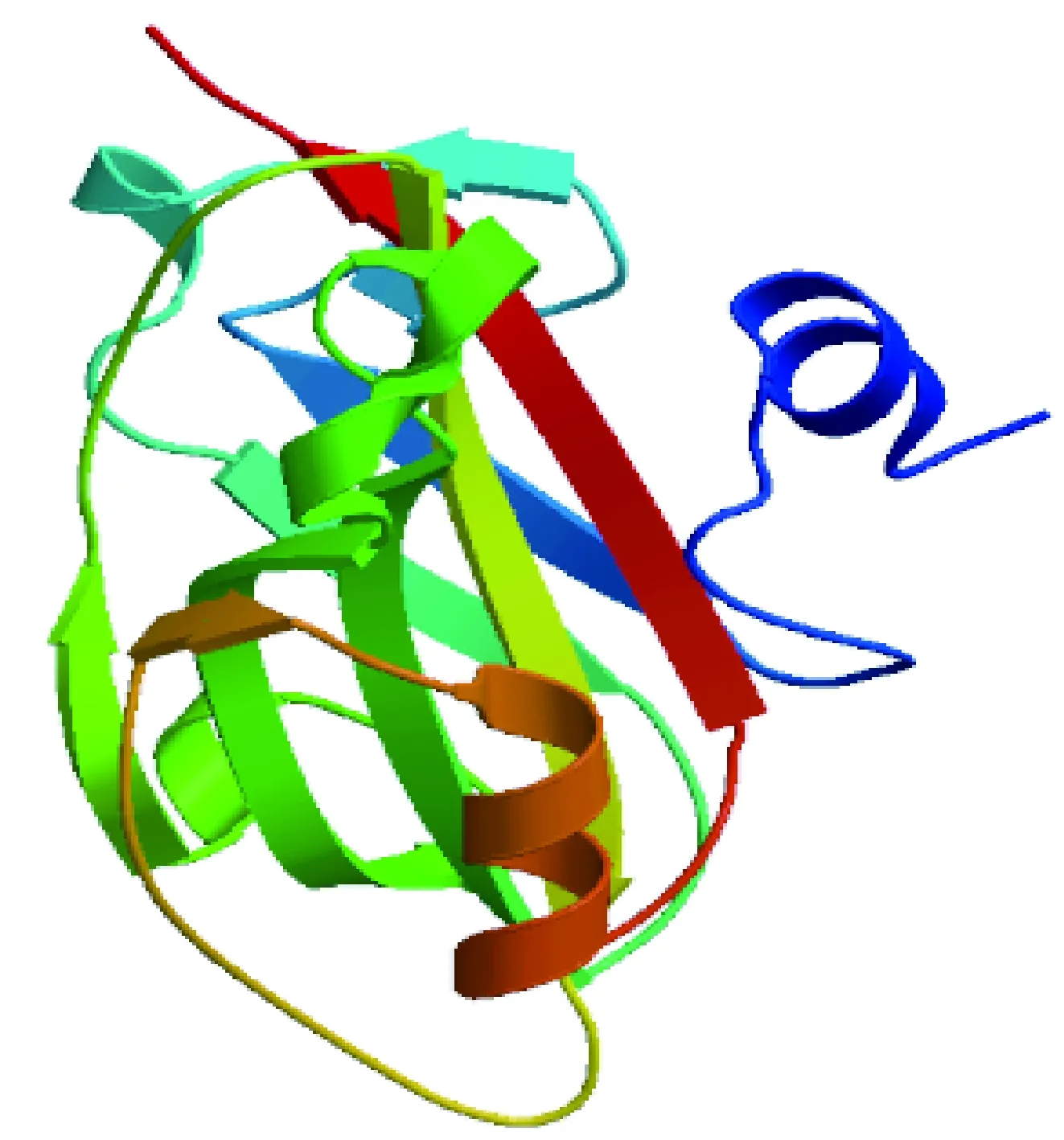
图4 GhBFT1蛋白三维结构预测Fig.4 Three-dimensional structure prediction of GhBFT1 protein
2.3 亚细胞定位分析
2.3.135S∶GhBFT1-GFP融合表达载体的构建及农杆菌转化
载体含有卡那霉素抗性基因nptII和花椰菜花叶病毒(CaMV)的35S启动子(图7A)。将构建好的载体酶切后经琼脂糖凝胶电泳,结果显示酶切产物除载体片段外,另有一约500 bp的条带(图7B),是GhBFT1基因去除终止子的片段,说明35S∶GhBFT1-GFP质粒构建正确。转化35S∶GhBFT1质粒的农杆菌GV3101,经菌落PCR扩增,产物电泳显示也扩增出了预期大小的条带(图7C),说明35S∶Gh-BFT1-GFP载体转化成功,可以用于后续的遗传转化和亚细胞定位研究。
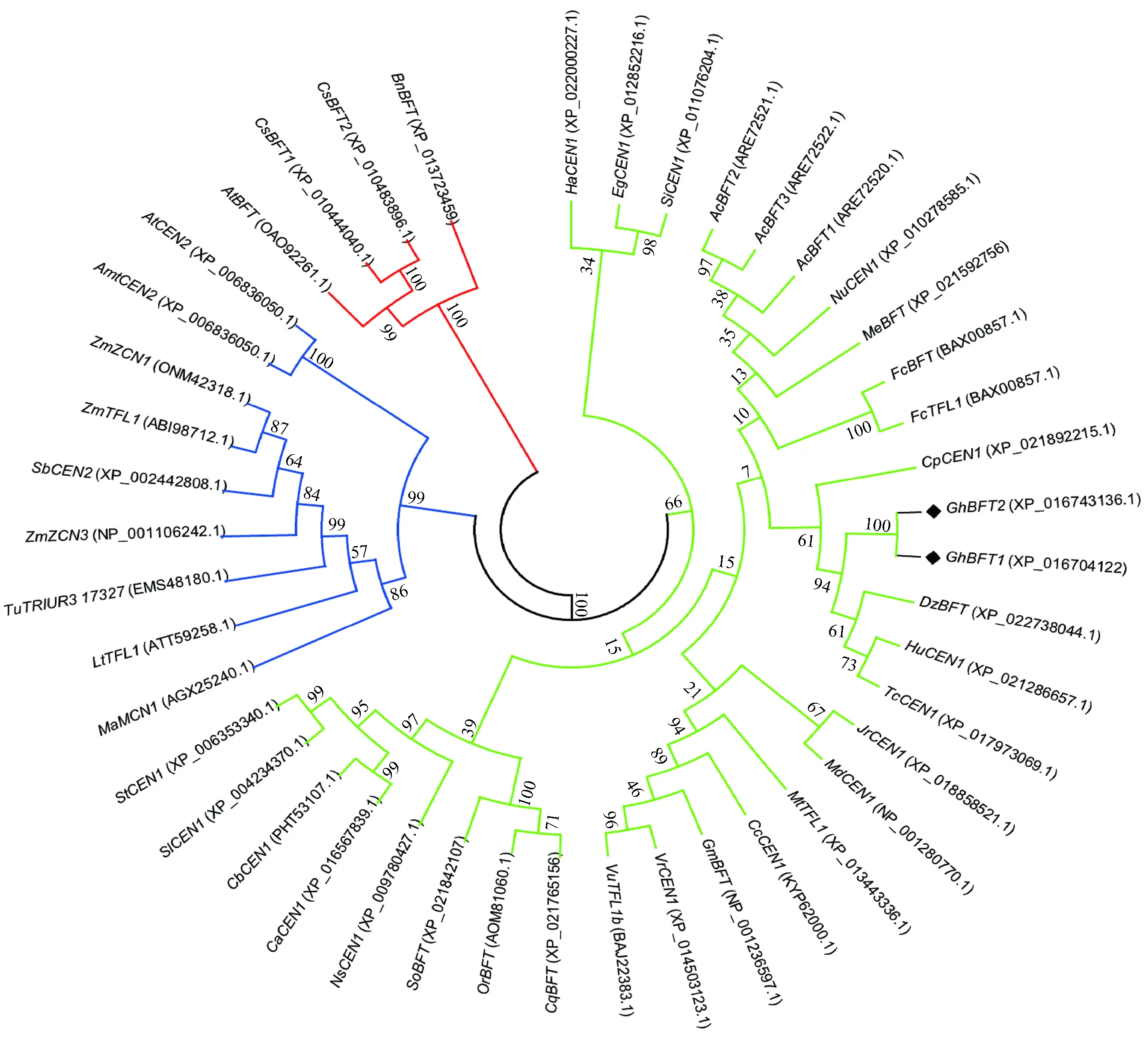
图5 不同植物基因组中的BFT基因编码的氨基酸序列进化分析Fig.5 Evolutionary analysis of BFT genes coding amino acids in various plant genomes
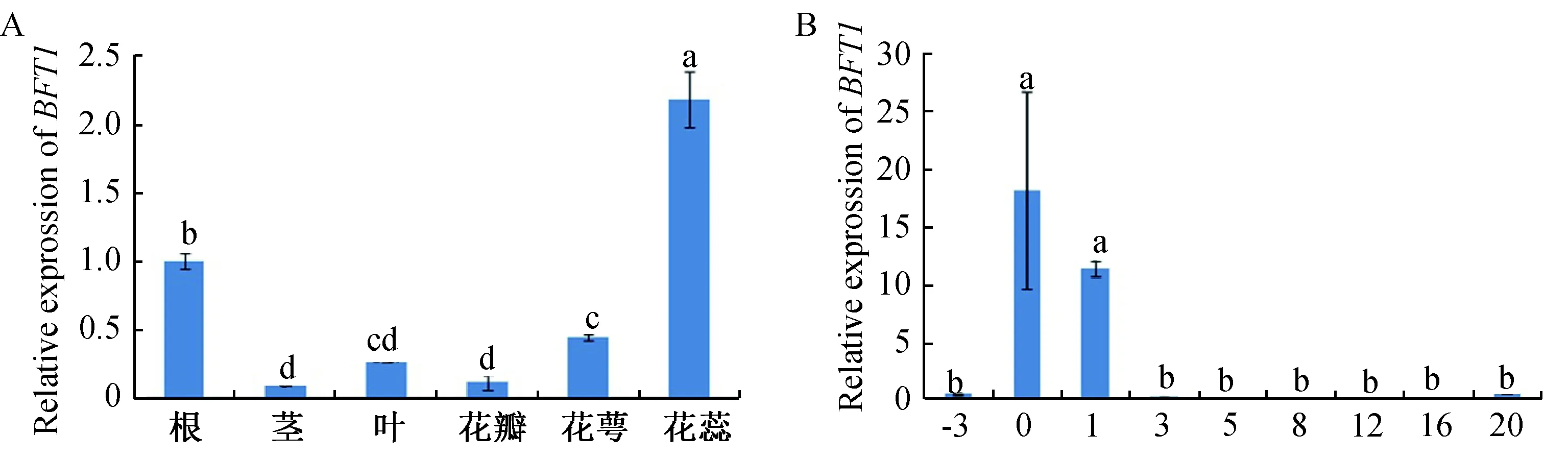
A:组织表达分析;B:纤维不同发育时期的表达分析;相同字母表示差异不显著,不同字母表示差异显著,数字代表开花天数图6 GhBFT1基因的表达分析Fig.6 Gene expression analysis of GhBFT1
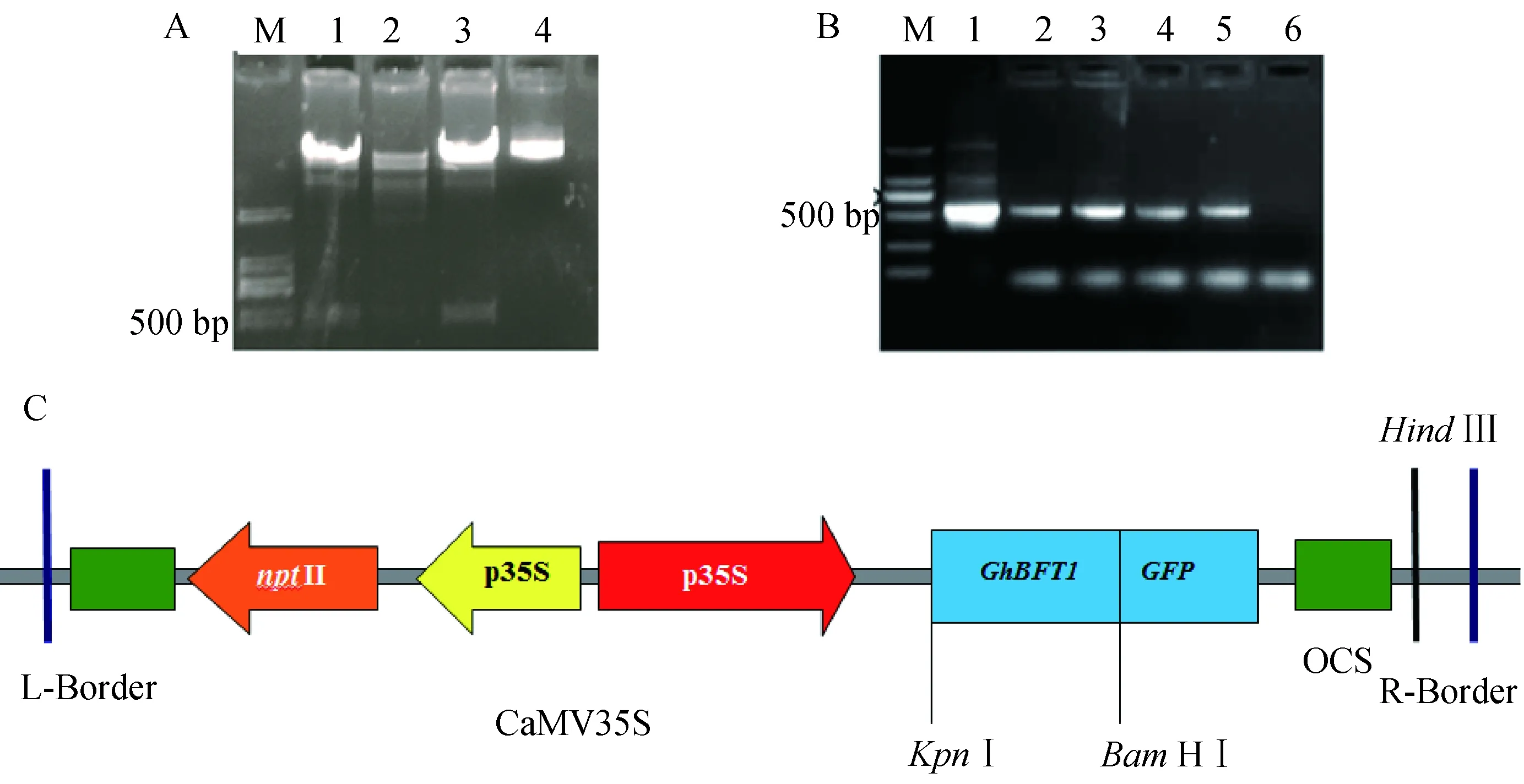
A:35S∶GhBFT1-GFP酶切鉴定;B:菌液PCR验证;C:融合表达载体的模式图图7 35S∶GhBFT1-GFP植物融合载体构建Fig.7 Plant fusion vector construction of 35S∶GhBFT1-GFP
2.3.2 GhBFT1蛋白的亚细胞定位
将35S∶GhBFT1-GFP使用瞬时转化方法转化至本氏烟草叶片中,使其基因在烟草的叶表皮细胞中表达,使用激光共聚焦显微镜观察,结果发现在叶表皮细胞的细胞质和细胞核中有绿色荧光信号,与GFP空白对照结果一致(图8)。GFP蛋白在植物细胞的细胞质和细胞核中表达,说明GhBFT1蛋白是细胞质和细胞核定位的蛋白。
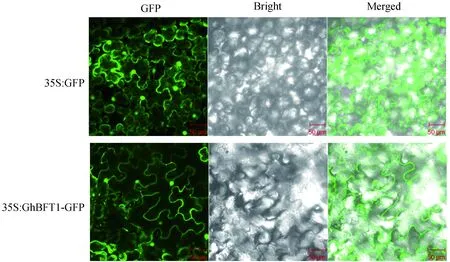
图8 GhBFT1-GFP融合蛋白在本氏烟草叶表皮细胞中的亚细胞定位分析Fig.8 Subcellular location of GhBFT1-GFP fusionprotein in leaf epidermal cells in N.benthamiana
3 讨论
本研究从陆地棉新陆早33中克隆的GhBFT1基因,比对分析表明属于D亚基因组,氨基酸分析表明二者都具有PEBP家族中区分FT和TFL1蛋白家族的保守氨基酸His88/Asp144。GhBFT1基因具有PEBP家族中的保守结构,同样具有保守的蛋白序列。GhBFT基因与一些物种中的CEN基因进化距离接近,说明了棉花TFL1旁系同源基因进化中的多样性。进化分析表明很多物种中含有多个FT/TFL1旁系同源基因,如大豆的FT/TFL1基因家族,并且FT亚家族基本聚成一类,而TFL1会聚类成多个分支,说明TFL1-like进化上更为自由。结合实验室的前期研究表明,棉花TFL1-like亚家族基因具有更丰富的进化潜力。
蛋白亚细胞定位分析表明GhBFT1同其它植物的PEBP蛋白一样位于细胞核和细胞质中。很多植物的PEBP同源蛋白都定位于细胞核和细胞质中,如拟南芥的FT[15]、烟草的4个FT蛋白[16]、菊花CsTFL1[17]。很多研究表明,FT/TFL1都能与转录因子FD蛋白互作,促进或抑制下游控制花分生组织活性基因的表达,从而促进或抑制成花转变。
基因表达分析发现陆地棉GhBFT1基因在根、雄蕊中的表达量较高,在叶、花萼中表达量中等,在茎、花瓣中表达量较少,表明基因可能在不同组织中的表达模式不同。此外基因在胚珠和纤维发育的不同发育时期的表达分析表明,开花前3天基因开始表达,在开花当天和花后第1天的胚珠中表达水平最高,且呈现开花后逐步降低的水平表现,而在开花3天后都处于较低的表达水平,说明基因可能在根和雄蕊的发育、胚珠发育的起始阶段具有重要作用。有研究[18]发现,拟南芥中的BFT基因在地上部分的分生组织如莲座叶、茎生叶及花中表达较高,在地下部分如根和再生顶端中表达较低。BFT基因所在的PEBP家族基因可以调控开花转变,能促进开花或抑制开花,推测GhBFT1也可以参与调控开花相关的代谢通路。此外,GhBFT1基因是否具有昼夜节律表达、是否参与调控纤维的发育、其详细的功能及生物机理等方面都需要进一步深入研究。

