小拟南芥转运蛋白基因及NHX2基因的克隆与表达
孙琦,黄薇,刘芳,金玉环,肖建旺,黄先忠
(石河子大学生命科学学院,特色植物基因组学实验室,新疆 石河子832003)
植物在生长过程中不断面临着各种生物和非生物因素的威胁,盐胁迫已成为影响全球农作物生产的主要非生物因素之一[1-5]。钠离子的过量积累造成细胞膜透性增加、蛋白功能紊乱、有毒物质积累及氧化损伤等,严重影响植物的生长发育[6-7]。植物通过不断适应高盐的环境而进化出了一些有效的策略以保证生存[8-10]。在细胞水平上,通过将Na+有效分隔到液泡和其他细胞器官中以及将Na+从根部排出是避免细胞质Na+浓度过高和维持细胞质K+/Na+比值的有效机制[11-13]。
转运蛋白(transport protein)是膜蛋白的一大类,介导生物膜内外的化学物质及信号的交换。因脂质双分子层在细胞或细胞器周围形成了一道疏水屏障,导致大部分亲水性化合物,如糖、氨基酸、离子等都需要特定转运蛋白的帮助来通过疏水屏障。因此,转运蛋白在营养物质摄取、代谢产物释放以及信号转导等广泛的细胞活动中起着重要的作用[14]。已有研究[15]表明植物体内存在多个与Na+转运相关的蛋白,如液泡膜上的Na+/H+逆向转运蛋白(NHX)和细胞质膜上的Na+/H+逆向转运蛋白(SOS)。液泡膜NHX主要行使Na+在液泡中区域化的功能,在提高植物耐盐性方面发挥了重要作用[16]。He等[17]将拟南芥AtNHX1转入棉花后发现,转基因能在高浓度NaCl条件下正常生长。Wu等[18]将水稻液泡型Na+/H+逆向转运蛋白OsNHX1基因转入獐毛中,转基因獐毛植株能够在350 mM NaCl处理10周后正常存活。另外,过量表达NHX基因在转基因植物拟南芥(Arabidopsisthaliana)[19],番茄(Lycopersiconesculentum)[20],茄果(Solanumpennellii)[21]和水稻(Oryzasativa)[2]中也证实了耐盐性的改善。
十字花科短命植物小拟南芥(Arabidopsispumila),是十字花科拟南芥的近源物种,主要生长在干旱少雨、土壤盐碱化严重的新疆的北部,具有耐盐碱、耐干旱等特点[22]。近年来,我们从小拟南芥中克隆了一些抗逆基因[23-29],但目前对于小拟南芥NHX2基因的克隆还没有研究,其响应盐碱胁迫的机制还不清楚。
近年来利用转录组测序技术鉴定耐盐相关的基因及功能分析,更好的解析了植物的耐盐机制[30-31]。前期我们利用二代和三代测序技术测序了小拟南芥响应高盐胁迫的全长转录组,经分析发现了8075个差异表达基因,初步分析了小拟南芥的盐适应机制[32]。本研究中,我们基于小拟南芥转录组数据筛选出了1157个盐胁迫下差异表达的转运蛋白基因,并通过K均值(K-means)方法对转运蛋白基因进行聚类,分析了转运蛋白基因在20个子聚类中的表达特征,从上调表达的子聚类中筛选并克隆了一个Na+/H+逆向转运蛋白基因ApNHX2。本研究所获得了差异表达的转运蛋白基因,为今后深入研究小拟南芥转运蛋白基因在耐盐性方面的作用提供了理论依据,为探索短命植物适应环境的分子机理奠定了基础。
1 材料与方法
1.1 植物材料
新疆小拟南芥种子为本实验室保存。种子萌发使用1/2 MS固体培养基。种子消毒参照文献[23]所述方法进行。
1.2 实验方法
1.2.1 小拟南芥胁迫处理、总RNA的提取和cDNA的合成
小拟南芥种子经灭菌后均匀播种在1/2 MS培养基上,4 ℃春化处理3 d后,放置于长日照光照培养箱中培养(16 h光照/8 h黑暗,温度为22 ℃)。将生长2周后的小拟南芥幼苗转移至含250 mM NaCl的1/2 MS培养基上分别处理0、0.5、3、6、12、24和48 h后收集材料。另外收集小拟南芥成熟植株的根、茎、叶、花以及果荚组织材料。采用TIANGEN公司的RNA prep pure Plant Kit试剂盒按照说明书提取所有样品的RNA。根据北京百泰克公司的M-MLV Reverse Transcriptase合成cDNA模板第一链。
1.2.2 小拟南芥响应盐胁迫的转运蛋白基因分析
根据七大数据库(Nr,Nt,Pfam,KOG/COG,Swiss-prot,KEGG,GO)的基因功能注释结合TransportDB2.0(http://www.membranetransport.org/transportDB2/index.html/)数据库,以transport为关键词在小拟南芥转录组测序得到的8075个差异表达基因功能注释信息文件[32]中手动查找转运蛋白基因,按功能进行细化分类。将查找到的所有转运蛋白基因在基因表达量注释信息文件中进行搜素,记录每个基因在盐胁迫处理不同时间点的表达量,以FPKM(expected number of Fragments Per Kilobase of transcript sequence per Millions base pairs sequenced,FPKM:每百万碱基对每千碱基转录物序列的预期片段数)值表示。利用R studio(https://www.rstudio.com/)绘制转运蛋白基因的表达热图。
对筛选得到的转运蛋白基因以基因的相对表达水平值log2(ratios)进行K-means聚类分析并统计分布在每个subcluster中的转运蛋白基因的数量。对于每个基因来说ratios为该基因在样品2的FPKM与该基因在样品1的FPKM值的比值。采用相应的距离算法计算每个基因之间的距离,根据基因的相对距离远近分成不同的subcluster,从而实现聚类。
1.2.3 Na+/H+逆向转运蛋白基因的筛选
根据K-means聚类分析得到的20个subcluster中,发现有一类整体趋势表现为上调的K subcluster,查找分布于该K subcluster中的基因表达量log10(FPKM+1)值,利用R studio(https://www.rstudio.com/)绘制热图,以直观分析各个基因在不同时间点的表达特征。将分布于该上调聚类中的Na+转运蛋白基因序列在CDS预测信息文件中查找编码区序列,对每1条基因在tair数据库(http://www.arabidopsis.org/)中进行Blast比对,并记录比对后的结果。根据比对结果发现Na+转运蛋白基因中有1条与拟南芥AtNHX2基因序列相似性极高的同源基因ApNHX2,在盐胁迫处理后的各个时间点的表达量均显著上调。
1.2.4ApNHX2基因的克隆和测序
使用DNAStar分析ApNHX2完整开放阅读框(ORF),根据ORF利用Primer5.0软件设计引物ApNHX2-F和ApNHX2-R,在两端分别加上KpnI和XbaI酶切位点(表1)。以250 mM NaCl胁迫处理12 h后的2周大的小拟南芥幼苗cDNA第一链为模板进行RT-PCR扩增,在20 μL的反应体系中加入10×PCR Buffer 2 μL,dNTP 1.5 μL,上下游引物各0.5 μL,模板cDNA 2 μL,Ex Taq (TaKaRa)酶0.3 μL,ddH2O 13.2 μL。反应程序为94 ℃预变性2 min,94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸2 min,共38个循环,终延伸为72 ℃ 10 min。PCR产物在1% (w/v)的琼脂糖凝胶上检测,将PCR产物利用凝胶回收试剂盒回收纯化后连接到pMD19-T(TaKaRa)载体上,转化大肠杆菌DH5α感受态细胞,经蓝白斑筛选,挑取单克隆于液体LB培养基中37 ℃、200 rpm下振荡培养过夜,提取质粒经双酶切鉴定,将鉴定正确的质粒交由北京华大基因公司测序。
1.2.5 ApNHX2蛋白的跨膜结构分析与进化树构建
利用TMHMM server v.2.0(http://www.cbs.dtu.dk/services/TMHMM/)分析该蛋白的跨膜区。利用NCBI的Blastp程序检索ApNHX2的同源蛋白,氨基酸序列的多重比对采用Clustal X2.0程序完成,用MEGA5.0软件构建系统进化树,其中用Neighbor-Joining方法进行1000次Bootstrap分析[33]。
1.2.6ApNHX2基因的组织表达分析
采用qRT-PCR进行基因的组织表达分析。ApNHX2基因引物为qRT-ApNHX2-F和qRT-ApNHX2-R,选择GAPDH作为内参基因[35],引物为GAPDH-F和GAPDH-R (表1)。qRT-PCR采用Fast SYBR Mixture试剂盒(康为世纪),利用美国ABI 7500 Fast实时荧光定量PCR仪(Life Technologies,Foster City,CA,USA)进行扩增。在10 μL的反应体系中加入cDNA模板2 μL,UltraSYBR Mixture 5 μL,ROX 0.2 μL,正反向引物(10 μM)各0.2 μL,ddH2O 2.6 μL。反应程序为95 ℃预变性10 min;95 ℃变性15 s,60 ℃退火1 min,共40个循环;60 ℃读取荧光值。检测每份样品的ApNHX2基因和GAPDH内参基因的Ct值,每份样品3次重复,实验数据采用2-ΔΔCt法进行相对定量分析[23]。采用SPSS17.0软件对实验结果进行单因素方差分析,利用Duncan法进行多组样本之间的差异显著性分析(P<0.05)[32]。

表1 本研究所用的PCR引物序列Tab.1 PCR primers used in this study
注:下划线代表限制性内切酶的酶切位点。
1.2.7 过量表达载体构建
将测序正确的质粒pMD19-T∶ApNHX2以及载体pCAMBIA2300-CaMV35S-OCS使用KpnI和XbaI进行双酶切,电泳检测后回收目的片段。利用T4连接酶4 ℃下过夜连接,将连接后的产物转化DH5α感受态细胞,37 ℃下倒置培养14~16 h。挑取单菌落于液体LB培养基中摇瓶过夜培养,通过抽提质粒和进行酶切验证,利用1.2% (w/v)的琼脂糖电泳检测,构建35S∶ApNHX2载体。将鉴定正确的质粒,用冻融法转化农杆菌GV3101,挑取单克隆进行菌液PCR验证,将鉴定正确的单克隆菌液甘油保存于-80 ℃备用。
2 结果与分析
2.1 筛选小拟南芥中耐盐相关的转运蛋白基因
根据七大数据库功能注释从8075个差异表达基因中找到1157个耐盐相关的转运蛋白基因,基因表达热图分析表明在盐胁迫的早期阶段(0.5~6 h),一些基因被快速激活上调表达,一些基因在胁迫的后期(12~48 h)被激活上调表达,而另外一些基因则表现为随胁迫时间的增加表达量持续上升(图1 A)。将1157个转运蛋白基因按功能分为ABC转运蛋白(ABC transporter);Ca2+转运蛋白(Calcium-transporter);K+转运蛋白(Potassium transporter);Na+转运蛋白(Sodium- transporter)以及糖转运蛋白(Sugar transporter)等(图1B)。统计主要转运蛋白基因的数量包括24个Na+转运蛋白基因,36个K+转运蛋白基因,30个Ca2+转运蛋白基因,9个Cl-转运蛋白基因以及ATPase相关转运蛋白家族H+-PPase、F-ATPase和P-ATPase中所含基因的数量分别为70、2和80个,从中得出P-ATPase家族中所包含的基因数量最多,而Cl-转运蛋白相关基因数量最少(图1B)。
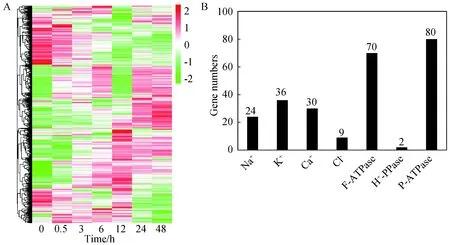
A:1157个转运蛋白基因在250 mM NaCl胁迫不同时间的表达热图;B:主要转运蛋白基因的数量分布情况图1 1157个盐胁迫差异表达的转运蛋白基因的分析Fig.1 Analysis of the 1157 differently expressed transporter genes under salt stress
2.2 K-means聚类方法分析转运蛋白基因
K-means聚类分析结果显示,1157个转运蛋白基因分布于20个K subcluster中,其中在K6,K9以及K15子聚类中的基因数量分布较多,分别为172,193以及190个,而在K5子聚类中基因分布最少,数量为5个(图2 A)。根据log2(ratio)值绘制的差异基因表达量聚类图表明分布于K6子聚类中的基因相对表达水平整体表现出持续上调的趋势(图2B)。通过查找分布于K6子聚类中的基因表达量log10(FPKM+1)值所绘制的热图结果显示,经盐胁迫处理后的基因一部分表现为早期(0.5~12 h)持续上调表达,一部分表现为后期(12~48 h)持续上调表达,而有一部分基因持续上调表达(图2C)。有一个差异表达明显的Na+转运蛋白基因ApNHX2分布在K6子聚类中,随着处理时间的增加,ApNHX2基因的表达量逐渐升高且在处理12 h时表达量达到最高,之后则表现出下降的趋势,但ApNHX2基因在6个胁迫时间点的表达量均高于对照条件下(0 h)的表达量(图2D),暗示该基因在小拟南芥耐盐反应中起着重要作用。
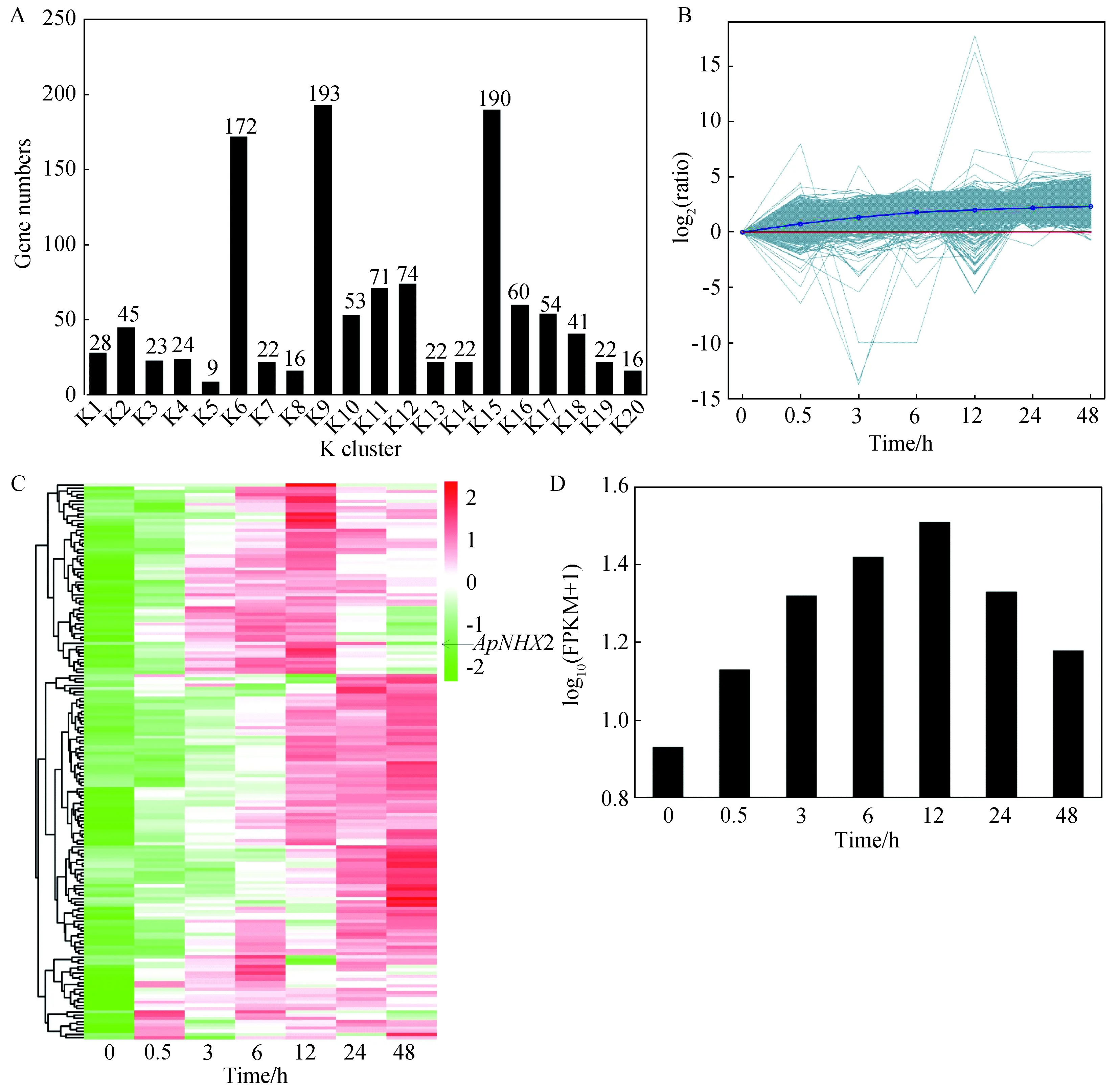
A:1157个转运蛋白基因在20个子聚类中的数量分布:B:K6差异基因表达量聚类图;C:K6子聚类中172个转运蛋白基因 响应250 mM NaCl胁迫的表达热图,箭头所指表示差异表达显著的Na+/H+逆向转运蛋白基因ApNHX2; D:ApNHX2基因在250 mM NaCl胁迫不同时间的表达图2 K-means聚类分析Fig.2 K-means clustering analysis
2.3 ApNHX2基因的克隆及生物信息学分析
利用引物ApNHX2-F和ApNHX2-R扩增得到约1.6 kb的扩增产物。测序结果结合全长转录组数据库分析表明ApNHX2全长为2299 bp,ORF大小为1626 bp,推测其编码541个氨基酸(图3)。ApNHX2蛋白的跨膜结构预测结果显示ApNHX2是一个典型的跨膜转运蛋白,具有12个跨膜结构区,其中包括2个未完全跨膜区(图4)。
2.4 ApNHX2蛋白的系统进化分析
通过NCBI数据库检索ApNHX2的同源蛋白序列,利用MEGA5.0软件构建了小拟南芥ApNHX2与拟南芥(Arabidopsisthaliana),野甘蓝(Brassicaoleraceavar.oleracea),欧洲油菜(Brassicanapus),盐角草(Salicorniaeuropaea),木薯(Manihotesculenta),玫瑰(Rosarugosa),醉蝶花(Tarenayahassleriana),榴莲(Duriozibethinus),滨藜(Atriplexhalimus),橡胶树(Heveabrasiliensis),白桦(Betulaplatyphylla)以及胡杨(Populuspruinosa)中NHX2蛋白的系统进化树(图5)。结果表明,ApNHX2与拟南芥以及欧洲油菜等的NHX2蛋白进化关系均较近,与拟南芥NHX2属于同一进化分支。
2.5 ApNHX2基因的组织表达分析
组织表达分析结果显示,ApNHX2基因在小拟南芥各组织中均有表达,在花中表达量最高,在其它组织中表达量均较低且无明显差异(图6)。
2.6 植物过量表达载体35S∶ApNHX2的构建
经KpnI和XbaI酶切的pMD19-T∶ApNHX2质粒以及pCAMBIA2300-p35s-OCS载体用T4连接酶连接后转化大肠杆菌DH5α,抽提质粒并进行双酶切验证,琼脂糖凝胶电泳检测结果显示,质粒1和质粒2酶切后条带均与目的基因大小一致,均在接近1600 bp处,说明目的片段已连接到表达载体上,成功构建植物过量表达载体35S∶ApNHX2(图7 A)。最终载体35S∶ApNHX2含有花椰菜花叶病毒CaMV35S启动子,章鱼碱合成酶基因OCS终止子及植物筛选标记新霉素磷酸转移酶基因NPTⅡ (图7B)。将35S∶ApNHX2载体转化农杆菌GV3101感受态细胞,通过菌液PCR验证发现扩增出约1600 bp长度的条带,表明该载体已成功转化农化菌GV3101(图7C)。
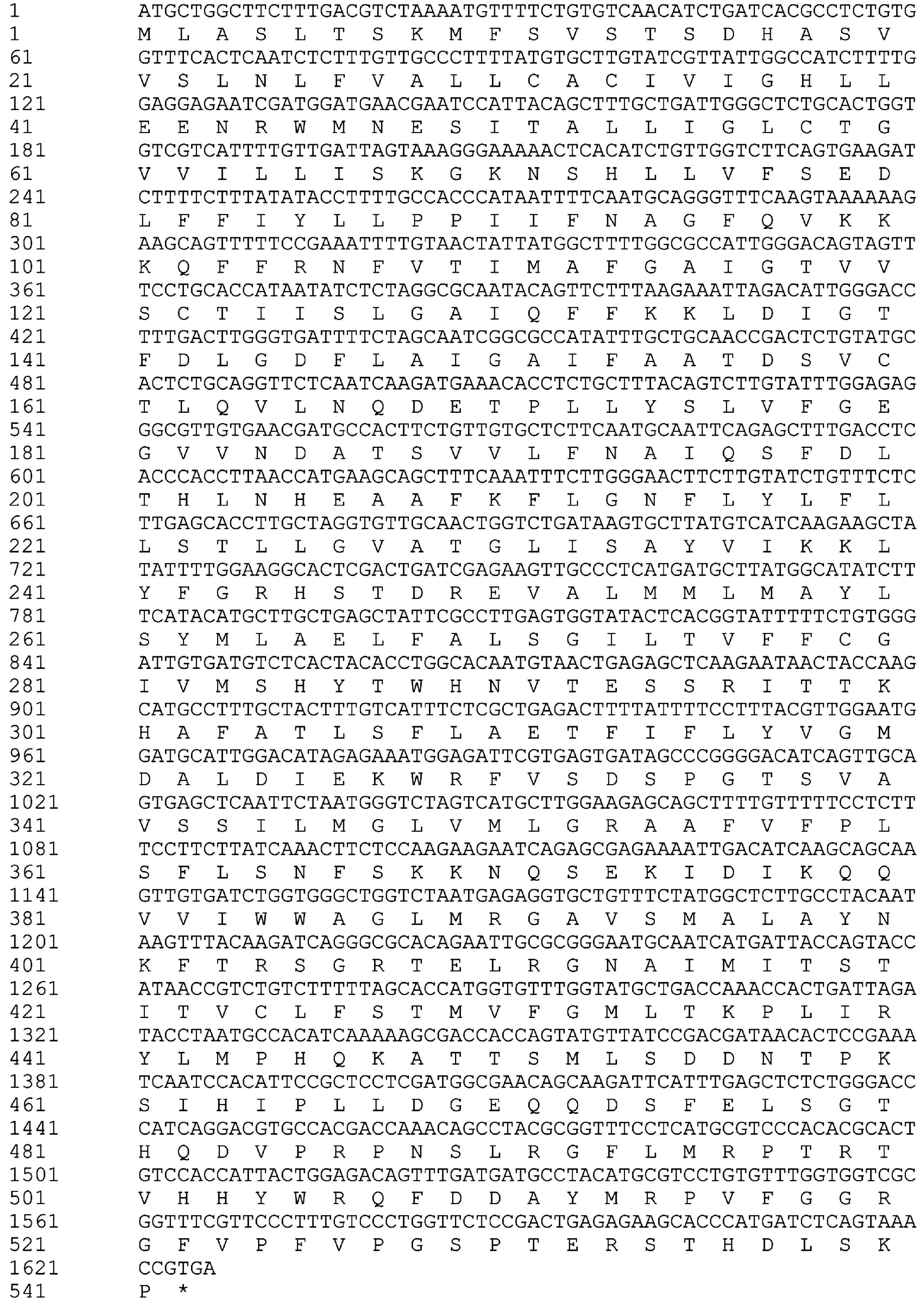
图3 ApNHX2的核苷酸序列及推测氨基酸序列Fig.3 Nucleotide sequence and putative amino acid sequence of ApNHX2
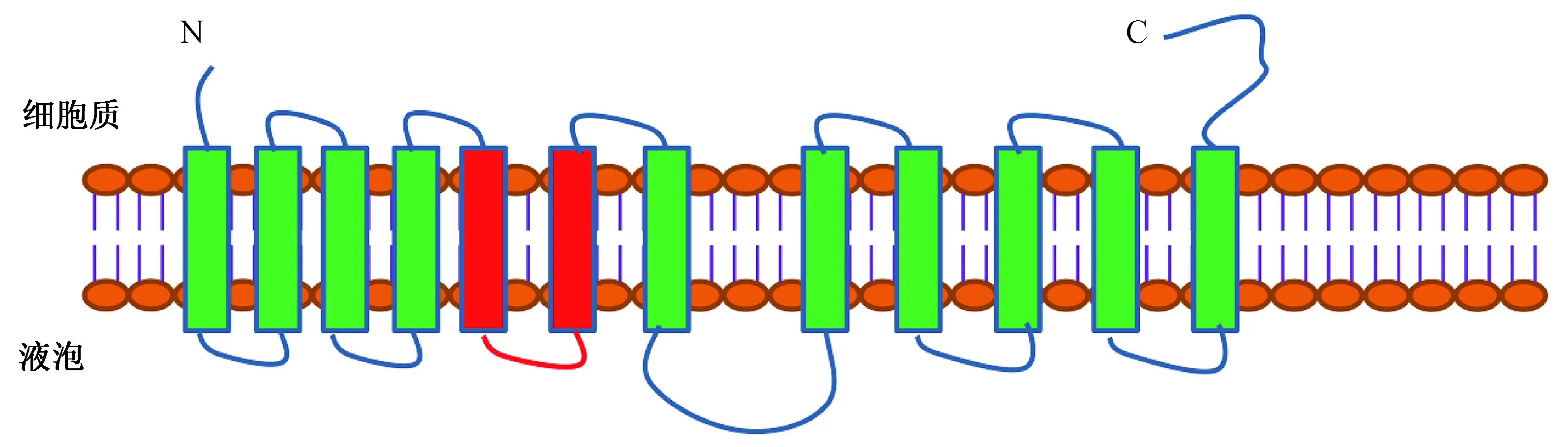
红色框代表2个未完全跨膜区;绿色框代表10个强跨膜区图4 ApNHX2蛋白的跨膜结构预测Fig.4 Prediction of transmembrane structure of ApNHX2
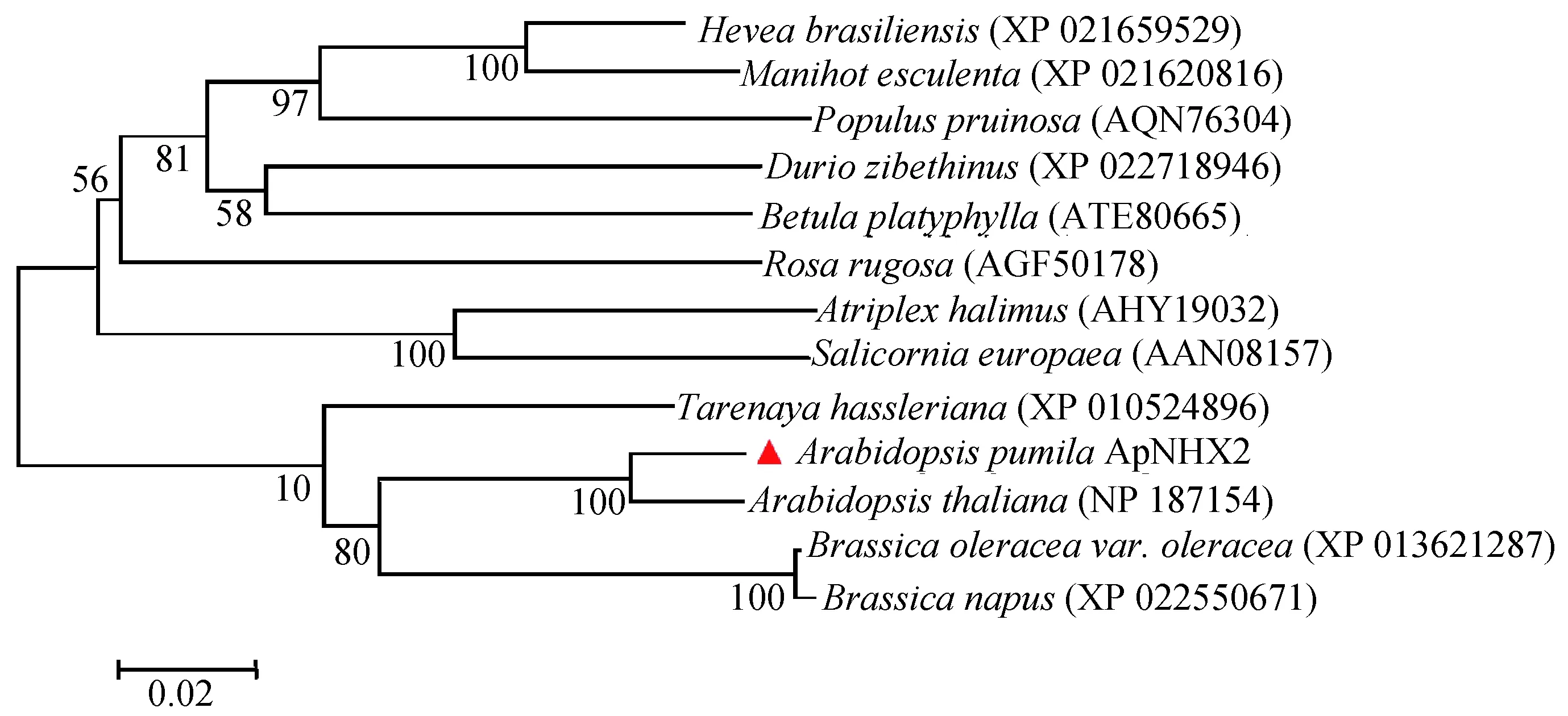
▲代表本研究克隆的ApNHX2蛋白;图中分支点的数字表示Bootstrap验证中基于1000次 重复该节点可信度的百分比;标尺代表每一位点碱基替换率图5 植物Na+/H+逆向转运蛋白NHX2的系统进化树分析Fig.5 Phylogenetic tree of Na+/H+ antiporter NHX2 from different plants
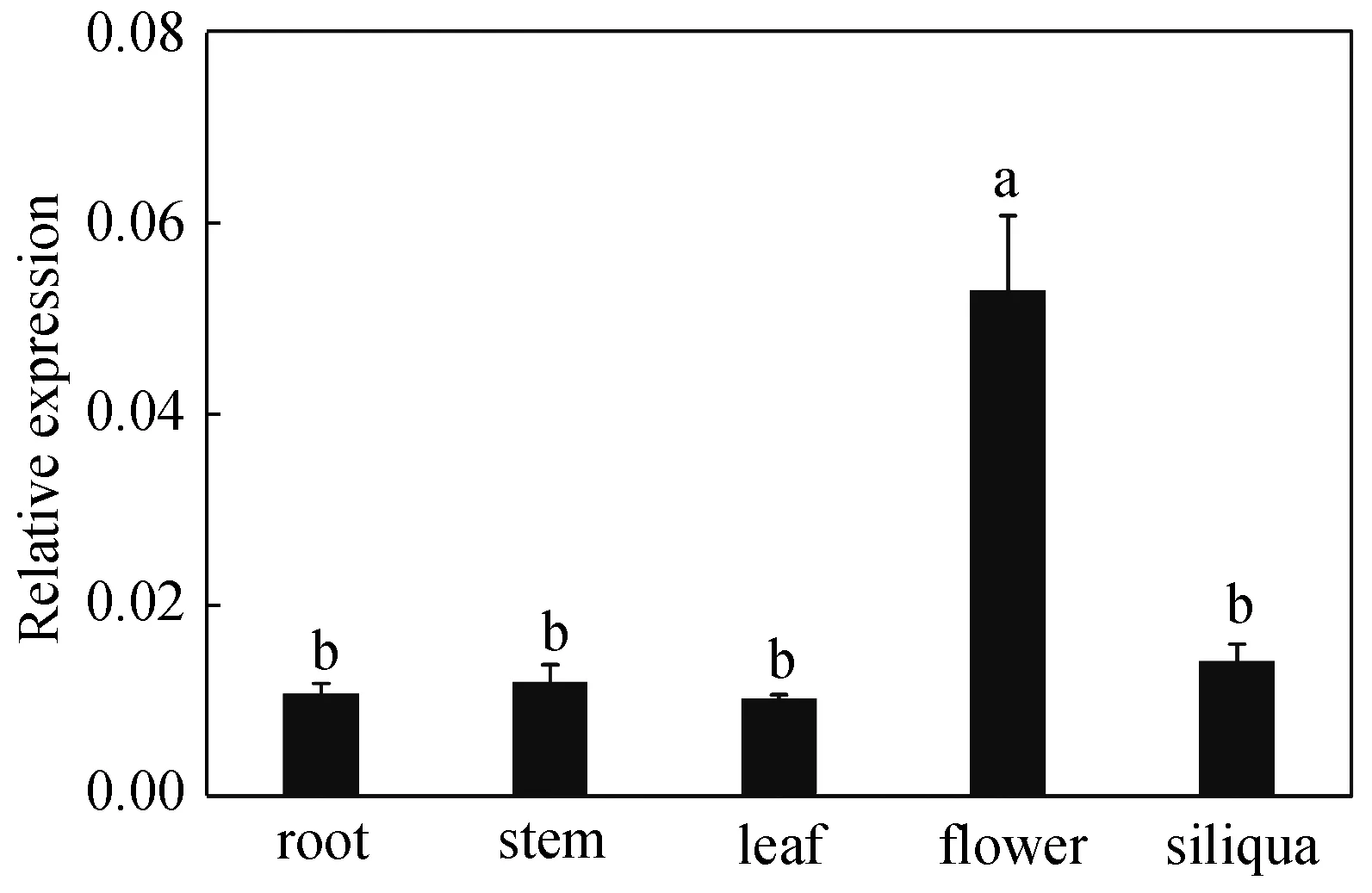
小写字母表示差异显著(P<0.05)图6 qRT-PCR验证的ApNHX2基因在在 根、茎、叶、花和果荚中的表达Fig.6 Expression pattern of ApNHX2 in different tissues of Arabidopsis pumila
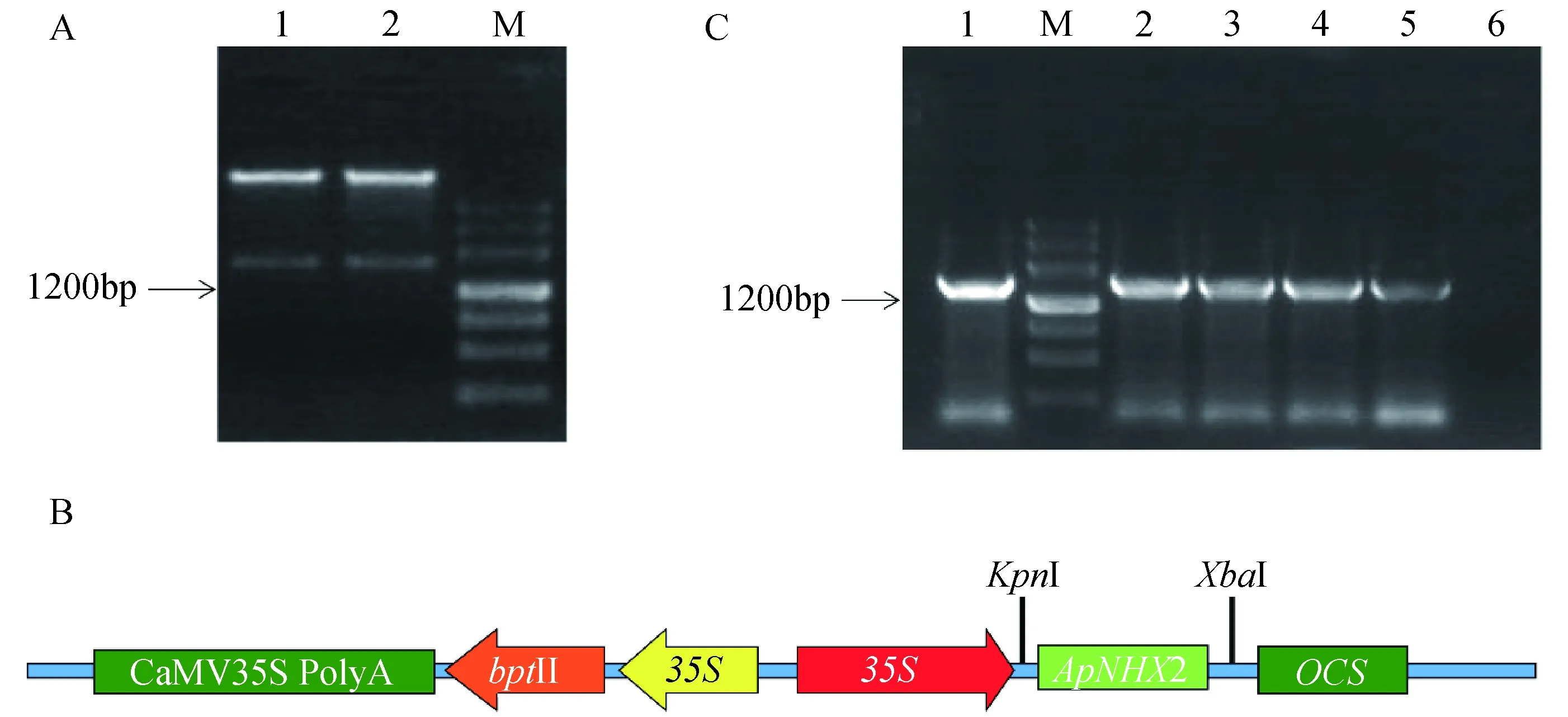
A:ApNHX2基因的质粒酶切检测,M为marker Ⅲ,1,2为35S∶ApNHX2;B:35S∶ApNHX2载体模式图;C:ApNHX2基因的 农杆菌PCR检测,M为marker Ⅲ,1为ApNHX2阳性对照,2-5为ApNHX2,6为ApNHX2阴性对照图7 过表达载体35S∶ApNHX2的构建Fig.7 Construction of plant overexpression vector 35S∶ApNHX2
3 讨论
转录组分析在阐明各种生长和发育过程以及应激条件下基因表达调控的复杂性中起着重要作用[35]。迄今为止的大多数研究[36-38]都报道了由二代测序(second-generation sequencing,SGS)技术产生的短读序列用于分析植物组织的转录组,但是这些序列阻止了全长转录本组装,降低了序列组装的准确性,使生物信息学分析变得困难。单分子实时(single-molecule real-time,SMRT)测序平台提供的第三代测序(third-generation sequencing,TGS)技术可以克服上述限制,由于其长读取而被广泛用于基因组测序[39-40]。尽管TGS具有相对较高的错误率,但通过使用短而高精度的SGS读数进行校正可以克服这一缺点[37-38]。在本实验室的前期研究中,我们结合SGS和TGS技术测序以产生更完整的A.pumila转录组[32],作为本研究的基础。
通过在小拟南芥转录组数据库中手动查找和筛选,从8075个差异表达基因中共整理出1157个功能注释为转运蛋白的基因,包括24个小拟南芥Na+转运蛋白基因(图1)。目前随着拟南芥和杨树(Populuspruinosa)的转录组测序工作的完成,分析显示拟南芥中存在10个Na+转运蛋白基因[41],杨树中存在11个Na+转运蛋白基因[42],研究者们对植物中的Na+转运蛋白基因有了进一步了解。本研究筛选出的小拟南芥Na+转运蛋白基因数量已远远超过拟南芥和杨树,因此我们推测Na+转运蛋白在小拟南芥适应高盐环境中起着重要的作用。
邱生平等[43]采用RT-PCR的方法从水稻中克隆了液泡膜Na+/H+逆向转运蛋白基因OsNHX2的全长cDNA,包含1635 bp的开放阅读框,编码544个氨基酸。李中虎等[44]在转录组测序的基础上,得到了滨麦(Leymusmollis)液泡膜Na+/H+逆向转运蛋白基因LmNHX2的DNA序列,包含1617 bp的开放阅读框,编码538个氨基酸。本研究基于转录组数据得到小拟南芥Na+/H+逆向转运蛋白基因ApNHX2的cDNA序列,包含1626 bp的全长开放阅读框,编码541个氨基酸(图3)。水稻OsNHX2和滨麦LmNHX2的跨膜结构域分析发现二者均含有12个跨膜结构区,其中包括2个未完全跨膜区[43-44]。本研究对小拟南芥ApNHX2跨膜结构域分析发现与水稻OsNHX2和滨麦LmNHX2具有相似的结果,含有12个跨膜结构区,其中包括2个未完全跨膜区(图4)。另外,邱生平等[43]通过系统发育分析表明OsNHX2与液泡膜Na+/H+逆向转运蛋白的同源关系较近而与质膜Na+/H+逆向转运蛋白的同源关系较远,这些结果说明OsNHX2可能是液泡膜Na+/H+逆向转运蛋白。而基于LmNHX2和其他NHX蛋白氨基酸序列构建的系统进化树[44]显示,滨麦LmNHX2与小麦(Triticumaestivum) TaNHX2二者氨基酸序列相似度高达99%,这与滨麦是小麦的野生近缘种的关系相符合。本研究通过系统发育分析表明ApNHX2与拟南芥NHX2蛋白进化关系较近,属于同一进化分支,这与小拟南芥是拟南芥的野生近缘种的关系相符合,可推断出ApNHX2属于液泡膜Na+/H+逆向转运蛋白(图5)。
基因表达模式的分析对于功能研究必不可少,组织表达分析表明ApNHX2在小拟南芥各组织中均有表达,但在花中表达量最高且明显高于其他组织,说明ApNHX2很可能参与到小拟南芥花器官发育的过程(图6)。已有研究[15]表明洋芋(Helianthustuberosus) Na+/H+逆向转运蛋白基因HtNHX2的表达提高了水稻对盐度的耐受性。在K+有限的盐胁迫条件下或一般营养缺乏的条件下,HtNHX2的表达增加了水稻籽粒产量,收获指数以及总养分吸收[15]。小麦Na+/H+逆向转运蛋白基因TaNHX2的表达也表现为能提高苜蓿(MedicagoSativa)[45]和大豆(Glycinemax)[46]的耐盐性。我们的研究发现,随着高盐胁迫时间的增加,ApNHX2基因的表达量逐渐升高且在处理12 h时表达量达到最高,之后表现出下降趋势,但ApNHX2基因在6个胁迫时间点的表达量均高于对照条件下(0 h)的表达量(图2D),暗示该基因在小拟南芥耐盐反应中起着重要作用。本研究构建了植物过量表达载体35S∶ApNHX2,并成功转化农杆菌GV3101,我们将进一步验证ApNHX2基因功能,为今后深入研究小拟南芥转运蛋白基因在耐盐性方面的作用提供理论依据。

