短命植物小拟南芥光周期调控基因CONSTANS的克隆与表达特征分析
刘芳,肖衡,金玉环,孙琦,黄薇,康凯程,黄先忠
(石河子大学生命科学学院/特色植物基因组学实验室,新疆 石河子 832003)
在植物生命周期中,光是影响植物从营养阶段向生殖阶段过渡的重要的环境因素之一。植物可以感知外部环境刺激(光信号)以预测环境的变化,并在适当条件下精确地调节其生长和发育[1]。研究表明,CONSTANS(CO)是光周期途径中控制开花的关键基因[2-3],CO蛋白受生物钟和光信号的严格控制[4-6],是位于生物钟和开花时间基因之间监测日照时间长度的必要元件,通过整合光和生物钟信号然后激活下游基因表达从而诱导植物开花[7]。
CO蛋白属于一类锌指转录因子,主要包括3个保守结构域:一个与核定位有关的CCT (CO、CO-Like和TOC1)结构域,另外两个拥有特殊结构CX2CX16CX2C(X代表任意氨基酸)并参与调节蛋白互作的B-box结构域[8-10]。CO基因功能研究备受关注,发现在已研究不同物种中存在很多CO同源基因,拟南芥中有17个CO同源基因[10],水稻(Oryzasativa)中有16个[11],油菜(Brassicanapus)中有4个[12],大麦(Hordeumvulgare)中有9个[11],小麦(Triticumaestivum)中存在3个CO基因[13],小立碗藓(Physcomitrellapatens)中有3个CO基因[14],大豆(Glycinemax)中有26个CO基因[15],陆地棉(Gossypiumhirsutum)中鉴定出42个CO基因[16]。
研究表明,CO基因家族在植物中调控多方面的生物学过程:陆地棉GhCOL1能够参与植物开花调控[16],葡萄(Vitisvinifera)VvCOL1与植物种子休眠有关[17],美洲黑杨(Populusdeltoides)CO1和CO2能够参与植物的形态发育[18],拟南芥AtCOL1、欧洲云杉(Piceaabies)PaCOL1和牵牛花(Pharbitisnil)PnCOL1能够调节植物昼夜节律[19-21],香蕉(Musanana)MaCOL1能够响应非生物和生物胁迫[22]。
小拟南芥(Arabidopsispumila)属于十字花科早春短命植物,主要分布在新疆北疆,适应新疆特殊气候条件,具有一定的耐逆性[23-24]。小拟南芥是拟南芥的近缘种,但是它比拟南芥更能适应外界的各种环境胁迫[23,25],因此具有良好的发展潜力和应用前景。前期我们实验室已经成功克隆了一些抗逆基因[26-32];构建了小拟南芥表达序列标签数据库[26];利用二代和三代测序技术完成了对小拟南芥响应盐胁迫条件下转录组测序工作,获得59, 328个unigenes,包含8075个差异表达基因[24]。虽然COL1基因在很多物种中已被广泛研究,但是迄今为止对于小拟南芥COL1的研究还尚未见报道。CO家族基因在小拟南芥的生长发育过程中是否与其他物种一样参与光周期调控开花等功能尚不清楚。因此,本研究基于小拟南芥转录组测序数据克隆了小拟南芥ApCOL1基因,利用生物信息学分析其结构特征,采用实时荧光定量PCR (qRT-PCR)技术研究了基因的昼夜节律性表达、组织特异性表达和响应非生物胁迫的表达特征。本研究为今后深入分析小拟南芥CO基因家族的功能奠定基础。
1 材料与方法
1.1 材料
本研究中所用到的植物小拟南芥(A.pumila)种子为本实验保存。小拟南芥种子灭菌和植株室内的培养方法参照文献[26]中的方法。
1.2 方 法
1.2.1 材料处理
胁迫处理:250 mmol/L NaCl胁迫处理方法参照文献[24]中的方法。生长15 d的小拟南芥幼苗分别放入4 ℃培养箱、40 ℃培养箱和含有20% PEG-6000的1/2 MS固体培养基上进行低温、高温和干旱处理。胁迫处理0 h、12 h、24 h和48 h后分别收集不同处理的幼苗。
昼夜节律样品:小拟南芥幼苗分别在长日照(LD,16 h光照/8 h黑暗)和短日照(SD,8 h光照/16 h黑暗)条件下生长25 d,生长温度22 ℃,光照条件200 μmol photons/m2/s。光照4 h开始第一次取样,每隔4 h取1次,各取12个时间点(共48 h)。
不同组织材料样品:LD条件下生长20 d小拟南芥取下胚轴和根组织;在抽苔期(种植后30 d)取叶和茎;在开花当天取花,在果荚期取长角果。将以上所有样品立即在液氮中冷冻后储存在-80 ℃备用。
1.2.2 小拟南芥总RNA的提取及cDNA第一链合成
用TRIZOL试剂(Invitrogen,CA,USA),根据说明书提取小拟南芥的总RNA。经1.0% (w/v)凝胶电泳和ND-1000分光光度计(NanoDrop Technologies,Wilmington,DE,USA)检测总RNA质量和浓度,根据Fermentas公司RevertAlidTMFirst Strand cDNA Synthesis Kit试剂盒说明书进行cDNA模板制备。
1.2.3 小拟南芥ApCOL1克隆与测序
我们实验室前期完成的小拟南芥转录组数据库[24],搜索到有1条unigene与拟南芥CO-like家族AtCOL1序列相似性非常高。该基因的ORF设计基因特异性引物ApCOL1-1F和ApCOL1-1R (表1),以小拟南芥的叶cDNA为模板进行RT-PCR扩增,PCR体系参照Ex Taq (TaKaRa)说明书。PCR反应程序: 94 ℃预变性2 min,94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸1 min 30 s,35个循环后,72 ℃延伸10 min。PCR产物经1.5% (w/v)琼脂糖凝胶电泳检测后,用凝胶回收试剂盒回收目的基因,连接pMD19-T载体,转化DH5α感受态细胞,提取质粒进行双酶切验证,将鉴定正确的菌液送往北京六合华大基因有限公司进行测序。

表1 本研究中所使用的引物Tab.1 PCR primers used in this study
1.2.4ApCOL1基因生物信息学分析
利用NCBI (http://www.ncbi.nlm.gov) BLASTX对ApCOL1蛋白进行保守结构域预测;SOPMA (https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.plpage=npsa_sopma.html)软件对蛋白的二级结构进行分析;Phyre2 Server (http://www.sbg.bio.ic.ac.uk/phyre2/html)软件进行蛋白的三级结构预测;利用ExPASy网站在线工具ProtParam (http://www.expasy.ch/tools/protparam.html)进行蛋白质氨基酸组成、相对分子质量、等电点和疏水性等理化性质的分析。利用Clustal X 2.0程序软件对氨基酸序列进行多重比对分析,采用MEGA 6.0软件进行系统进化树的构建与分析,其中用Neighbor-Joining进行1000次Boot-strap分析[33]。
1.2.5 小拟南芥ApCOL1的表达分析
利用qRT-PCR技术分析基因昼夜节律表达、组织表达及胁迫表达特征。基因特异引物为qApCOL1-F和qApCOL1-R,内参引物为GAPDH-F和GAPDH-R (表1)。qRT-PCR采用Fast SYBR Master Mixture试剂盒(康为世纪),美国ABI 7500 Fast实时荧光定量PCR仪(Life Technologies, Foster City, CA, USA)进行扩增。10 μL的反应体系中,包括cDNA模板2 μL,Fast SYBR Green Master Mixture 5 μL,ROX 0.2 μL,上下游引物各0.2 μL,RNase-Free Water补齐。反应程序:95 ℃预变性10 min,95 ℃变性15 s,60 ℃退火1 min,40个循环,60 ℃读取荧光值。检测每份样品的目的基因和内参基因的Ct值,每份样品3次PCR重复。qRT-PCR实验数据采用2-ΔCt法进行相对定量分析[34],利用SPSS软件进行差异显著性分析,Duncan新复极差法进行多重比较分析。
2 结 果
2.1 小拟南芥CO同源基因的克隆
基于小拟南芥转录组数据库基因功能注释,筛选了一个CO同源基因并命名为ApCOL1。为了获得小拟南芥ApCOL1基因的开放阅读框(ORF)序列,以小拟南芥的叶片cDNA为模板进行RT-PCR扩增,通过扩增获得目的片段,PCR产物大小约为1000 bp (图1)。结合转录组数据与测序结果(图1,图2),表明该序列全长为1320 bp,ORF大小为1071 bp,推测编码氨基酸356个(图2)。
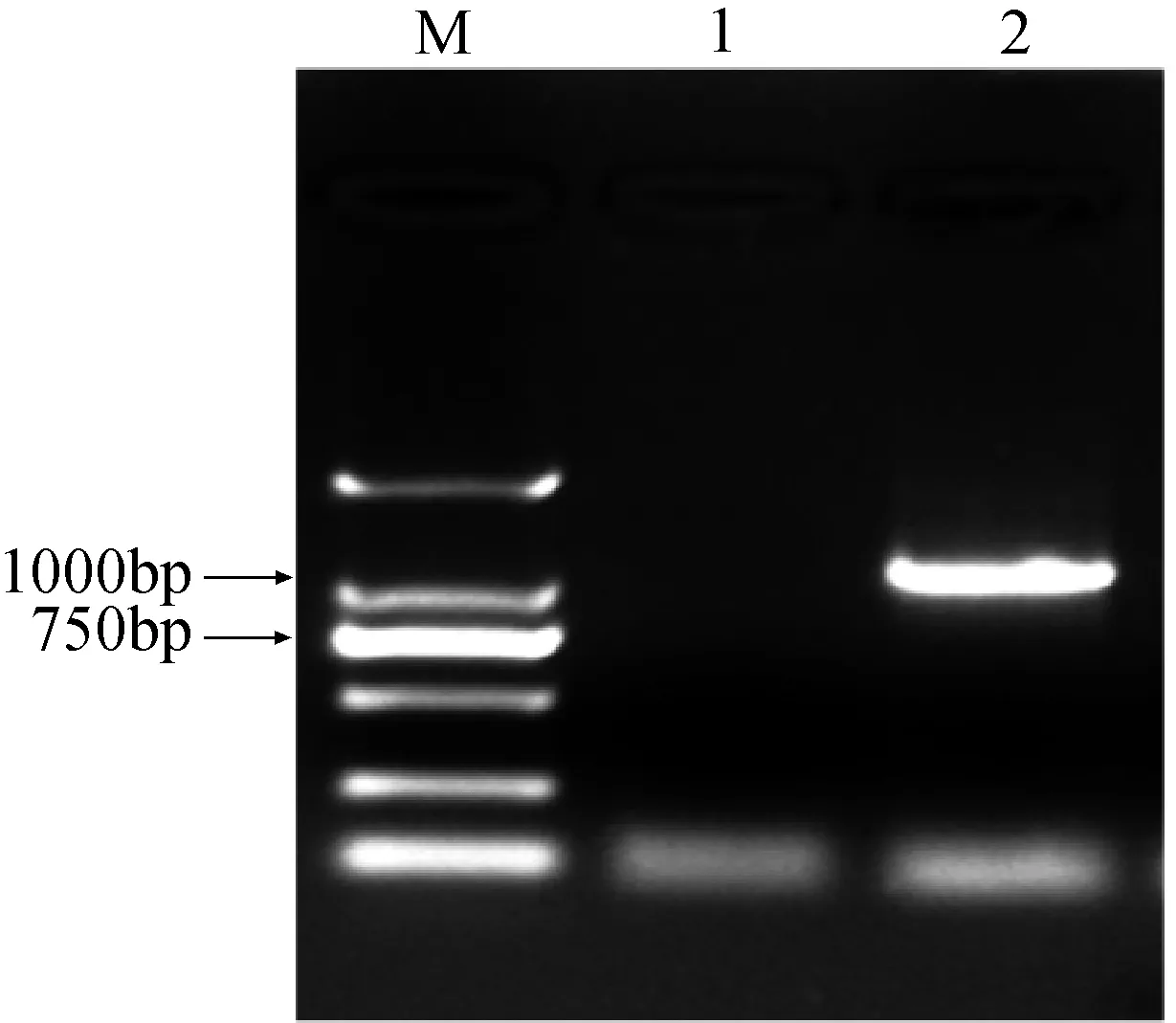
M:分子量maker,DL2000;1:阴性对照; 2:以小拟南芥叶片cDNA为模板的PCR产物;图1 ApCOL1基因的PCR扩增结果Fig.1 PCR amplification of ApCOL1 gene

红色横线表示起始密码子;* 表示终止密码子图2 ApCOL1核苷酸序列及推测氨基酸序列Fig.2 Nucleotide sequence of ApCOL1 and the putative amino acid sequence
2.2 生物信息学分析
保守结构域分析表明ApCOL1具有CO-like家族典型特征(图3)。ApCOL1蛋白的氨基末端有两个保守结构域B-box 1 (C-X2-C-X8-C-X2-D-X-A-X-L-C-X2-C-D-X3-H-X8-H)和B-box 2 (C-X2-C-X3-P-X4-C-X2-D-X3-L-C-X2-C-D-X3-H-X8-H),以及在羧基末端存在一个CCT结构域,该结构域大约由43个氨基酸组成(图4 A)。ApCOL1与拟南芥AtCOL1的氨基酸序列相似性为86.8%,B-box和CCT结构的残基相似性分别为93.8%和92.9%。选取17种不同物种包括拟南芥、琴叶拟南芥、亚麻芥(Camelinasativa)、甜菜(Betavulgaris)、甘蓝(Brassicaoleracea)、大麦、芥菜(Brassicajuncea)、黑芥菜(Brassicanigra)、向日葵(Helianthusannuus)、美洲黑杨、小立碗藓、欧洲云杉、萝卜(RaphanussativusL)、苹果(Malusdomestica)、水稻、大豆和丹参(Eutremasalsugineum)的COL1同源蛋白比对分析,发现不同物种COL1蛋白都具有其高度保守的B-box和CCT结构域(图4 B)。蛋白理化性质分析表明ApCOL1蛋白的分子量39.712 kDa,等电点为5.77,属于不稳定蛋白,平均亲水性系数为-0.713,亲水性系数为负值属亲水性蛋白,正值为疏水性蛋白。因此,小拟南芥ApCOL1是亲水性蛋白。蛋白的二级结构分析结果显示ApCOL1蛋白中含有105个α螺旋,占总数的29.49%,无规则卷曲有208处,占58.42%,还包含10.11%的延伸链和2.52%的β转角(图5)。蛋白三级结构同源建模表明ApCOL1蛋白与AtCOL1蛋白的三级结构相似性为97.8% (图6),以α螺旋为主。

图3 ApCOL1蛋白保守结构域预测分析Fig.3 The conserved domain of ApCOL1 protein
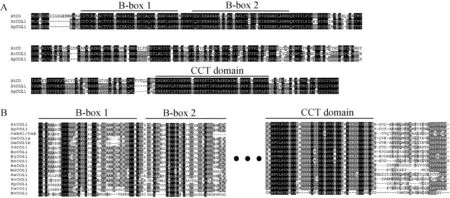
A:ApCOL1与AtCO、AtCOL1氨基酸比对;B:ApCOL1与不同物种间COL1蛋白比对分析图4 小拟南芥ApCOL1与不同物种COL1蛋白氨基酸序列多重比对分析Fig.4 Multiple alignment of amino acid sequences among ApCOL1 and other COL1 proteins from selected plant species

图5 ApCOL1蛋白二级结构预测Fig.5 Secondary structure prediction of ApCOL1
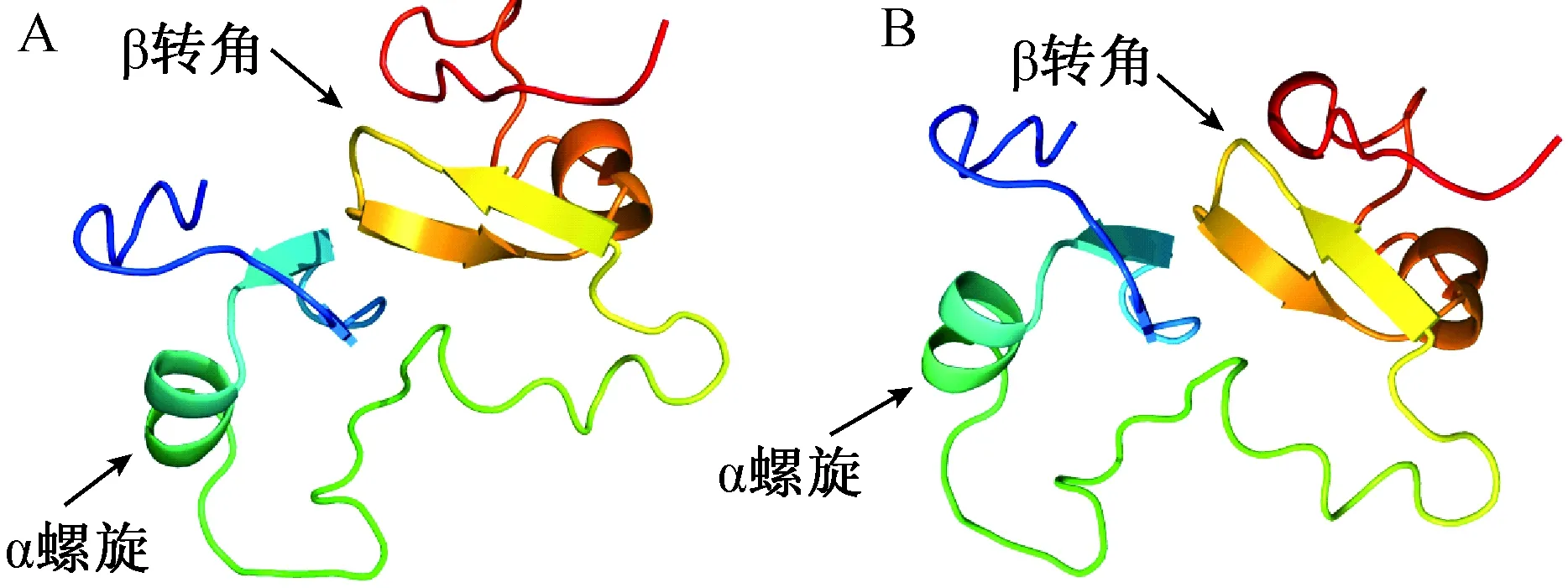
A:拟南芥AtCOL1蛋白三级结构;B:小拟南芥ApCOL1蛋白三级结构预测,红色代表N端,蓝色代表C端图6 ApCOL1蛋白三级结构预测Fig.6 Tertiary structure prediction of ApCOL1 protein
2.3 系统进化分析
为研究ApCOL1在不同物种中进化关系,我们利用18种不同物种间的COL1蛋白构建了系统发育进化树(图7A)。结果表明ApCOL1与AtCOL1、AlCOL1的亲缘关系最近,与亚麻芥COL1和荠菜COL1的亲缘关系较近。拟南芥CO-like家族成员被分为主要的三大亚组:AtCO-AtCOL5含有两个B-box和一个CCT结构域属于第一亚组;AtCOL6-AtCOL8和AtCOL16包括一个B-box和一个CCT结构域属于第二亚组;AtCOL9-AtCOL15含有一个B-box,一个锌指结构和一个CCT结构域属于第三亚组[11]。小拟南芥ApCOL1属于哪个亚组尚不清楚,进行了与拟南芥CO及16个CO基因同源性比对分析及系统进化分析,结果表明ApCOL1与AtCOL1归为一个亚组,且与拟南芥AtCOL1的亲缘关系最近(图7B),保守结构域分析结果表明ApCOL1在N端含有两个B-box结构域,在C端含有一个CCT结构域(图3,图7 C)。我们的研究表明ApCOL1属于第一亚组。
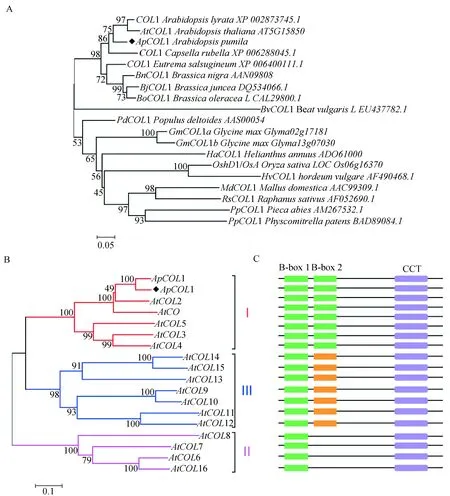
A:不同物种间COL1蛋白的亲缘关系;B:ApCOL1蛋白与拟南芥CO-like家族蛋白的亲缘关系,注:图中◆代表本研究克隆的ApCOL1蛋白; 分支点的数字表示Bootstrap验证中基于1000次重复该节点可信度的百分比;标尺代表每一位点氨基酸替换率。Ⅰ, Ⅱ, Ⅲ属于CO-like基因 家族中的不同分组;C:保守结构域模式图,绿色和橙色盒分别代表不同的N端B-box锌指结构,紫色盒代表C端CCT结构域图7 植物CO-like蛋白进化树分析Fig.7 Phylogenetic tree analysis of plant CO-like proteins
2.4 ApCOL1基因的表达特征分析
拟南芥AtCOL1、欧洲云杉COL1和COL2在调节昼夜节律方面起关键作用,大麦HvCOL1和香蕉MaCOL3参与植物开花过程[21,35-38]。本研究首先分析ApCOL1基因分别在LD或SD条件下的节律表达情况。qRT-PCR结果表明ApCOL1在LD和SD两种光照条件下具有相似的昼夜表达特征(图8)。在LD条件下,ApCOL1光照4-16 h后其表达水平呈下降趋势,进入黑暗条件4 h后ApCOL1的表达水平下降到最低,随后开始迅速积累并在第二天黎明时升至最高(图8 A)。在SD条件下,ApCOL1的表达变化与长日照条件下的情况类似,在有光条件下其表达量逐渐降低,进入黑暗条件8 h后ApCOL1的表达水平降至最低,随后快速积累并到第二天黎明出现表达峰值(图8B)。
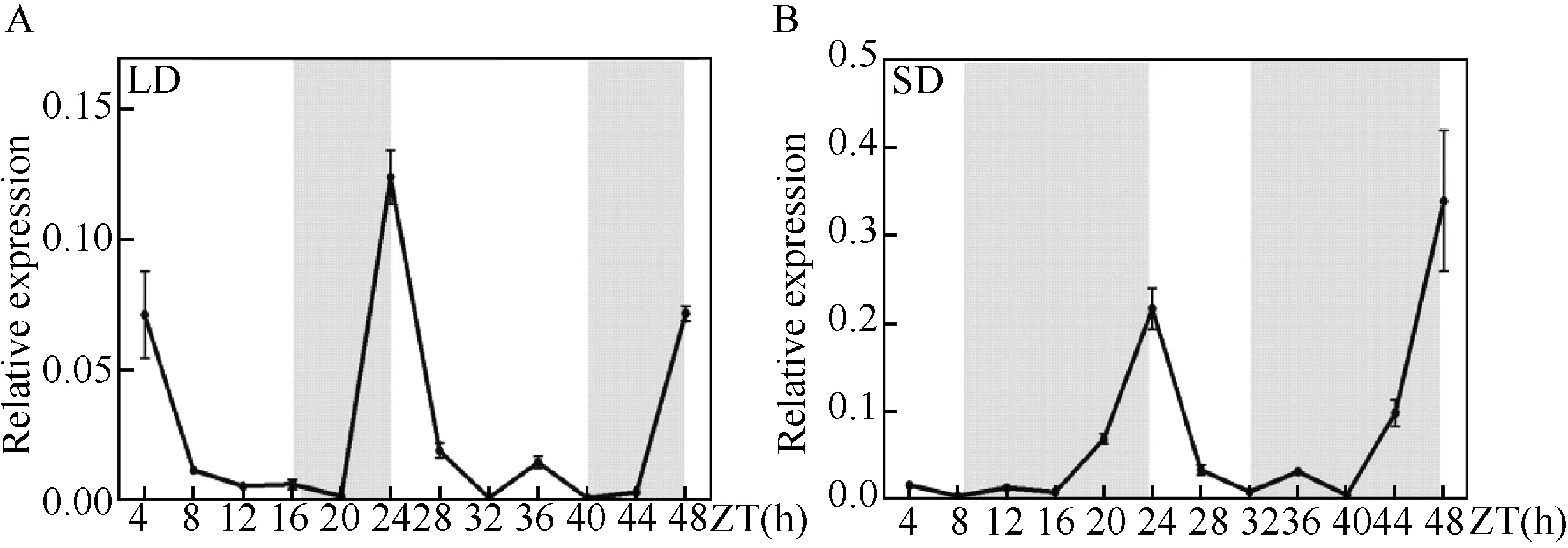
A:ApCOL1基因在长日照(16 h光照/8 h黑暗)下的表达分析;B:ApCOL1基因在短日照(8 h光照/16 h黑暗)下的表达分析;白色代表白天,灰色代表黑夜;ZT:不同时间图8 ApCOL1基因在长、短光照条件下的节律表达分析Fig.8 Diurnal expression patterns of ApCOL1 in LD and SD condition
组织表达分析表明ApCOL1基因在小拟南芥的下胚轴、根、茎、叶、花和果荚中均表达,但在果荚表达量最高,推测该基因参与小拟南芥果实的发育或种子的形成(图9)。我们进一步分析了ApCOL1基因响应不同胁迫处理的表达模式(图10)。结果表明250 mM NaCl胁迫明显下调ApCOL1基因的表达, 胁迫处理12 h,24 h和48 h表达量与0 h相比均显著降低,随着胁迫时间的延长其表达水平没有显著差异(图10A)。20% PEG-6000模拟干旱胁迫也能明显抑制ApCOL1基因的表达,且与盐胁迫处理下ApCOL1基因表达特征类似(图10B)。在高温(40 ℃)胁迫12 h,ApCOL1基因下调表达,24 h上调表达,48 h下降到对照水平(图10 C)。然而在低温(4 ℃)胁迫12 h和24 h,基因表达变化不明显,48 h表达水平显著下降(图10 D)。研究结果表明盐、干旱、高温和低温能够影响ApCOL1基因的表达。
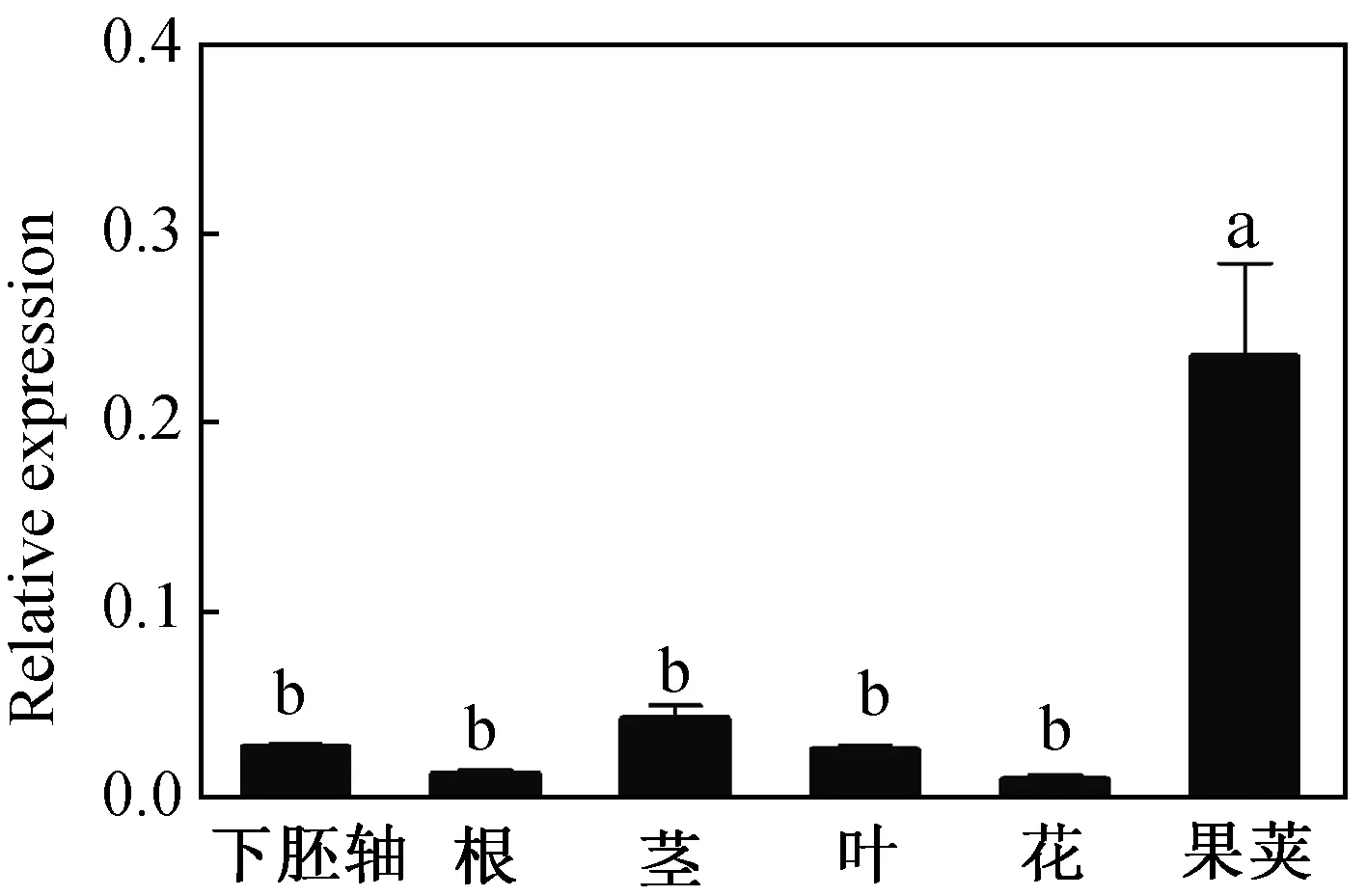
图9 小拟南芥ApCOL1组织表达分析Fig.9 Expression patterns of ApCOL1 in different tissues of A. pumila
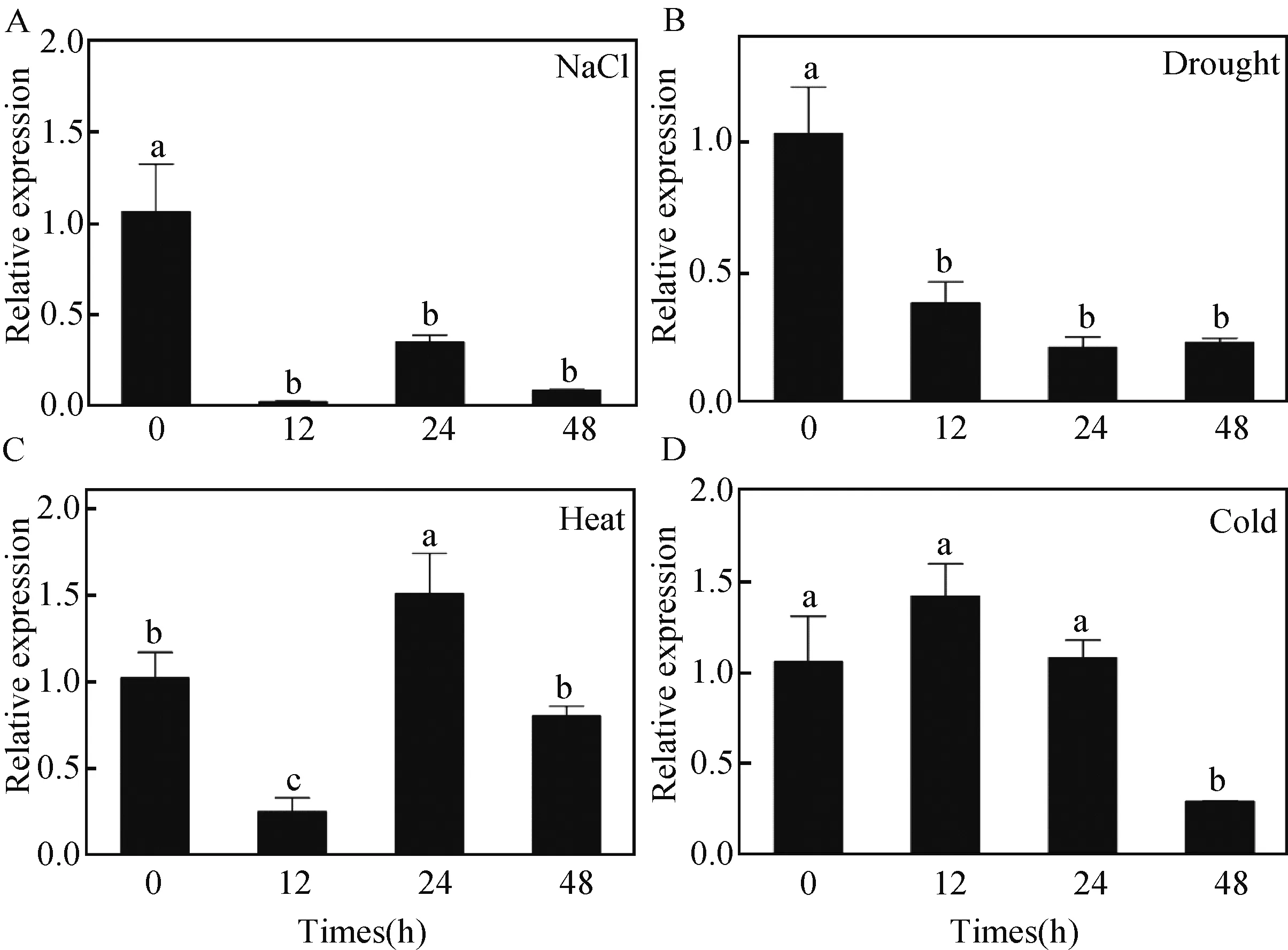
A:250 mmol/L NaCl胁迫处理ApCOL1表达情况;B:20% PEG-6000处理下ApCOL1表达情况;C:40 ℃高温胁迫处理下ApCOL1表达情况; D:4 ℃低温胁迫处理下ApCOL1表达情况。每个数据均是三次重复的平均值,数据以平均值±样本值标准误差(Mean±SE)表示(P<0.05)图10 不同胁迫处理下小拟南芥ApCOL1的表达分析Fig.10 Expression patterns of ApCOL1 under different stresses in A. pumila
3 讨 论
不同物种CO-like家族成员中的许多重要生物学功能已经被广泛报道,但是目前对于小拟南芥CO及CO-like的分子机制及功能还不清楚,因此分析其分子机制及功能有着十分重要的意义。本研究以短命植物新疆小拟南芥ApCOL1为研究对象,利用其三代全长转录组数据,从小拟南芥中克隆了ApCOL1基因完整的ORF。
ApCOL1蛋白保守域分析表明,ApCOL1在N端有两个保守的B-box,C端存在一个CCT结构域,属于CO-like家族。拟南芥CO-like家族主要被分为三大亚组,第I亚组包含两个B-box和一个CCT结构域[11]。此外,根据B-box和CCT域之间的次级保守域,第I组还可以进一步分为Ia,Ib,Ic,Id和Ie[11];第II亚组仅仅包含一个B-box和一个CCT结构域;第III亚组是由一个B-box、一个锌指结构域和一个CCT结构域组成[37,39]。本研究通过保守结构域(图3)、氨基酸序列的多重比对(图4)和蛋白结构分析(图6)表明ApCOL1与AtCOL1保守区域氨基酸组成相似,保守性强且保守结构类似。由此推测,小拟南芥ApCOL1蛋白的功能可能与ACOL1蛋白功能类似。此外,系统进化树分析结果显示ApCOL1与拟南芥CO-like基因家族中的AtCOL1亲缘关系最近(图7 B)。所以,我们推测小拟南芥ApCOL1属于第I亚组成员。
拟南芥中有关CO基因的研究表明,CO基因在整个生长发育过程及不同组织中广泛表达,其中在营养生长和生殖生长阶段叶片的维管组织中表达量最高[40]。本研究ApCOL1基因在各组织中均表达,尤其在果荚中呈优势表达(图9),推测该基因在小拟南芥种子形成和发育过程中可能起着重要作用。
植物CO-like基因表达受生物钟的调控,但不同的基因具有自己独特的昼节律表达特征[41]。小拟南芥ApCOL1基因在LD和SD两种光照条件下具有相似的节律表达特征:在刚进入黑暗条件时表达量下降,随后表达量由最低开始逐渐累积并在第二天黎明时达到表达峰值(图8)。说明ApCOL1基因与AtCOL1基因具有类似的昼夜节律表达模式[19],推测ApCOL1基因能够调节植物的昼夜节律。
目前,对CO-like基因家族的研究主要集中在植物光周期和昼夜节律调控方面,但是关于响应非生物胁迫的研究较少。已有的研究表明拟南芥AtCOL4能够响应ABA和盐胁迫[42],水稻OsCOL9通过施加外源水杨酸和乙烯能够与支架蛋白OsRACK1互作从而增强水稻的抗性[43],杨树COL2基因的表达水平受高温胁迫抑制[18],病原体胁迫和冷胁迫能够增强香蕉MaCOL1基因的表达[22]。因此,我们分析了不同胁迫处理对ApCOL1基因表达的影响(图10),结果表明250 mmol/L NaCl胁迫和20% PEG-6000模拟干旱胁迫12 h明显抑制ApCOL1基因的表达,并且随着胁迫时间的延长ApCOL1表达水平没有显著差异。高温(40 ℃)胁迫不能完全抑制ApCOL1基因的表达,ApCOL1基因的表达在24 h内先下降后上升并达到最高,48 h又下降到对照水平。低温(4 ℃)胁迫24 h之前,ApCOL1基因的表达没有明显变化,但处理48 h表达水平显著下降。说明ApCOL1基因在小拟南芥应对非生物胁迫中起着重要作用。本研究结果为深入分析小拟南芥ApCOL1基因在逆境胁迫中的功能,探索短命植物适应环境的分子机制奠定了基础。

