大鼠Neuritin基因启动子区克隆、鉴定及生物信息学分析
李琼琼,王立民,徐梦思,万科幸,黄瑾,王成坦,毛福秀,高蕊*
(1 石河子大学医学院/新疆地方与民族高发病教育部重点实验室,新疆 石河子 832002; 2 新疆农垦科学院省部共建绵羊遗传改良与健康养殖国家重点实验室,新疆 石河子 832000)
以色列科学家Nedivi于1993年首次在大鼠海马齿状脑回cDNA 文库中克隆出Neuritin基因[1]。随后,其又发现光刺激可诱导大鼠视觉皮质中可塑性相关候选基因15的表达[2]。时隔四年,Naeve等人再次从人类大脑皮质cDNA 文库中筛选并鉴定出该基因,发现其纯化蛋白具有促进神经突起的快速生长和加速分支形成的作用,因此将其正式命名为Neuritin[3]。Neuritin基因富集表达于脑组织,在不同发育阶段,Neuritin的表达区域亦有所变化:发育过程中,Neuritin主要表达于皮质、海马、大脑的感觉区;在成年期,则主要表达在与可塑性相关的神经区域,如海马、嗅球、蒲肯野氏细胞中[3-5]。大量研究表明,Neuritin不仅能促进神经突起的生长及其分支的形成,促进突触的发育成熟,调节突触回路的形成,还能促进神经元的迁移,抑制神经细胞凋亡,维持神经元的存活[4, 6-9]。
启动子区域是参与真核生物的转录活性调控的重要区域,在基因转录调控中发挥重要作用[10]。由于第四版大鼠基因组Neuritin基因启动区域组装有误(RGSC 6.0/rn6),迄今为止仍未见大鼠Neuritin基因启动子序列与启动Neuritin转录活性的文献报道。相关Neuritin基因表达调控的研究主要集中在在诱导表达上,研究发现Neuritin的表达调控在胚胎发育期是非活动依赖的,而在出生后至成年期,Neuritin的激活区域与神经活动依赖的可塑性相关区域相重叠[11-13],除了KA[3]、光线刺激[1]、突触活动[14]、BDNF[15]、NGF[16]、GDNF[17]可诱导Neuritin基因表达外,雄激素[18]和神经兴奋剂[19]也可诱导Neuritin基因的表达;而在脊髓损伤[20]、缺氧[21]、脑外伤[22]、电惊厥治疗[23]、抗抑郁药[24-25]作用后Neuritin的表达也出现了上调。本课题组前期研究发现全脑短暂性缺血再灌注模型大鼠Neuritin基因表达显著升高,且其表达水平的变化趋势恰好与机体的修复程度呈正相关[26-28]。
基于以上研究背景。本研究根据物种的同源性设计引物克隆大鼠Neuritin启动子区域序列,并采用Sanger测序技术对其序列进行鉴定,利用生物信息学方法分析其序列特征,预测启动子主要调控区域转录因子结合位点,为进一步深入研究其表达调控机制奠定基础。
1 材料与方法
1.1 试验动物
成年健康Sprague-Dawley大鼠购买于新疆疾病预防与控制中心,体重约200 g,取0.5 cm鼠尾剪碎,用于提取组织总DNA。
1.2 试验试剂
Tris碱、乙二胺四乙酸二钠(EDTA-2Na)、氯化钠(NaCl)、十二烷基硫酸钠(SDS)、浓盐酸、Tris平衡酚、氯仿(三氯甲烷)以及琼脂糖为实验室留存试剂。青霉素、链霉素购自于Invitrogen公司。高保真酶购自天根生化(北京)有限公司。大肠杆菌DH5α感受态细胞购自全式金生物技术有限公司。PCR产物纯化试剂盒、质粒小抽提试剂盒、高糖DMEM细胞培养基及胎牛血清购于OMEGA公司;pMDTM19-T载体、LA酶购自宝生物工程(大连)有限公司。
1.3 试验方法
1.3.1 基因组DNA提取
采用苯酚-氯仿抽提法提取大鼠鼠尾组织基因组DNA,75%的乙醇洗涤2次,ddH2O溶解基因组至终浓度为200 ng/μL,OD260/280比值为1.8-2.0,基因组DNA于-20 ℃。
1.3.2 大鼠Neuritin基因5’调控区引物设计
以小鼠Neuritin基因CDS区上游3000 bp的碱基序列为参考序列,采用比较基因组学的方法同第四版大鼠基因组Neuritin基因启动子区域进行比较,采用oligo 6.0软件针对涵盖大鼠Neuritin基因启动子的上、下游保守序列设计引物,由Invitrogen公司合成,引物信息如下:
PFnrn1∶5’-CCGCTCGAGGTCAAACCATTTGCGACCGCAGACC-3’。
PRnrn1∶5’- CTAGCTAGCGAAGGGGAAAGCATCCTTTACCCCT-3’。
1.3.3 大鼠Neuritin基因5’调控区PCR扩增和测序
以大鼠基因组DNA为模板进行扩增,PCR反应体系为50 μL:LA酶和高保真酶各0.5 μL,LA Buffer 5 μL,dNTP 8 μL,模板1 μL,上下游引物各1 μL,ddH2O 33 μL。扩增反应条件:94 ℃预变性30 s;98 ℃ 10 s,68 ℃ 3min共进行40个循环;72 ℃延伸10 min;4 ℃保存。PCR产物用0.7%琼脂糖凝胶电泳分离,切胶回收。将回收产物克隆入pMDTM19-T Vector载体,并转化到DH5α感受态细胞中,挑取阳性克隆,采用质粒提取试剂盒提取质粒,送新疆昆泰锐生物公司测序。
1.3.4 大鼠Neuritin基因5′ 调控区生物信息学分析
利用启动子生物信息学软件EMBOSS Cpgplot(http://www.e bi.ac.uk/Tool s/seqstats/e mboss_cpgplot/)和Promoter Scan(http://www-bimas.cit.nih.gov/molbio/proscan)对大鼠Neuritin基因5′调控区序列进行预测分析,初步确定启动子核心调控区域。
1.3.5 大鼠Neuritin基因启动子主要调控区域生物信息学分析
利用Promoter scan,AliBaba2.0,TRBIND,Match 1.0 Public及TFSEARCH(表1)等生物信息学软件预测大鼠Neuritin基因启动子主要调控区域的转录因子结合位点。

表1 启动子在线分析软件Tab.1 Online softwares for promoter analyzing
2 结果
2.1 大鼠Neuritin基因5′ 调控区扩增及序列的测序
以大鼠鼠尾组织基因组DNA为模板,对预设的大鼠Neuritin基因启动子区域进行PCR扩增,扩增产物经电泳检测,扩增得到一条大小约为3400 bp的特异性条带(图1)。Neuritin扩增片段纯化后连接至 T 载体、转化感受态细胞、涂板、挑取单一菌落,采用质粒提取试剂盒提取质粒,采用XhoⅠ和NheⅠ限制性核酸内切酶初步鉴定出阳性克隆(图2)。阳性质粒送测序公司测序,测序结果与大鼠
Neuritin基因完全一致,鉴定为大鼠Neuritin基因5′ 调控区序列(图3)。
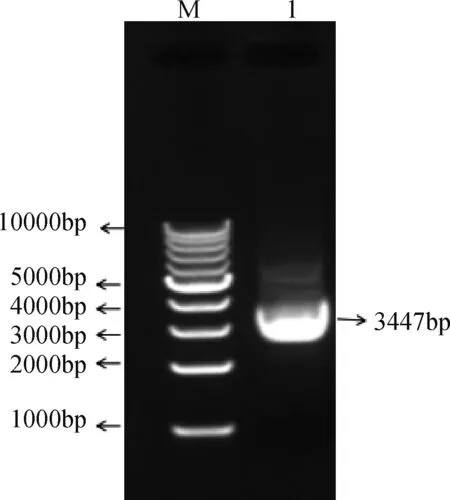
M:1 kb Marker;1:PCR扩增产物图1 大鼠Neuritin基因5′调控区PCR扩增产物电泳图谱Fig.1 Electrophoresis chart of 5′ regulatory region of Rat Neuritin
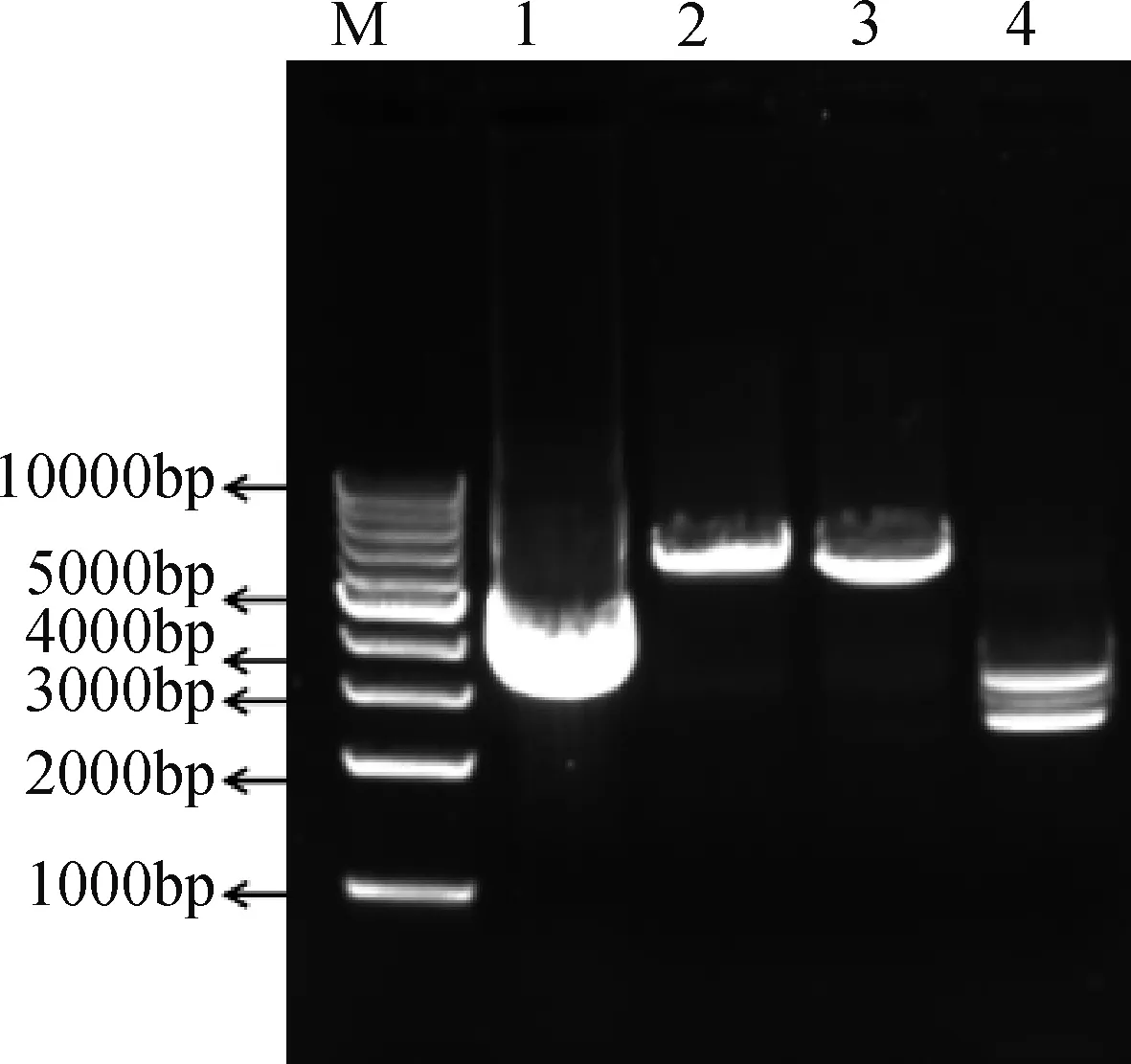
M: 1 kb Marker; 1:重组质粒pMD19-Nrn1-promoter; 2: XhoⅠ单酶切(6140 bp);3: NhoⅠ单酶切(6140 bp); 4:双酶切(2693 bp;3447 bp)图2 Neuritin启动子区域重组质粒酶切鉴定Fig.2 Identification of recombinant vectors of Neuritin promoter region by restriction enzymes
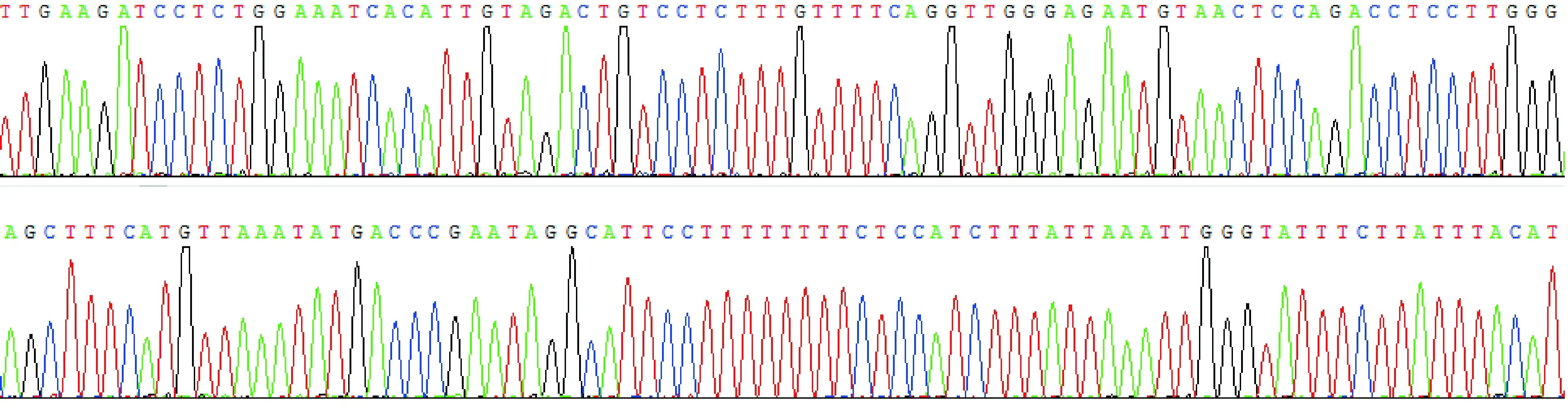
图3 大鼠Neuritin启动子区域阳性质粒部分序列测序图谱Fig.3 Sequencing of partial sequences of positive plasmid of rat Neuritin promoter region
2.2 大鼠Neuritin基因5′调控区序列分析
对阳性质粒测序后的碱基组成进行分析,大鼠Neuritin基因5′调控区序列中A、T、G、C碱基含量分别为21.4%、24.9%、26.1%和27.6%,其中A+T含量为46.3%,G+C含量为53.7%。同源性分析发现,大鼠Neuritin基因5′调控区序列与人和小鼠的一致性分别为92.9%和91.1%。
利用Promoter Scan软件预测发现在大鼠Neuritin基因5′调控区序列CDS区上游224 bp处有一个TATA 盒,并预测了多个转录因子结合位点。利用EMBOSS Cpgplot在线工具检索了所克隆的约3447 bp启动子区域的CpG岛,进一步发现距大鼠NeuritinCDS区上游740~1012 bp位置处有一个CpG岛(图4、图5)。据此初步证实Neuritin基因核心启动子位于Neuritin基因起始位点前1100 bp的上游片段。

下划线为为CpG岛,加粗字体灰色为转录因子结合位点,加粗灰色斜体为TATA-Box图4 大鼠Neuritin基因5′调控区核苷酸序列Fig.4 Sequences of 5′regulatory region in Rat Neuritin
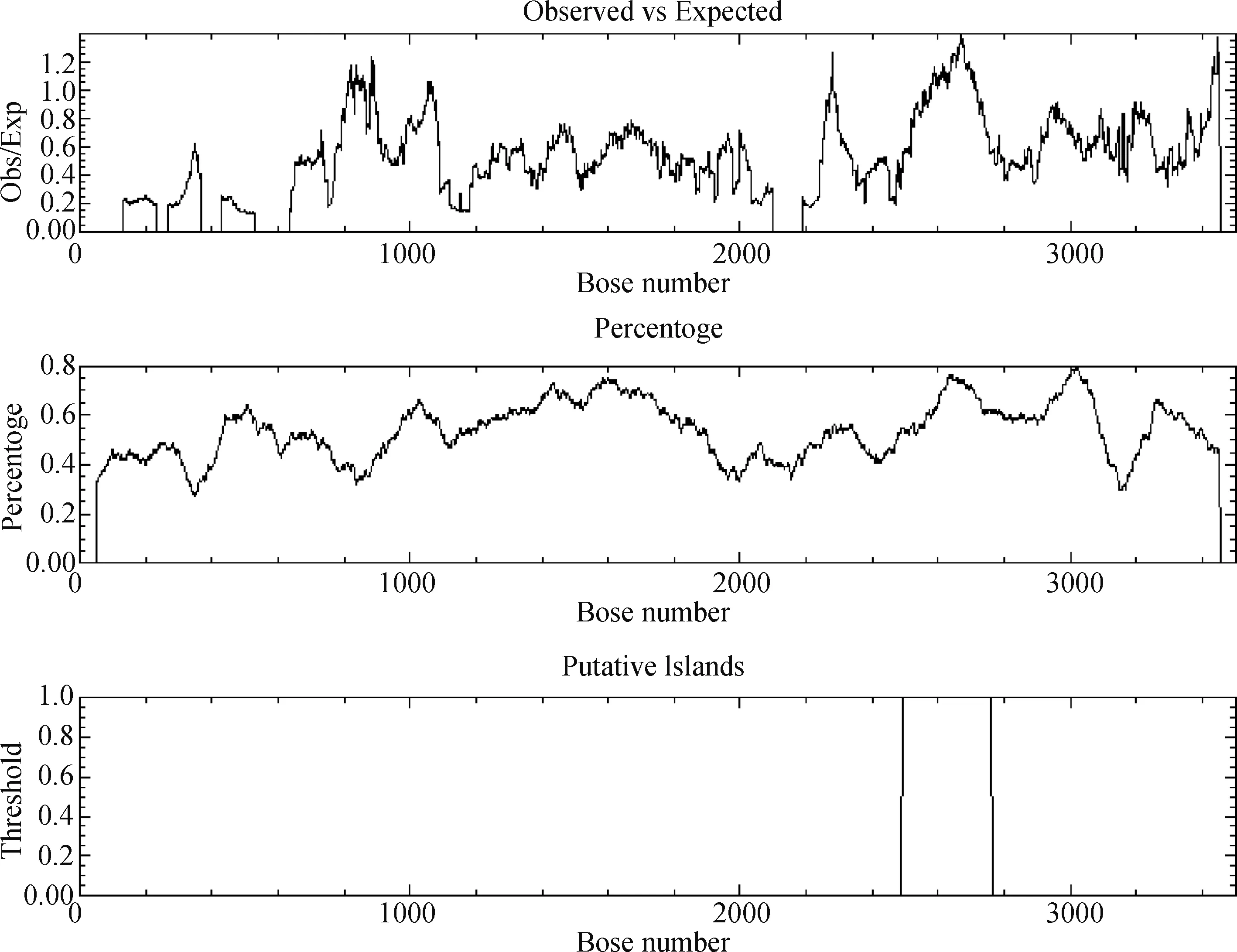
图5 大鼠Neuritin基因5′调控区CpG岛预测结果Fig.5 Prediction of CpG islands in 5′ regulatory region of Rat Neuritin
2.3 大鼠Neuritin基因启动子主要调控区域转录结合位点生物信息学分析
依据上述以上的分析结果,进一步利用五款转录因子分析软件(Promoter scan,AliBaba2.0,TRBIND,Match 1.0 Public和TFSEARCH)对大鼠Neuritin基因5′调控区1100 bp的核心启动子区域进行转录结合位点生物信息学分析,我们采用严苛的求五种预测软件预测结果的交集的方法,最终筛选出与Neuritin基因启动相结合的候选转录因子。对于预测得出交集的转录因子结合位点,进一步将这些位点序列与小鼠和人的序列进行比较,将转录因子结合位点同源性高的转录因子作为最终候选转录因子结合位点。结果显示共筛选出CREB,AP-1,GATA-1,AP-2,AP-4,RAP1,MCM1和Pit八个转录因子(表2)。

表2 五款转录因子预测软件预测的结果(交集)Tab.2 Prediction results of five transcription factor prediction softwares (intersection)
3 讨论
有关Neuritin表达调控机制的研究十分有限,现有的研究表明Neuritin基因的表达调控机制存在3种不同的途径:(1)神经营养因子的诱导途径,当外源性BDNF作用于神经元时,可通过TrkB 受体途径激活Neuritin的表达,但阻断TrkB 受体后只阻断BDNF对Neuritin的激活,而不影响KCL诱导Neuritin表达的作用[3]。(2)神经活动的独立诱导途径,神经活动可激活N-甲基-D-天(门)冬氨酸(N-methyl-D-aspartate,NMDA) 受体,通过开放电压门控的L型钙通道,引发胞外钙离子内流,促使细胞内钙离子浓度迅速增加,激活钙调蛋白结合的靶标蛋白钙调蛋白激酶(CaM kinases)和细胞分裂素活化蛋白激酶(mitogen-activated protein kinase, MAPK) 通路,独立诱导Neuritin的表达[33]。该信号转导通路可被钙调蛋白激酶抑制剂制 KN-62 所阻断,但却不能阻断BDNF对Neuritin基因的激活作用[13]。(3)对Neuritin基因转录后水平表达调控途径的研究发现,神经元特异性的RNA结合蛋白Hud蛋白与Neuritin的表达存在一定相关性,Hud蛋白能够结合到Neuritin转录产物3’非翻译区的AU富集区,从而参与Neuritin基因的表达[29]。Akten等[30]发现,运动神经元生存(survival motor neuron, SMN)蛋白可与Hud蛋白形成复合体,通过调控Neuritin基因转录后水平的表达,参与挽救脊髓性肌萎缩症中运动神经元轴突的缺失。在表观调控机制方面,本课题组利用Solexa高通量测序技术对全脑短暂性缺血再灌注和正常对照的大鼠脑组织小RNA进行测序[28],筛选出差异表达的miRNA,并应用双荧光素报告系统及细胞水平实验,验证了miR-204在转录后水平对Neuritin基因具有负向调控作用[31]。
启动子是基因的重要组成部分,是真核生物基因表达调控的顺式作用元件,控制基因表达的起始时间和表达丰度[10]。因此,了解启动子的功能活性对于研究基因的表达调控十分重要。由于UCSC数据库上大鼠Neuritin基因启动子存在拼接错误,本研究根据比较基因组设计在小鼠和大鼠基因组上均高度保守的上、下游引物扩增大鼠Neuritin基因CDS区上游3447 bp的碱基序列,大鼠Neuritin基因启动子所克隆的序列与小鼠的同源性高达91.1%,与人的Neuritin基因启动子序列的同源性高达93%,其序列的同源性与人更为接近。生物信息学分析发现大鼠Neuritin基因5′调控区序列CDS区上游224 bp处存在典型的TATA-Box。TATA-Box是存在于真核生物启动子中很常见的一种顺式作用元件,它存在于由RNA聚合酶Ⅱ所转录的大多数真核生物基因的近端启动子中,TATA-Box可以与其他启动子元件联合起作用,一起调控启动子的转录活性[32]。本研究还发现距大鼠NeuritinCDS区上游1100-850 bp位置处有一个CpG岛,CpG岛含有丰富的CG碱基,易于发生DNA甲基化,提示大鼠Neuritin基因的表达调控可能还涉及到表观遗传修饰,如甲基化修饰的调节。本研究还对Neuritin基因CDS区上游1100 bp的核心启动子区域进行转录因子结合位点分析,筛选出CREB,AP-1,GATA-1,AP-2,AP-4,RAP1,MCM1和Pit 8等八个转录因子。物种同源性比对性结果显示CREB和AP-1的结合位点序列与人和小鼠Neuritin启动子序列同源性较高。大量研究表明转录因子CREB在神经系统的发育、抑郁、成瘾性、生理周期中,特别是在长时程记忆过程中具有重要作用[33],其可能在Neuritin基因的表达调控中扮演重要角色。
本研究鉴定了大鼠Neuritin基因的启动子区域,这不仅对于深入阐Neuritin基因的表达调控机制奠定了坚实的基础,而且也有助于进一步解释Neuritin基因在神经受损后的再生中过程中行驶的生物学功能。

