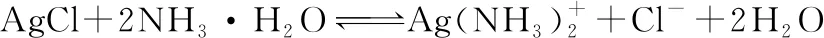基于“学科”素养 着眼“能力”提升——2019年高三化学冲刺备考策略
河北
2019年《考试大纲》明确指出:“化学学科命题注重测量自主学习的能力,以能力测试为主导,将在测试考生必备知识、关键能力和思维方法的基础上,全面检测考生的化学科学素养。”从近几年的高考命题来看,试题突出对主干知识,强化化学基本方法、基本思想、学科核心素养的考查。同时,重视理论联系实际,关注与化学有关的科学技术、社会经济和生态环境的协调发展,促进学生在知识和技能、过程和方法、情感态度和价值观等方面的全面提升。基于此,发挥“考纲”功能,着眼“能力”提升,才是复习之根本。依据“考纲”中的考核目标与要求,结合化学学科体系和学科特点,从以下三个方面进行针对性的冲刺备考,最终实现复习的最大效益。
策略之一:落实“考纲”要求,强化核心考点
《考试大纲》明确写出知识内容的要求层次,强调领会所学化学知识的含义及其适用条件,能够正确判断、解释和说明有关化学现象和问题。在理解所学各部分化学知识之间的本质区别与内在联系的基础上,运用所掌握的知识进行必要的分析、类推或计算,解释、论证一些具体的化学问题。特别是涉及理解(掌握)和综合运用的知识,必将成为高考的核心考点。为此,在冲刺复习阶段要做到对照《考试大纲》,领会“考点”的本质,做到能“知其然”,还能“知其所以然”,从而实现知识的再升华。例如,在强化“核心考点”的复习中,要依据“教材”特点和《考试大纲》要求,抓住主要知识的精髓,特别是“物质结构、氧化还原反应、离子反应、化学平衡、元素化合物知识、电化学、化学实验、化学基本计算等”核心内容,都要依据《考试大纲》要求,深化理解,建构知识网络,提高解决化学问题的综合能力。
【例1】氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。
回答下列问题:
(1)与汽油相比,氢气作为燃料的优点是____________________(至少答出两点)。但是氢气直接燃烧的能量转换率远低于燃料电池,写出碱性氢氧燃料电池的负极反应式_____________。
(2)氢气可用于制备H2O2。已知:




a.容器内气体压强保持不变
b.吸收ymol H2只需1 mol MHx
c.若降温,该反应的平衡常数增大
d.若向容器内通入少量氢气,则v(放氢)>v(吸氢)
(4)利用太阳能直接分解水制氢,是最具吸引力的制氢途径,其能量转化形式为________。

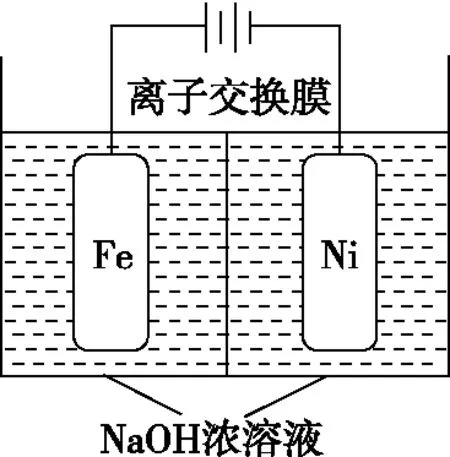
图1

图2
①电解一段时间后,c(OH-)降低的区域在________(填“阴极室”或“阳极室”)。
②电解过程中,须将阴极产生的气体及时排出,其原因是__________。
③c(Na2FeO4)随初始c(NaOH)的变化如图2,任选M、N两点中的一点,分析c(Na2FeO4)低于最高值的原因:______________________________。




(4)利用太阳能直接分解水制氢,是将光能转化为化学能。
(5)①根据题意可知,镍电极有气泡产生是氢离子放电生成氢气,铁电极发生氧化反应,溶液中的氢氧根离子减少,则电解一段时间后,c(OH-)降低的区域在阳极室。②氢气具有还原性,根据题意Na2FeO4只在强碱性条件下稳定,易被H2还原。电解过程中,需将阴极产生的气体及时排出,防止Na2FeO4与H2反应使产率降低。③依题意Na2FeO4只在强碱性条件下稳定,在M点:c(OH-)低,Na2FeO4稳定性差,且反应慢;在N点:c(OH-)过高,铁电极上有氢氧化铁生成,使Na2FeO4产率降低。
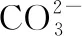
策略之二:落实“考纲”要求,梳理课本知识
《考试大纲》明确了对中学化学基础知识能正确复述、再现、辨认,并能融会贯通。通过对自然界、生产和生活中的化学现象的观察,以及实验现象、实物、模型的观察,对图形、图表的阅读,获取有关的感性知识和印象,并进行初步加工、吸收、有序存储。为此,在冲刺复习阶段一定要回归课本,认真梳理课本知识,特别是《考试大纲》对每个知识内容的要求层次,做到了解、理解(掌握)、综合应用的目的。例如,《物质结构与性质》在高考中属于选考内容,在复习这一部分内容时,学生更应该强化课本知识,依据《考试大纲》对知识内容的要求层次,认认真真地梳理每一个知识点,做到在解决化学问题(习题)时,能从课本上找到“源头”,明确无论是简单题、难题的“根”都离不开课本,培养学生分析问题和解决问题的综合能力。
【例2】锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)基态Ge原子的核外电子排布式为[Ar]________,有________个未成对电子。
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键。从原子结构角度分析,原因是________。
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因:________。

(4)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是____________。
(5)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为________________________,微粒之间存在的作用力是________________________。


②晶胞参数,描述晶胞的大小和形状,已知Ge单晶的晶胞参数a=565.76 pm,其密度为________g·cm-3(列出计算式即可)。

【解析】(1)Ge是32号元素,与碳元素是同一主族的元素,在元素周期表中位于第四周期ⅣA族,则基态Ge原子的核外电子排布式为[Ar]4s24p2,也可写为3d104s24p2;在其原子的最外层的2个4s电子是成对电子,位于4s轨道,2个4p电子分别位于2个不同的4p轨道上,所以基态Ge原子有2个未成对的电子。
(2)Ge与C是同族元素,C的原子半径较小,原子之间可以形成双键、叁键;但Ge原子之间难以形成双键或叁键,从原子结构角度分析,这是由于锗的原子半径大,原子之间形成的σ单键较长,p-p轨道肩并肩重叠的程度很小或几乎不能重叠,难以形成π键。
(3)从表中数据可知,锗元素的卤化物在固态时都为分子晶体,分子之间通过微弱的分子间作用力结合;对于组成和结构相似的物质来说,相对分子质量越大,分子间作用力越大,熔沸点越高。由于相对分子质量:GeCl4 (4)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。元素的非金属性越强,其吸引电子的能力就越强,元素的电负性就越大。元素Zn、Ge、O的非金属性强弱顺序是O>Ge>Zn,所以这三种元素的电负性由大至小的顺序是O>Ge>Zn。 (5)锗与金刚石结构相似,金刚石中碳原子是sp3杂化,锗晶体中锗也是相同的杂化;由于是同一元素的原子通过共用电子对结合,所以微粒之间存在的作用力是非极性共价键,即原子间以共价键结合。 【点评】高考对“物质结构与性质”模块内容的命题,试题立足课本,强调对原子结构与性质、分子结构与性质、晶体结构与性质的核心概念和基础知识的理解和运用,突出能力的考查,是高考必考题型之一。本题是一道涉及锗(Ge)原子、分子结构和晶体结构的题目,试题有一定难度。为此,解决好这类问题的关键,就是掌握课本知识,即物质结构包括原子结构(原子核外电子排布、原子的杂化方式、元素电负性大小比较、元素金属性与非金属性的强弱)、分子结构(化学键、分子的电子式、结构式、结构简式的书写、化学式的种类、官能团等)、晶体结构(晶体类型的判断、物质熔沸点的高低和影响因素、晶体的密度、均摊方法的应用等)。特别是一些重要的难点内容要重视方法、规律的总结,真正弄懂,融会贯通,学会迁移运用。 《考试大纲》明确了化学学科命题注重考查学生自主学习的能力,重视理论联系实际,关注与化学有关的科学技术、社会经济和生态环境的协调发展,以促进学生在知识和技能、过程和方法、情感态度和价值观等方面的全面发展。为此,在冲刺复习中,要对照《考试大纲》,优化真题训练,通过训练复习,提高解题技巧和准确性,优化解题思路和方法。做到真正弄懂,融会贯通,实现能力的再升级。例如,在复习后期,要强化以能源、环境、化工生产、社会热点等为情景,结合图象、数据、图表、化学工艺流程(框图)、化学实验控制变量、新药、新的染料中间体、新型有机材料的合成等为信息载体的高考必考“主打”题目,一定要训练到位,时时反思,认真总结,才能做到知己知彼,百战不殆,在高考中取得好成绩。 【例3】某科研小组采用如下方案回收一种光盘金属层中的少量Ag(金属层中其他金属含量过低,对实验的影响可忽略)。 (1)“氧化”阶段需在80℃条件下进行,适宜的加热方式为____________________。 (2)NaClO溶液与Ag反应的产物为AgCl、NaOH和O2,该反应的化学方程式为________。 HNO3也能氧化Ag,从反应产物的角度分析,以HNO3代替NaClO的缺点是________。 (3)为提高Ag的回收率,需对“过滤Ⅱ”的滤渣进行洗涤,并____________________。 (4)若省略“过滤Ⅰ”,直接向冷却后的反应容器中滴加10%氨水,则需要增加氨水的用量,除因过量NaClO与NH3·H2O反应外(该条件下NaClO3与NH3·H2O不反应),还因为____________________。 (5)请设计从“过滤Ⅱ”后的滤液中获取单质Ag的实验方案:____________________(实验中须使用的试剂有:2 mol·L-1水合肼溶液,1 mol·L-1H2SO4)。 【解析】(1)根据题给信息,“氧化”阶段需在80℃条件下进行,由于加热温度低于水的沸点,则适宜的加热方式为水浴加热。 (3)为提高Ag的回收率,需对“过滤Ⅱ”的滤渣进行洗涤,洗涤的目的是为了把滤渣表面残存的银氨配离子洗涤下来,并将洗涤后的滤液合并入“过滤Ⅱ”的滤液中。 【点评】高考《考试大纲》突出了元素化合物典型物质制备的考查,命题以“真实的实验(工艺)流程”为背景,将元素化合物知识、化学反应原理、化学实验和化学用语等方面的知识融合在一起,着力考查实验分析能力,强调元素化合物知识与实验的结合,是高考中的必考题目之一。本题是一道涉及回收一种光盘金属层中的少量Ag的化学工艺流程试题,试题难度不大。为此,解决这类问题的关键,就是要把握好流程中发生的核心反应,根据试题给予的信息(流程)进行分析、推导和判断,围绕“预处理”“核心反应”“提纯分离”等环节,通过实验(工艺)条件的选择,具体实验(工艺)措施的解释等来解决试题中的问题。对于比较复杂的问题,在读懂流程图、明确每一步骤的操作,涉及的化学反应以及弄明白每一中间混合物的微粒种类的前提下,从基本理论(氧化还原、化学平衡、盐类水解、电化学等)、反应条件的控制(温度、压强、催化剂、原料配比、pH调节、溶剂选择、除杂、产品分离等)、绿色化学观点(原子经济性、循环操作、环保)、经济角度(提髙产量与产率、原料廉价易得、降低能耗、设备简单)、安全生产(防爆、防中毒、防污染)等方面进行联想解题。同时,答题时要注意化学用语的规范性,尤其要注意原理性描述语言跟操作性语言描述的区别。
策略之三:落实“考纲”要求,优化真题训练