罗红霉素片仿制药与原研药溶出行为一致性研究及溶出度方法的建立
刘亚威 姚兰 张亚杰
(辽宁省药品检验检测院,沈阳 110036)
罗红霉素为大环内酯类抗生素,抗菌谱与红霉素相仿,对敏感菌株引起的呼吸道感染、耳鼻喉科感染、泌尿生殖道感染、皮肤软组织感染及军团菌感染有较好的疗效[1]。罗红霉素的不良反应一般轻微,发生率较低,在我国应用广泛[2]。罗红霉素由法国Roussel-Uclaf公司研制,1987年在法国首次上市,商品名为罗力得(rulide)。国内浙江震元制药有限公司于1995年生产上市,目前国内已有数十家原料药和制剂生产企业。
罗红霉素为水难溶性药物,分类属于BCSⅡ类,即低溶解、高渗透药物,且为pH值依赖性药物。因此罗红霉素制剂的溶出度是其研发过程中的关键因素。建立有区分力的溶出曲线可以在一定程度上比较出仿制制剂与原研制剂的差别,评价药品的质量[3-4]。
本研究参照国内外标准,建立新的溶出曲线测定方法,并对国内21家生产企业生产的罗红霉素片各选1批次样品进行溶出曲线的考察,并与法国赛诺菲公司原研罗红霉素片进行比对,采用美国食品药品监督管理局(FDA)推荐的相似因子(f2)对其进行相似性评价;鉴于罗红霉素的酸不稳定性[5],本文还进行了罗红霉素片的酸中溶出性质进行了研究,为国内罗红霉素片仿制药一致性评价及处方工艺筛选提供一定的参考。
1 仪器与试药
仪器:Agilent 708-850DS全自动溶出仪;天大天发ZKT18真空脱气仪;Mettler Toledo XP205型电子天平;Waters 1525-2489高效液相色谱仪;Waters Xbridge C18色谱柱(250mm×4.6mm, 5μm)。
试药:无水乙酸钠,三乙胺,磷酸二氢铵,氢氧化钠,磷酸二氢钾,盐酸均为分析纯;乙腈为色谱纯;溶出介质用水均为实验室自制蒸馏水经脱气后使用。
样品:法国赛诺菲公司罗红霉素片(批号:6GN5A、6GN4A、5EE7A参比制剂),国内21家生产企业的罗红霉素片。
2 方法与结果
2.1 色谱条件
C18柱检测波长为210nm,流动相为0.067mol/L磷酸二氢铵溶液(用三乙胺调节pH值至6.5)-乙腈(65:35),柱温为35℃,流速为1.0mL/min,进样量为20μL。
2.2 溶液的制备
对照品溶液的制备:精密称取罗红霉素对照品约16mg,置于100mL量瓶中,加溶出介质溶解并稀释至刻度,摇匀。
供试品溶液的制备:取每批样品6片,按照中国药典2015版四部通则0931试验,取溶出液用0.45μm滤膜滤过,用溶出介质稀释至0.16mg/mL的溶液。
2.3 溶出条件的选择
根据国家食品药品监督管理总局《普通口服固体制剂溶出曲线测定与比较指导原则》,参考各国药典标准和相关文献,本研究对罗红霉素片进行了溶出条件的筛选。
2.3.1 溶出方法的选择
首先,参照中国药典(ChP)2015[6]对3批罗红霉素原研药进行溶出度的测定,在实验过程中发现用篮法测定原研罗红霉素片,样品崩解后,辅料黏附于篮网表面,造成篮网堵塞,样品溶出不完全,造成测定结果不均一,因此篮法不适用于罗红霉素片溶出度测定。结果显示,有2批制剂批内6片各取样点溶出量结果差异较大,45min时,1批有2片低于限度值80%,6片溶出结果的RSD为24%;1批有1片低于80%,RSD为11%。测定结果见表1。
其次,采用桨法对3批罗红霉素原研药进行测定,每批6片溶出结果均较均一,30min时RSD分别为0.7%、0.4%和0.5%。测定结果见表1。
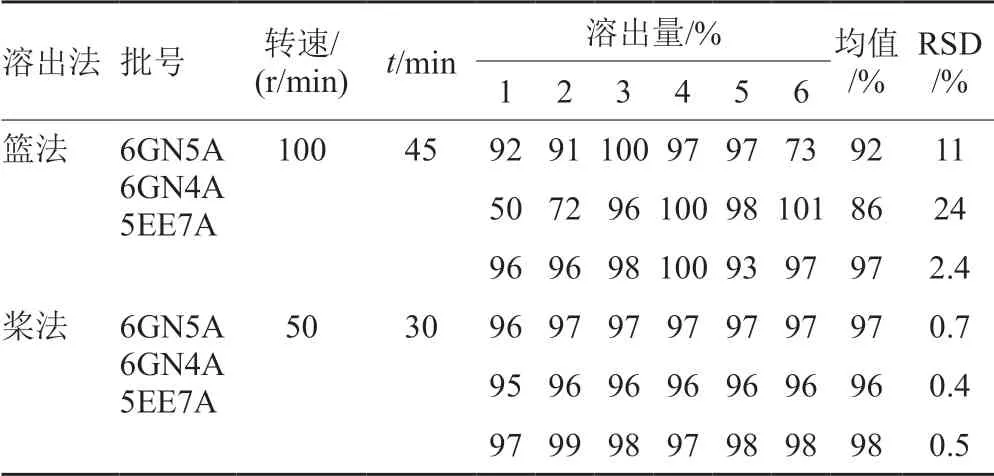
表1 3批原研药采用篮法和桨法溶出度结果Tab.1 The dissolution of roxithromycin tablets carried out with basket/paddle method
2.3.2 溶出介质的选择
采用pH1.2盐酸溶液,pH6.0磷酸盐缓冲液,pH6.8磷酸盐缓冲液和水4种溶出介质,桨法,对原研药进行多条溶出曲线的考察。分别于5、10、15、20、30、45、60和90min取样10mL,滤过,并及时补充溶出介质10mL,采用HPLC法测定,用外标法计算溶出量。另取罗红霉素对照品适量,精密称定,用上述溶出介质溶解并稀释制成含0.16mg/mL的溶液,作为对照品溶液。按照“2.1”项下的色谱条件,精密量取上述两种溶液各20μL,注入液相色谱仪,记录色谱图,按外标法以峰面积计算出每片的溶出量。
原研药在4种介质中的溶出曲线见图1。由测定结果可见,原研药在pH6.8介质中,30min溶出量达到85%以上;在pH6.0介质中,15min溶出量达到85%以上;而在pH1.2酸性介质和水中溶出极为缓慢,15min时,溶出量分别为15%和19%;直至90min时溶出量仅分别达到50%和57%,
2.3.3 转速的选择
采用桨法50和75r/min两种不同转速,分别在pH6.0和pH6.8的溶出介质中,按上述“2.3.2”项下方法测定溶出曲线(表2)。
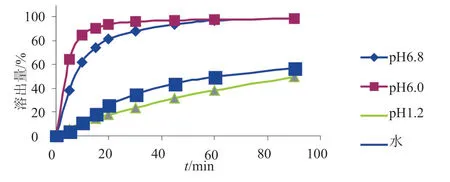
图1 原研药溶出曲线图Fig.1 The dissolution curve of original tablets
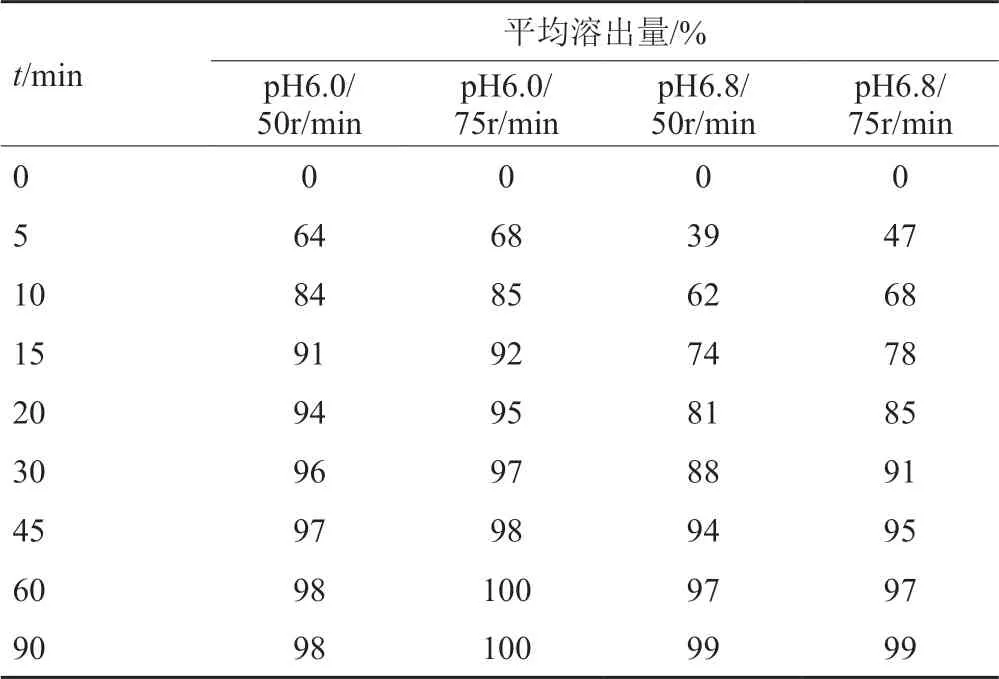
表2 原研药在pH6.0和pH6.8介质中50和75r/min溶出量结果Tab.2 The dissolution results of the original tablets in pH6.0/pH6.8 medias
2.4 溶出度方法的建立
在前期溶出曲线试验方法建立过程中发现ChP2015中溶出度检查方法存在一定的提升空间,拟建立新的溶出度检查方法,以期更合理有效的控制产品质量。
2.4.1 修订理由
ChP2015采用篮法测定罗红霉素片的溶出度,而一般国际上对片剂的溶出度控制方法多采用桨法,在实验过程中发现用篮法测定原研罗红霉素片,样品崩解后,辅料黏附,造成篮网堵塞,样品溶出不完全,造成测定结果不均一,影响判定;而用桨法测定,溶出度结果均一,重现性好。
罗红霉素为BCSⅡ类,属于低溶解、高渗透药物,且随pH升高,其溶解度降低。其在体内吸收部位主要应在小肠,在胃中应不释放或少量释放。溶出度条件选择不仅应该符合质控要求,还应模拟药物在体内吸收环境,一般情况下,人体在空腹状态下,十二指肠pH环境约为6.0,空肠6.2~6.4,回肠6.6~7.4。因此,选择pH6.0磷酸盐缓冲液作为溶出介质最接近罗红霉素体内吸收环境[7]。
结果表明,在pH6.0条件下,转速50和75r/min溶出量的结果相当,本研究选择与现行标准篮法100r/min相当的桨法50r/min。
2.4.2 拟修订方法
拟对罗红霉素片现行标准中溶出度检查方法进行修订。拟修订方法为:以pH6.0磷酸盐缓冲液 900mL为溶出介质,转速为50r/min,按照溶出度与释放度测定法按中国药典2015年版二部通则0931第二法[8]测定,经30min取适宜量,滤过,取续滤液测定。限度为标示量的80%。
2.4.3 方法验证试验
线性:取罗红霉素对照品适量,用pH6.0磷酸盐缓冲液溶解并定量稀释成系列浓度溶液,按中国药典2015年版二部,罗红霉素片含量测定项下高效液相色谱法测定。以峰面积对溶液浓度做回归方程,结果为A=3×106C-7901.8,相关系数r=1,对照品溶液在0.02055~1.0276mg/mL的范围内,线性关系良好。
精密度试验:取罗红霉素对照品适量,用pH6.0磷酸盐缓冲液溶解并定量稀释成一定浓度溶液,连续进样6次,精密度良好,RSD=0.8%。
稳定性试验:取罗红霉素对照品适量,用pH6.0磷酸盐缓冲液溶解并定量稀释成一定浓度溶液,分别在0、3、8、16、19和22h测定峰面积,RSD=0.2%。
回收率试验:取罗红霉素对照品适量,以pH6.0磷酸盐缓冲液作为稀释剂,按处方比例配制相当于标示量80%、100%和120%的供试品溶液及相应的空白辅料溶液,计算回收率。结果见表3。
专属性试验:按处方比例配制辅料空白,取适量,加pH6.0磷酸盐缓冲液稀释至一定浓度,过滤、取续滤液按罗红霉素片含量测定项下高效液相色谱法测定。与样品测定图谱比较,辅料对测定无干扰,见图2。
2.4.4 样品溶出度测定
21个生产企业49批次样品按修订的溶出度测定方法进行试验,结果有34批次样品符合规定,占69.4%;有15批次样品不符合规定,占30.6%。与现行标准比较,拟建立的方法更接近药物体内代谢吸收条件,方法条件更加合理,区分力更强,能够更好地控制产品质量。测定结果也提示出部分企业的处方及工艺合理性存在一定问题,应及时改进。
2.5 溶出曲线相似性评价
以pH6.0磷酸盐缓冲液900mL为溶出介质,转速为50r/min,按照溶出度测定法(中国药典2015年版四部通则0931第二法)测定,分别在第5、10、15、20、30、45和60min时间点各取样10mL,并及时补充溶出介质10mL,滤过,取续滤液测定。测定方法同ChP2015罗红霉素片溶出度项下,计算各点溶出量。按上述方法测定21个国内生产企业的样品,以及原研厂的药品,计算溶出量,绘制溶出曲线,采用f2相似因子评价仿制药与原研药体外溶出曲线相似性,以考察各制剂溶出行为差异。各企业溶出量和相似因子计算结果见表4,溶出曲线见图3。

表3 回收率结果表Tab.3 Results of recovery tests

图2 空白溶液(A)和溶出度样品(B)色谱图Fig.2 The chromatogram of the blank solution(A) and the dissolution test solution (B)
由检验结果可知,21家企业中有9个国内生产企业样品在15min内溶出量大于85%或f2因子大于50,与原研制剂相似;其他生产企业样品f2因子小于50,与原研不相似。

表4 罗红霉素片溶出曲线测定和相似度计算结果表Tab.4 The dissolution and similarity results of roxithromycin tablets
2.6 酸中溶出性质的研究
以pH1.2盐酸溶液为介质,按照上述方法,以胃排空时间15min为限度[9],按上述方法测定国内样品及原研药溶出量,比较相似性。原研药在酸性介质中的平均溶出量为13%,21家国产制剂在酸性介质中平均溶出量小于20%有13家,其余企业平均溶出量高于20%。

图3 原研药和21个厂家仿制药的溶出曲线图Fig.3 The dissolution curves of all tests
由于罗红霉素在酸性介质中极不稳定,迅速降解,原研药对罗红霉素的酸中释放量进行了控制,而国内部分企业处方工艺未对酸中释放量进行控制,药物作用发挥会受到影响,提示企业进行改进。
2.7 小结
通过实验结果可知,在pH6.0条件下测定的溶出曲线具有一定的区分力。原研药在10min迅速崩解分散,国内各生产企业样品,在该溶出介质中迅速崩解分散并不形成团块的样品,一般可以获得比较好的溶出结果,而在溶出介质中溶胀并聚集成团的制剂溶出结果较低,说明各企业处方工艺对溶出的影响较大。本研究还在pH6.8的条件下对部分企业的样品进行了溶出曲线的考察,考察结果与pH6.0条件下相同。21家生产企业中有9家企业产品的溶出行为与原研相似。而通过对罗红霉素片酸中溶出量的考察结果看出,上述溶出行为与原研相似的产品中也有部分产品并没有控制酸中溶出量,二者结合后与原研相似的产品仅余4家。而pH6.0及pH6.8条件下不相似的企业也有部分对酸中溶出量进行了控制。以上说明,各企业生产工艺方面存在较大差异,建议企业在进行药品质量一致性评价过程中,更加重视处方筛选和工艺控制,以进一步提高与原研的质量和疗效的一致性。

表5 原研药和21个厂家仿制药的酸中溶出量结果表Tab.5 The dissolution results of all the tests in acids
3 讨论
罗红霉素属于BCSⅡ类药物,且为pH依赖性强的药物,其溶解度随pH值的升高而降低。其在水中难溶,样品均溶出缓慢,在90min时,原研片的溶出度仅为57%;在酸中极不稳定,迅速降解,推测原研药应该在处方工艺上控制了酸中溶出量,因此,应考察国内产品是否也控制了酸中的释放量。通过文献检索认为,罗红霉素体内吸收主要部位应为小肠,为更好的模拟药物在小肠内崩解释放过程,选择pH6.0缓冲液作为溶出介质,实验结果表明,pH6.0的缓冲液作为溶出介质具有一定的区分力,但在pH6.0条件下罗红霉素的体内外相关性还需进一步研究。并且,本研究还对部分企业的样品在pH6.8缓冲液为溶出介质条件下进行了考察,结果与pH6.0条件下溶出曲线计算所得相似性考察结果一致。通过对罗红霉素片pH6.0和pH6.8及酸中溶出量的考察,结果表明21家企业中有4家企业溶出行为与原研相似,提示企业应进一步控制处方及工艺,使人民群众用药更趋于合理有效。

