雾化吸入氨基糖苷类药物治疗MDR/XDR菌肺部感染的有效性与安全性的Meta分析
李锐 刘福 丁锐 李胜前 彭媛 何梅 赵曜 杨明,*
(1 川北医学院附属医院药剂科,南充 637000;2 川北医学院药学院,南充 637000)
关健词:雾化吸入;氨基糖苷;多重/广泛耐药菌;肺部感染;Meta分析
近年来,革兰阴性菌特别是多重耐药菌(multiple resistant nacteria, MDR)和广泛耐药菌(extensively drug resistance, XDR)在呼吸机相关性肺炎(ventilatorassociated pneumonia, VAP)和医院获得性肺炎(hospital acquired pneumonia, HAP)中的检出率不断增多,给临床治疗带来了极大的困难[1-2]。关于静脉用氨基糖苷类药物治疗VAP或HAP的临床研究较多,但是静脉给药较强的耳肾毒性,且在肺泡内难以达到有效的浓度,临床使用非常受限。而有关研究显示,雾化吸入氨基糖苷类药物可直达肺部,增大肺部药物浓度,提高其临床治愈率,并且可以降低对肾脏的损伤[3-4]。氨基糖苷类药物雾化吸入法被认为在治疗重度革兰阴性菌感染时,具有更强的抗菌活性以及无肾损的优势[5]。因此,雾化吸入是近年来提出的一种治疗难治性院内获得性肺部感染的方法之一。但该用法属于超说明书用药,且吸入治疗的有效性和安全性以及最佳用量均尚无定论[6]。另外,国外相关指南指出,雾化吸入疗法用作MDR/XDR革兰阴性菌感染全身用药无效患者的辅助治疗似乎更有益,但雾化吸入可能会导致的细菌耐药率的增加[7-8]。基于以上争议,本文进行了雾化吸入氨基糖苷类药物治疗MDR/XDR菌肺部感染的有效性与安全性的系统评价,意在为临床用药提供参考。
1 资料与方法
1.1 文献检索
计算机检索PubMed、Embase、中国知网数据库、万方数据库以及维普数据库。检索关于雾化吸入氨基糖苷类药物治疗肺部感染相关的文献研究,检索年限为从每个数据库建库开始到2018年4月。中文检索词为“雾化”、“吸入”、“阿米卡星”、“妥布霉素”、“庆大霉素”和“肺炎”;英文检索词为“inhalation”、“inhaled”、“aerolized”、“nebulised”、“amikacin”、“tobramycin”、“gentamycin”以及“pneumonia”。然后采用布尔逻辑进行检索。
1.2 文献筛选
1.2.1 纳入标准
临床随机对照试验(randomized controlled trials, RCT)研究或临床对照研究;雾化吸入氨基糖苷类药物治疗肺炎的研究;致病菌为MDR/XDR菌感染;患者为VAP或HAP院内感染;结局指标:临床治愈率、死亡率、细菌清除率以及不良反应(adverse effects, AEs)。
1.2.2 排除标准
非RCT研究或非临床对照性研究;未使用氨基糖苷类药物及未使用雾化治疗的研究;致病菌为非MDR/XDR;社区获得性院外感染及非肺部感染;动物试验;数据不完整的研究;重复性研究。
1.2.3 筛选方法
由两位文献评审人根据纳入标准和排除标准独立地进行数据提取,然后统一评估所有的相关文献是否有所需的数据并进行交叉核对。若评审双方存在分歧,则由第三评审员介入分析,最后通过讨论来解决分歧。
1.3 数据提取
由两位评审员根据纳入标准、排除标准独立进行数据提取,互不干扰,提取的数据应包括:第一作者;文章发表年限;患者的平均年龄;男性比例;随访时间;给药方案;临床治愈率;死亡率;细菌清除率;AEs;是否随机;是否有分配隐藏;是否应用盲法;是否有失访与退出;数据是否完整;是否有选择性报道。
1.4 质量评估
纳入文献的质量高低采用改良的Jadad评分来评价[9],评分在0~7分波动。运用Rev Man 5.1的“偏倚风险表”来评估文献的偏倚风险[10],根据Begg's漏斗图的对称性评价发表偏倚存在与否,但是为了排除观察Begg's漏斗图的对称性可能具有较强的主观性,本文还采用Egger's测试的统计学数据来证明偏倚是否存在:P<0.05存在偏倚;P>0.05,不存在偏倚[11-12]。偏倚风险采用STATA 12.0统计分析,其他数据统计采用Rev Man 5.1分析。
1.5 数据统计分析
本文计数资料和计量资料分别采用集中优势比(odds ratio, OR)为效应指标,95%置信区间(confidence intervals, CI)也应用于Meta分析。同时,统计I2值来判断各研究间的异质性。若I2<50%,P>0.05则采用固定效应模型(fixed-effects model, FEM)进行分析;若I2=50%,P<0.05则采用随机效应模型(randomed-effects model, REM)进行分析。若需要分析异质性来源,则进行敏感性分析和亚组分析。
2 结果
2.1 文献检索结果及质量评估
通过对各数据库的检索,初筛到中英文文献共586篇,通过进一步阅读文题、摘要和全文,最终纳入13篇文献[13-25],14项研究(其中1篇文献包含2项研究[21])。纳入各研究的患者依存性以及治疗组与对照组基线一致。本文应用改良的Jadad评分,对纳入的文献进行质量评价。结果显示,有1篇低质量文献[18],8篇中等质量文献[13-17,23-25],4篇高质量文献[19-22]。纳入Meta分析的所有文献研究的主要特点及质量评估(表1)。
2.2 偏移风险评估
用Rev Man 5.1中的“偏倚风险表”评价纳入的每篇文献,结果显示,有1篇文献存在高偏倚风险[18],4篇文献存在低偏倚风险[19-22],剩余的8篇文献可能存在未知偏倚风险[13-17,23-25];各个文献研究的单项偏倚风险评估表(图1)。
2.3 有效性分析
2.3.1 临床治愈率
10篇文献[13-17,19-21,24,25],共11个研究涉及临床治愈率。实验组共纳入411名患者,对照组共纳入370名患者,按照对照组给药方法的不同分2个亚组进行临床治愈率的统计分析。Meta分析结果表明,各研究间存在较大的异质性(I2=52%, P=0.02),故采用REM进行统计分析,实验组的临床治愈率比对照组显著增高(OR=2.24, 95%CI(1.35, 3.71), P=0.002)(图2)。
2.3.2 死亡率
11篇文献[13,15,16,18-25],共12个研究涉及死亡率。实验组共纳入479名患者,对照组共纳入427名患者,按照对照组给药方法的不同分2个亚组进行死亡率的统计分析。Meta分析结果表明,各研究间存在中等大小的异质性(I2=43%, P=0.06),故采用FEM进行统计分析,实验组和对照组的死亡率无显著性差异[OR=0.90, 95%CI(0.65, 1.24), P=0.51](图3)。
2.3.3 细菌清除率
9篇文章[15-17,19-22,24,25],共10个研究涉及细菌清除率,实验组共纳入323名患者,对照组共纳入315名患者,按照对照组给药方法的不同将其分2个亚组进行细菌清除率的统计分析。Meta分析结果表明,各研究间存在中等大小的异质性(I2=36%, P=0.12),故采用FEM进行统计分析,实验组的细菌清除率显著高于对照组[OR=3.59, 95%CI(2.53, 5.08), P<0.00001](图4)。

表1 纳入Meta分析各文献研究的主要特点及质量评估Tab.1 Main characteristics and quality appraisal of each studies in the Meta-analysis

图1 各个文献研究的单项偏倚风险评估Fig.1 Each risk of bias item for each study
2.4 安全性分析
9篇文献[13-15, 17,19-21,24,25]报道了AEs,包括感染性休克,呼吸系统疾病,心血管系统疾病,胃肠道疾病,急性肾衰竭,肾损伤以及其他不良反应。按照发生AEs的不同类型分为7个亚组进行安全性分析。Meta分析结果表明,各文献研究间存在比较小的异质性(I2=25%, P=0.12),故采用FEM进行统计分析,实验组的AEs发生率显著低于对照组[OR=0.62, 95% CI(0.47, 0.82), P=0.0009](图5)。
2.5 发表偏移分析
本文分别对各个指标进行发表偏移分析,通过STATA 12.0绘制Begg's漏斗图,图中每个圆圈代表各个独立研究。观察各漏斗图的对称性,除个别研究可能因异质性较大而分布在漏斗图以外,其它各圆圈基本对称的分布于漏斗图的左右及上下(图6A~C)。
应用STATA 12.0软件,对以上两个Begg's漏斗图再进行Egger's测试。结果显示,临床治愈率的Egger's测试P=0.556,>0.05,死亡率的Egger's测试P=0.679,>0.05,细菌清除率的Egger's测试P=0.118,>0.05,再次从数据上证明本文无发表偏倚。
2.6 敏感性分析
为了探讨异质性来源,本文对各个指标分别进行敏感性分析。
2.6.1 亚组分析
Meta分析结果显示,临床治愈率,死亡率和细菌清除率的I2值分别为52%、43%和36%,异质性均较大,遂对可能导致异质性的因素如种族差异(欧美和亚洲),年龄(>60岁和≤60岁)及随访时间(>4周、4周和<4周)分别分亚组进行敏感性分析。亚组分析结果显示,种族、年龄和随访时间对分析结果影响均较小(表2)。
2.6.2 文献逐一剔除分析
每个结局指标分别逐一去除纳入文献来分析异质性来源。结果发现,临床治愈率分析中,剔除Kollef等[20]后对结果影响较大(I2=31%, P<0.0001);死亡率分析中,剔除Yohei等[23]后对结果影响较大(I2=19%, P=0.93);细菌清除率分析中,剔除Lucy 等[22]后对结果影响较大(I2=6%, P<0.0001)。上述各文献的纳入可能是导致异质性来源的重要原因。
3 讨论
本文通过Meta分析比较了雾化吸入氨基糖苷类药物与静脉注射或者空白雾化治疗MDR/XDR细菌所致肺部感染的有效性与安全性。
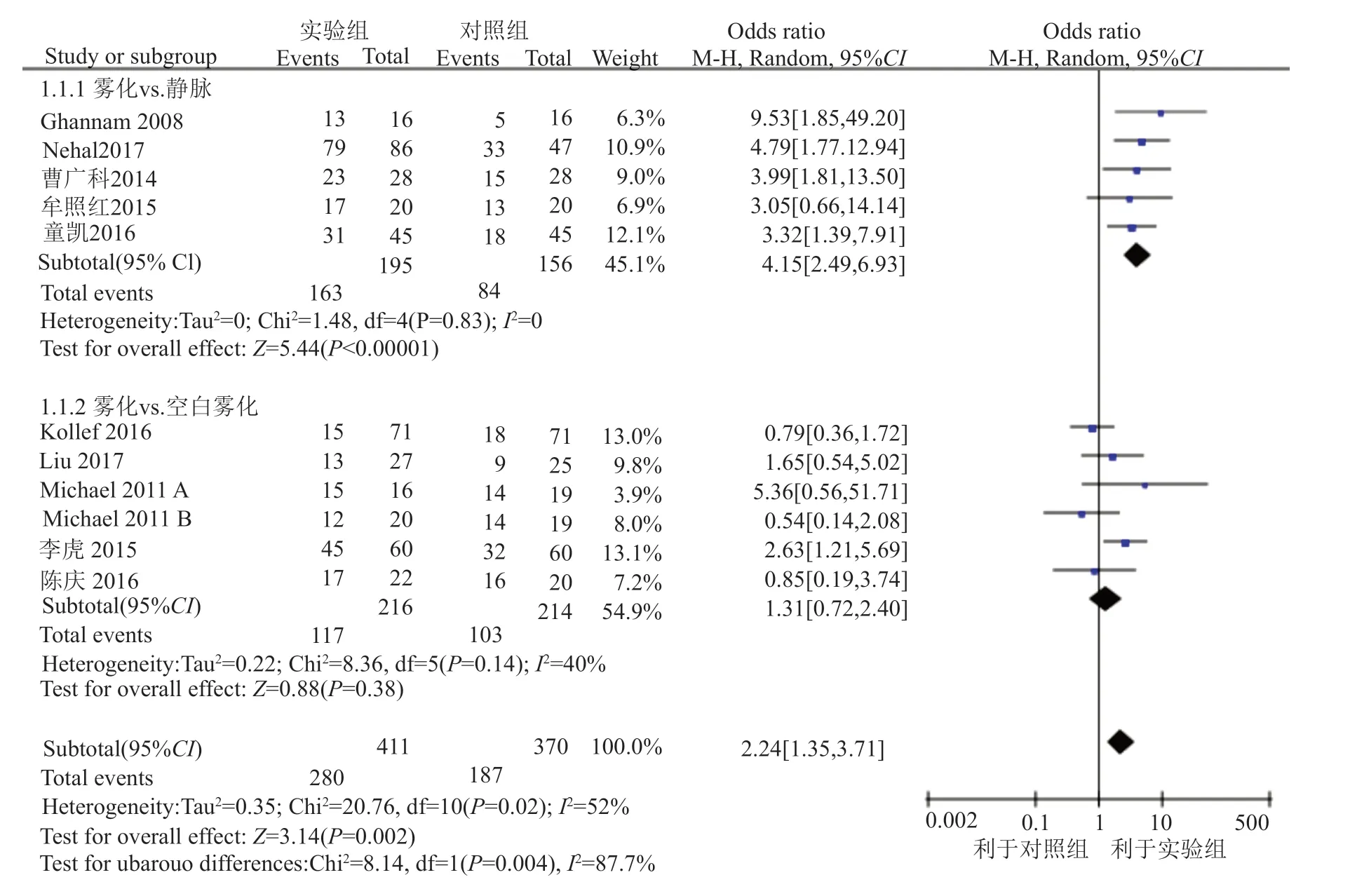
图2 实验组和对照组临床治愈率比较的森林图Fig.2 Forest plot for the comparison of the rate of clinical cure between treatment group and control group

图3 实验组和对照组死亡率比较的森林图Fig.3 Forest plot for the comparison of the rate of mortality between treatment group and control group
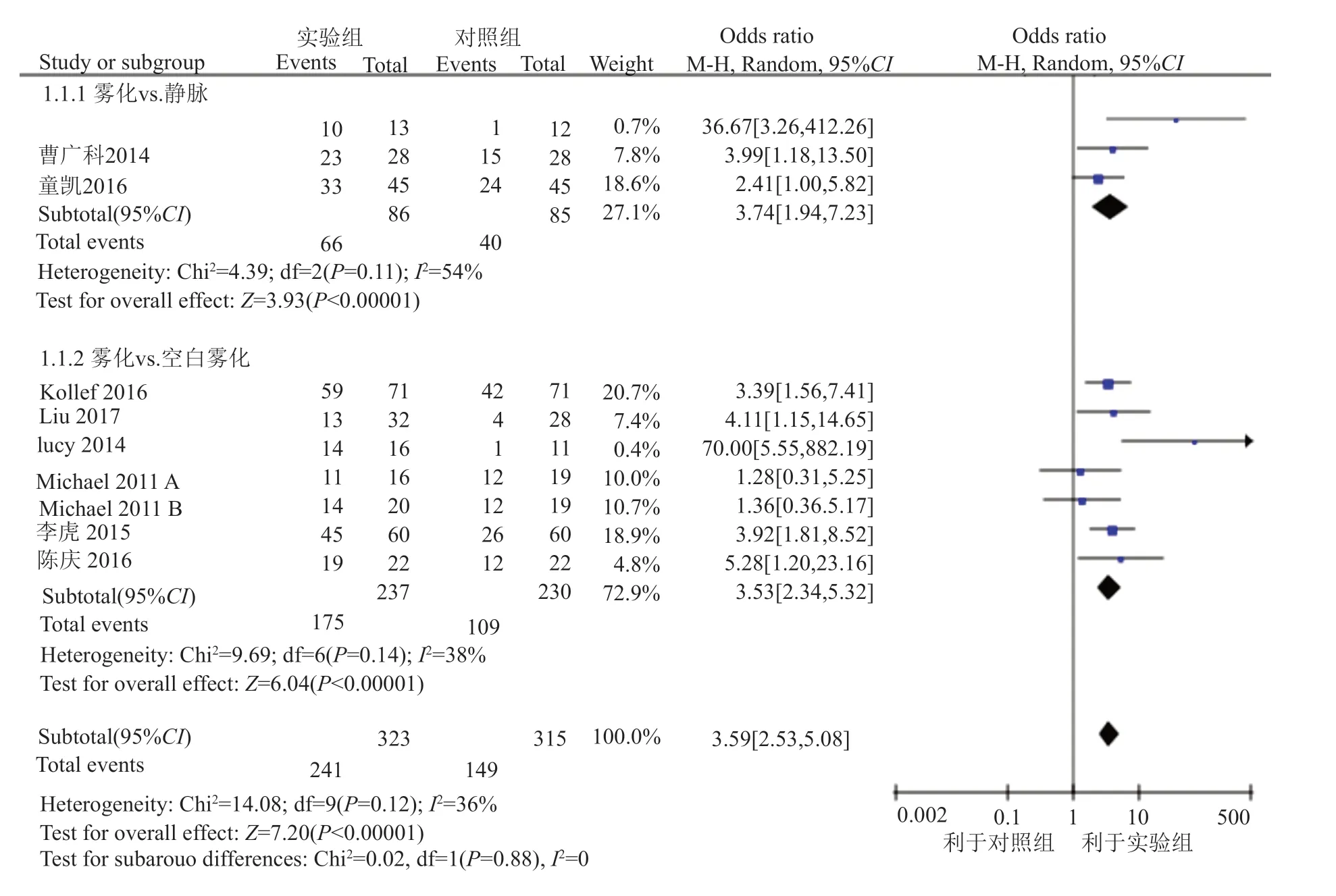
图4 实验组和对照组细菌清除率比较的森林图Fig.4 Forest plot for the comparison of the rate of bacteria clearance between treatment group and control group
对于有效性来说,Meta分析结果显示,治疗组与对照组相比,其临床治愈率及细菌清除率均存在显著性差异,虽然对照组的死亡率比治疗组高,但两组死亡率无显著性差异。基于氨基糖苷类抗菌药物静脉给药其组织穿透力低,难以在肺泡内达到有效的药物浓度。研究表明,通过雾化吸入抗菌药物能使气道痰液中的药物浓度达到体外最低抑菌浓度的20~100倍[26],远高于美国临床和实验室标准协会中规定的常见革兰阴性菌对氨基糖苷类的耐药折点,因此雾化吸入组的临床治愈率更高以及有更强的细菌清除效果。但是,由于耐药菌本身属于难治菌,对于长期卧床且免疫力低下患者,其本身预后较差,抗感染治疗并不能很好的改善其临床结局,故反映患者预后的死亡率,雾化吸入治疗对于该类患者可能并无显著优势。
对于安全性来说,雾化吸入氨基糖苷类药物治疗的AEs发生率显著低于未雾化组。从纳入的AEs发生率数据来看,雾化吸入可能增加患者支气管痉挛的发生率,但却降低了患者的肾毒性且其严重不良反应较对照组更少,患者较易耐受。另外,雾化吸入可在局部形成高浓度药物累积效应,相较于全身用药所需剂量较小,与全身用药相比更安全,而且费用更低,其安全性及经济学效应更优[18],但雾化吸入时临床医生仍应密切监测患者发生AEs。
敏感性分析结果表明,种族差异、年龄和随访时间可能并不是异质性来源。通过对各个结局指标所有纳入文献进行逐一剔除后,发现异质性来源可能受文献Kollef等[20]、Lucy等[22]及Yohei等[23]的临床试验方法学影响。Kollef等[20]提到其临床治疗失败的原因可能是参与研究的患者来自欧美多个国家,多重耐药病原体的流行趋势分布不均,所以试验结果可能存在一定的处方偏移;Yohei等[23]的研究年限跨度较大,治疗组与对照组的纳入人群并不是同一平行时间段,医疗条件和技术的不断进步可能是该研究治疗组死亡率明显降低的重要原因之一,所以试验结果可能存在一定的选择偏移。Lucy等[22]的研究中包含了万古霉素对耐药阳性细菌的细菌清除率,所以试验结果可能存在一定的检测偏移。
本文仍有部分局限性。首先,有效性分析时按对照组给药方法的不同进行亚组分析的样本数较小,所以小样本分析可能会导致假阳性或者假阴性结果。其次,由于各个纳入文献的治疗方案中药物的给药剂量不尽相同,本文无法根据给药剂量的大小来进行亚组分析,因此药物剂量大小可能会导致一定的处方偏倚。
本Meta分析结果具有重要的临床指导意义,但是受研究方法学的限制,该结论有待设计完善的进一步、大样本的临床试验来验证,以期为MDR/XDR肺部感染患者提供更有效的治疗措施。

图5 实验组和对照组AEs发生率比较的森林图Fig.5 Forest plot for the comparison of the rate of AEs between treatment group and control group
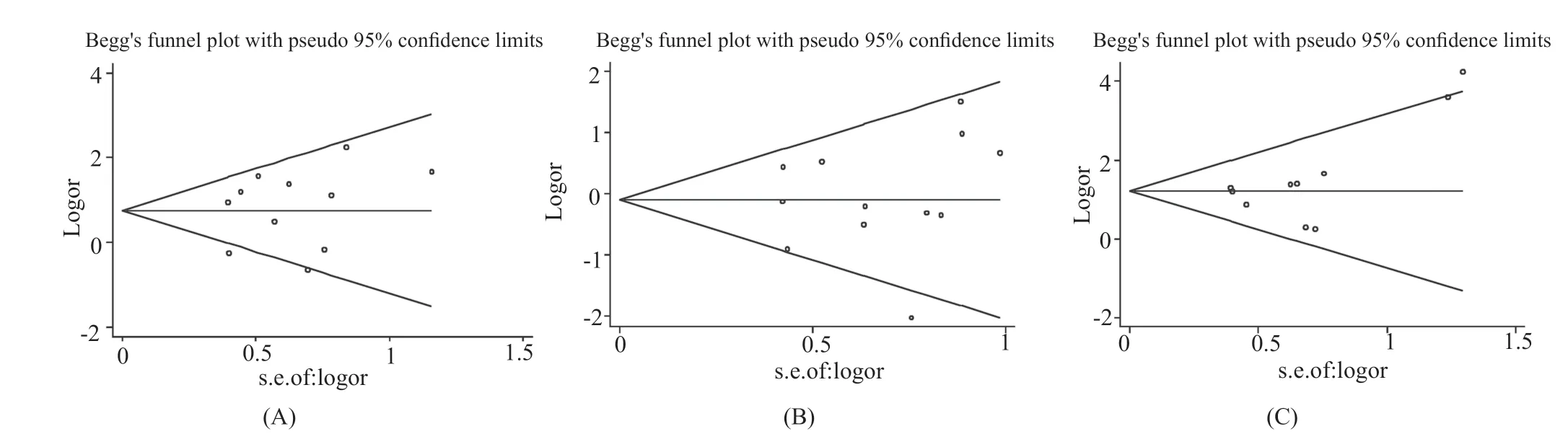
图6 临床治愈率(A)、死亡率(B)和细菌清除率(C)的Begg's漏斗图Fig.6 Begg's funnel plot of the rate of clinical cure (A), the rate of mortality (B) and the rate of bacteria clearance(C)
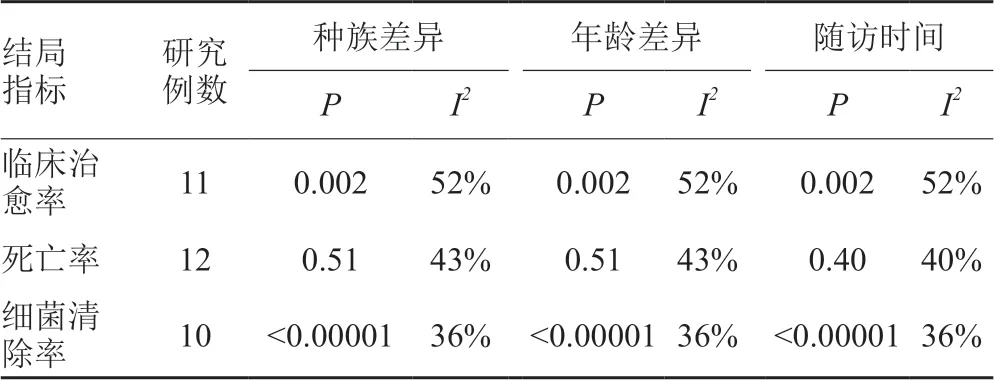
表2 每个结局指标各影响因素的亚组分析Tab.2 Subgroupanalysisbasedoninfluence factors of each outcome indicator

