中药活性成分防治脓毒症的研究进展
薛漓轩,周钱留,张媛媛,寇俊萍*
(1.中国药科大学中药学院中药药理与中医药系,江苏 南京 211198;2.江苏省中药评价与转换重点实验室,江苏 南京 211198)
脓毒症(sepsis)是感染引起的宿主反应失调所导致的致命性器官功能障碍[1]。脓毒症是临床危重症的常见并发症之一,其发病机制复杂,多种致病微生物均可引发脓毒症。感染早期,侵入机体的病原微生物及其毒素,从局部进入机体循环,激活宿主免疫系统,激活内皮细胞,炎性因子大量释放,引起细胞因子风暴,同时过度的活性氧和活性氮产生,引起氧化应激,组织因子表达、形成微血栓,不可控的炎症反应进一步引起免疫麻痹、细胞损伤、细胞器功能障碍,导致内皮完整性被破坏,通透性升高,凝血功能紊乱,微循环障碍,引起多器官功能障碍、多器官衰竭,最终引起宿主死亡[2-6]。现代流行病学研究认为,脓毒症严重威胁人类健康,给全球医疗卫生事业带来巨大负担。来自高收入国家的数据显示,全球每年约有3 150万例脓毒症和1 940万例严重脓毒症患病病例,造成约530万人死亡。由于低收入和中等收入国家关于脓毒症发病率的相关研究数据较少,因此,该病实际发病率和死亡率可能比预计要多[3]。
目前治疗脓毒症手段主要是采取液体复苏、抗感染治疗、血管活性药物、糖皮质激素、抗凝治疗、营养支持等多种方式综合治疗[7-8]。其中,抗生素的大量使用,虽然降低了脓毒症患者的死亡率,但细菌耐药概率的增加也为后续治疗带来了压力[2]。糖皮质激素用于脓毒症治疗已有40多年历史,然而其是否能显著降低严重脓毒症患者死亡率至今仍存在争议[9-11]。虽然脓毒症治疗手段众多,但是目前临床上依旧没有疗效确切可靠的药物。近年来,中药对脓毒症防治的研究报道日益增多,本文对近3年来在英文期刊上发表的中药防治脓毒症的机制进展予以综述,以期为研发防治脓毒症的新药提供实验依据和线索。
1 抑制过度炎症反应
研究表明,款冬酮(10 mg·kg-1)可以通过抑制核因子-B(NF-B)和丝裂原激活的蛋白(mitogen-activated protein,MAP)3种主要激酶的激活,来下调盲肠结扎再穿孔(cecal ligation puncture,CLP)模型的脓毒症小鼠肺泡巨噬细胞中环加氧酶(COX)-2和肿瘤坏死因子α(TNF-α)的表达,抑制血清一氧化氮(NO)、前列腺素E2(PGE2)和高迁移率族蛋白B1(HMGB1)的释放,降低脓毒症小鼠的死亡率[12]。红景天苷(20、40 mg·kg-1)可以通过上调沉默信息调节因子1(SIRT1)表达,抑制NF-B活化和HMGB1核转位,改善脓毒症肺损伤[13]。姜酮(0.72 mg·kg-1)和人参皂苷Rh1(126、252 μg/只)通过抑制脓毒症小鼠HMGB1释放,抑制血管通透性增加和白细胞迁移[14-15]。苍术酮(25 mg·kg-1)通过上调SIRT1表达,抑制NF-B活化,抑制小胶质细胞激活和神经炎症,减轻脂多糖(LPS)诱导的小鼠脓毒症相关性脑病(SAE)和认知功能障碍[16]。静脉注射柁树酮A(0.147、0.294 mg·kg-1)能够上调SIRT1表达,减轻LPS诱导的脓毒症肝损伤,抑制血清炎症因子释放,抑制髓过氧化物酶(MPO)活性[17]。
静脉注射橙皮苷(10、20 mg·kg-1)通过抑制Hsp70/TLR4/MyD88通路,预防脓毒症小鼠肺损伤[18]。在LPS刺激的RAW264.7细胞中,给以大黄酚(15 μmol·L-1),能通过调节PPAR-γ/NF-B途径抑制TNF-α、诱导型一氧化氮合酶(iNOS)、白细胞介素-1β(IL-1β)和NF-Bp65表达的增高[19]。姜黄素(20 mg·kg-1)可以调节PI3K/AKT信号通路,抑制miR-155,降低脓毒症小鼠谷丙转氨酶(ASL)、尿素氮(BUN)水平和脾中巨噬细胞比例[20]。
Nod样受体蛋白3(NLRP3)的异常激活与多种炎性疾病或代谢紊乱有关,在脓毒症感染期间,起重要作用。灯盏花乙素(100、200 mg·kg-1)可抑制巨噬细胞NLRP3过度激活,降低腹腔注射大肠杆菌诱导小鼠脓毒症模型死亡率,抑制血清IL-1β水平,减轻肝脏炎性细胞浸润[21]。肉桂醛(0.132、0.264 g·kg-1)能够抑制组织蛋白酶B(CTSB)和嘌呤能离子通道型受体7(purinergic ligand-gated ion channel 7 receptor,P2X7R)在肺中表达,抑制NLRP3和IL-1β,减轻LPS诱导的脓毒症小鼠炎症反应[22]。
2 抑制氧化应激
研究发现,幼大鼠模拟的儿童脓毒症模型中,白藜芦醇(30 mg·kg-1)能够通过激活核因子E-2相关因子(Nrf-2)信号,上调HO-1和醌NADP脱氢酶1(NQO1)表达,抑制脓毒症幼大鼠肾中TNF-α、IL-1β和肾损伤分子1(KIM-1)表达,减轻脓毒症幼大鼠急性肾损伤[23]。此外,腹腔注射白藜芦醇可以通过抑制PI3K/Nrf2/HO-1信号通路,降低脓毒症大鼠肺组织中丙二醛(MDA)和8-羟基脱氧鸟苷(8-hydroxy-2deoxyguanosine,8-OHDG)表达水平,增加超氧化物歧化酶(SOD)活性,上调HO-1和Nrf-2蛋白表达和Akt磷酸化,改善脓毒症[24]。
姜黄素(20、40、80 mg·kg-1)下调血清IL-1β、TNF-α、谷丙转氨酶(ALT)、谷草转氨酶(AST)和碱性磷酸酶(ALP)水平,上调SOD、过氧化氢酶(CAT)、谷胱甘肽(GSH)和谷胱甘肽过氧化物酶(GSH-Px)水平,是通过抑制PI3K/Akt、P38/JNK和CYP2E/Nrf-2/ROS信号通路发挥改善内毒素血症中的氧化反应和肝损伤作用[25]。体外实验中,姜黄素衍生物FM0807能通过抑制ROS/JNK/p53信号通路,抑制LPS诱导的RAW264.7细胞中炎症因子和iNOS表达增加[26]。
和厚朴酚(20 mmol·L-1)可以通过抑制TLR2/4/MyD88信号通路,抑制脓毒症大鼠血清培育的NRK-52E细胞中iNOS、NO水平和MPO活性,上调GSH和SOD的表达水平,体内实验中,通过分子建模和模拟对接,推测和厚朴酚可能通过与Nrf2-Keep1结合,置换Nrf2,激活Nrf2/HO-1信号通路,抑制脓毒症大鼠肾中TNF-α、IL-1β和IL-6表达[27]。瑞香素(5 mg·kg-1)能通过抑制JAK/STATs通路,抑制STAT1和STAT3入核,抑制NO、PGE2表达,增加脓毒症小鼠存活率,减轻肺损伤[28]。灌胃给以山柰酚(100 mg·kg-1)可以抑制炎症相关因子表达,增加SOD、CAT和GSH活性,下调脓毒症小鼠肺组织中iNOS和细胞间黏附分子-1(iCAM-1)水平,发挥抑制氧化应激作用[29]。
3 调节免疫反应
研究显示,在小鼠腹部烧伤10%,并在烧伤后第一天和第三天,腹腔注射铜绿假单胞菌,制备的复杂脓毒症模型中,柴胡多糖(40、100、250 mg·kg-1)剂量依赖地降低小鼠死亡率,并通过调节骨髓有核细胞(BMC)的增殖、运动、迁移和局部分化,增强体内CD11c-CD45RBhighDCs的局部募集和分化,恢复晚期脓毒症的免疫平衡,和调节TLR4信号通路实现对晚期脓毒症的免疫逆转,来发挥改善脓毒症作用[30]。丹参酮ⅡA(15 mg·kg-1)能够恢复CD4+和CD8+T细胞百分比,抑制脾中调节性T细胞(Treg)的形成,抑制脾中干扰素-γ(IFN-γ)、IL-2水平,上调IL-4和IL-10表达水平,促进Th1/Th2动态平衡,增加巨噬细胞吞噬活性,增强脓毒症小鼠细菌清除率,抑制血清HMGB1水平升高,抑制CD3+CD4+/CD3+CD8+淋巴细胞百分比降低和Tregs增加,发挥免疫调节作用[31]。静脉输注牛去氧胆酸盐(0.5 mg·kg-1,20 min),可以通过调节蛋白质组表达,增加粒细胞源性抑制细胞(MDSCLT)的数量,抑制T细胞的增殖和迁移,降低血清促炎因子,恢复低血压,减轻肝、肾损伤,延长脓毒症小鼠的存活率,此外,牛去氧胆酸盐处理后的MDSCLT在过继转移治疗中比未处理的能更好地改善脓毒症[32]。姜黄素可以通过增强Treg细胞抑制功能,增加血浆IL-10、降低TNF-α和IL-6水平,改善CLP小鼠存活率[33]。
4 调节细胞死亡
研究发现,连续10 d经口给予柚皮苷100 mg·(kg·d)-1能够通过抑制BAX/Bcl2比值,抑制心肌凋亡,同时降低心肌组织TNF-α、IL-1β和IL-6表达,上调SOD表达,下调MDA水平,发挥抗炎抗氧化作用[34]。腹腔注射紫檀芪(5、10、15 mg·kg-1)可以通过抑制BAX表达,增加Bcl2表达,抑制肝细胞凋亡,还能通过上调SIRT1表达,抑制肝中炎症反应[35]。白藜芦醇(40 mg·kg-1)可以通过上调血管内皮生长因子-B(VEGF-B)表达水平,抑制LPS诱导的肺泡巨噬细胞凋亡[36]。人参皂苷Rg1(200 mg·kg-1)通过抑制脓毒症小鼠海马区中微管相关蛋白1轻链3Ⅱ(LC3Ⅱ)和p62表达,抑制caspase-3活化,来抑制神经细胞凋亡,降低脓毒症小鼠死亡率,改善SAE引起的认知障碍[37]。另一项研究也显示,人参皂苷Rg1(30 mg·kg-1)可以通过激活自噬,上调Nrf2表达,抑制p65磷酸化,抑制小鼠肺上皮细胞(MLE-12)凋亡,减轻脓毒症引起的肺损伤[38]。
另有研究发现,人参皂苷Rg3(25 μmol·L-1)可以通过调节线粒体自噬,减轻线粒体功能障碍,激活AMPK通路,减轻脓毒症引起的细胞、器官功能障碍[39]。青蒿琥酯可以通过抑制TRAF6-Beclin1-PI3KC3复合物形成,抑制自噬激活,抑制LPS诱导的巨噬细胞释放细胞因子,改善脓毒症[40]。
5 调节内皮屏障功能
研究发现,梓醇(10 mg·kg-1)可以抑制SRC、PI3K、FAK磷酸化,抑制CTSB激活,促进claudin-5和连接黏附分子-1(junction adhesion molecule,JAM-1)重分布,抑制IV型胶原蛋白和层黏连蛋白(LN)降解,减轻LPS诱导的血管通透性增加,降低脓毒症小鼠死亡率,表面等离子共振技术(SPR)检测结果证明,梓醇是通过直接与TLR4、SRC结合,发挥改善LPS引起的内皮屏障功能障碍的作用[41]。天竺葵素(30 μmol·L-1)可以抑制LPS和CLP诱导的转换生长因子诱导蛋白(TGFBIp)释放,抑制TGFBIp诱导的屏障破坏、白细胞迁移[42]。小檗碱(25、50 mg·kg-1)通过调节Wnt/β-catenin信号通路,抑制脓毒症大鼠血管通透性升高,在LPS刺激的大鼠肠微血管内皮细胞模型中,恢复血管内皮屏障功能,增加跨内皮电阻值(TEER)、上调claudin-12,β-连环蛋白和血管内皮钙黏蛋白(VE-cadherin)含量,维持紧密连接和黏附连接稳定性,发挥维持肠血管屏障功能作用[43]。鹅掌楸(20 mg·kg-1)通过抑制肺中VEGF表达和NF-B活化,抑制血管通透性增加和过度炎症反应[44]。双氢青蒿素(25 μmol·L-1)通过恢复TNF-α抑制的人肾小球内皮细胞(HRGECs)中紧密连接蛋白(occludin)表达,降低肾小球内皮通透性,双氢青蒿素(50 mg·kg-1)可以减轻LPS诱导的脓毒症小鼠肾小球损伤,降低尿液中白蛋白与肌酐比值(UACR),降低血清肌酐[45]。补骨脂(15、30、60 mg·kg-1)能抑制脓毒症小鼠体内炎症因子水平升高,降低肺水肿,恢复claudin-1和VE-cadherin表达,维持肺内皮屏障功能,同时还能增加SOD活性,抑制MDA、8-OHDG和3-硝基酪氨酸(3-NT)表达水平增加[46]。
6 讨论
脓毒症的发病机制是一个复杂的、多通路、多环节参与的过程,早期研究集中在抑制脓毒症期间的全身炎症反应综合征上,近期研究发现,多器官功能障碍和多器官衰竭是引起脓毒症患者死亡的重要原因,且全身炎症反应综合征与器官损伤并无确定的时间先后关系,因此,单纯的抑制过度炎症反应,可能不能降低脓毒症患者的死亡率,炎症因子抑制剂在临床应用的失败也验证了这一点,所以如何在抑制过度炎症反应、氧化应激的同时,改善器官损伤,恢复机体免疫系统功能是未来研究治疗脓毒症药物的重要方向。目前脓毒症研究的动物模型主要集中在盲肠结扎穿孔术模拟的阑尾炎或憩室炎穿孔,或腹腔、静脉注射LPS引起的内毒素血症上,其他模型还有烧伤、细菌攻击模型等。然而,由于引起脓毒症感染的微生物种类繁多,脓毒症发病机制复杂多样,不同地区、不同感染源的患者对脓毒症感染呈现不同表型,且由于基因的多样性,患者在面对不同治疗药物,其疗效也有差异。因此,如何选择或制备更合适的动物模型,降低其与临床疾病的差异性,是脓毒症新药研发的关键之一。
本文综述研究显示,中药活性成分可通过调节多条脓毒症相关通路,参与防治脓毒症及脓毒症诱导的器官功能障碍中的过度炎症反应、氧化应激、免疫紊乱、细胞死亡和内皮通透性增加,其相关作用途径总结归纳如表1所示。防治脓毒症的中药活性成分涉及黄酮类、萜类、木脂素类、皂苷类、醌类、生物碱类、多糖类、苷类、苯丙素类、醛类、香豆素类、挥发油类、甾体类等,主要通过调节TLR4/MyD88/NF-B、MAPK等相关通路,抑制HMGB1等蛋白表达,上调Nrf2、SIRT1等蛋白表达来减轻多器官功能障碍,降低脓毒症死亡率,发挥防治脓毒症作用。其中,黄酮类、萜类、木脂素类主要调节TLR4/NF-B信号通路,上调SIRT1表达,抑制过度炎症反应和氧化应激,黄酮类、萜类还能调节MAPK通路,进一步抑制脓毒症引起的抗炎促炎反应失衡和过度氧化应激。皂苷类、苷类和挥发油类可以抑制HMGB1表达水平增高,抑制炎症反应,降低血管通透性。黄酮类、皂苷类成分能够通过上调Nrf2信号通路,发挥抗氧化作用。醌类、苷类、生物碱类主要通过抑制NF-B信号通路,抑制机体炎症反应。醌类和苯丙素类可以激活PPAR-γ受体,抑制炎症因子产生。醌类、黄酮类和多糖类成分,可以调节机体免疫反应,减轻脓毒症引起的免疫麻痹。甾体类成分可以调节免疫,抑制全身炎症,改善脓毒症。醛类可以通过调节NLRP3抑制炎症反应。香豆素类可以通过抑制JAK/STAT信号通路,下调ROS产生,发挥抗炎抗氧化作用。上述研究主要集中在黄酮类、萜类和木脂素类成分上,三者均具有抗炎抗氧化作用,其中黄酮类和萜类还可以抑制血管通透性增高,维持内皮屏障功能,改善脓毒症引起的水肿,减缓器官功能障碍,值得进一步探索开发。
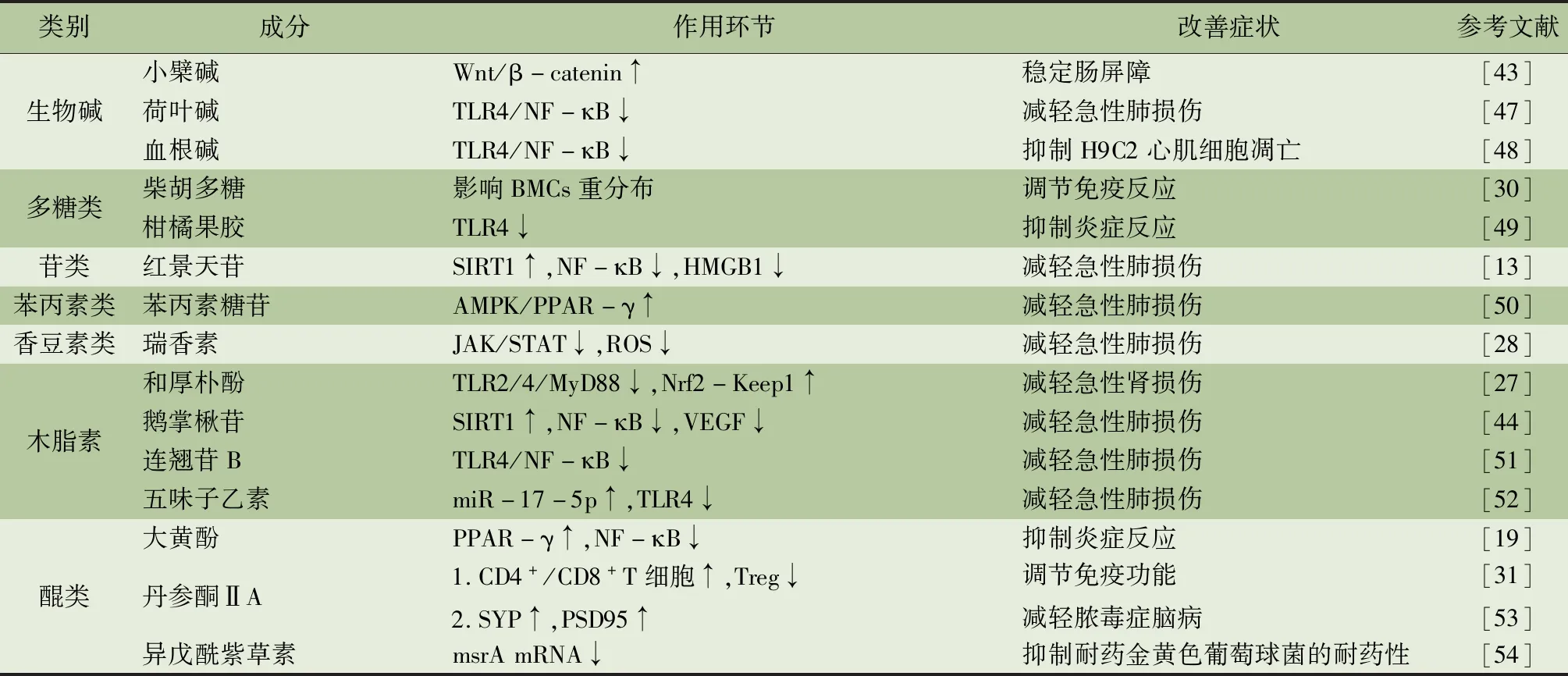
表1 中药活性成分防治脓毒症的作用环节进展

表1(续)
7 展望
尽管中药活性成分防治脓毒症的研究已取得一定进展,但其分子机制研究仍不够深入具体,仍缺乏明确的作用靶点。因此,如何利用基因组学、蛋白质组学、代谢组学和网络药理学等技术,整合基因敲除、蛋白抑制、过表达等分子生物学技术和分子对接与分子动力学模拟、表面等离子共振等方法,更客观、全面、具体地对中药活性成分治疗脓毒症的分子机制或关键环节进行深入阐释和反复确证,发掘中药有效成分在疾病相关信号网络中的具体作用靶点或识别生物标志物,以期为脓毒症新药开发提供可能的潜在靶点和先导化合物,为指导临床用药提供数据支持和参考依据,是未来探讨中药防治脓毒症需要思考的重要问题,值得关注。

