miR-21对宫颈癌Siha细胞增殖侵袭及调控SPRY2表达的影响*
夏 红,褚桂芬,杨 翔,杨 丽,胡金霞
(1.广东省广州市番禺区中心医院妇科 511400;2.滨州医学院生物化学与分子生物学教研室,山东烟台 264003)
宫颈癌是全世界女性中最常发生的恶性肿瘤之一,我国宫颈癌的发生率和病死率占全球的1/3,严重威胁妇女的身心健康[1]。micro RNA(miRNA)作为一种新型肿瘤诊断的生物标志物,已成为学者们研究的热点[2]。miRNA-21(miR-21)是发现较早、研究较多的一种miRNA,几乎参与了所有恶性肿瘤的发生发展[3]。快速发育生长因子同源蛋白2抗体(SPRY2)是miR-21的调控靶点之一,其异常表达在肿瘤细胞的增殖及凋亡等过程中发挥重要作用[4]。但是SPRY2在宫颈癌中的作用罕见报道,miR-21是否通过调控SPRY2的表达进而影响宫颈癌的增殖凋亡尚未有报道。鉴于此,本研究通过脂质体转染来调节宫颈癌Siha细胞中miR-21的表达水平,探讨miR-21对宫颈癌Siha细胞体外增殖、侵袭和凋亡的作用及可能机制。
1 材料与方法
1.1材料
1.1.1组织收集 采集2016年1月至2017年12月番禺区中心医院收治患者的宫颈鳞癌组织22例,诊断结果均由2位病理医师根据WHO分级诊断标准得出,患者均为新发病例,术前未接受过放化疗。因子宫肌瘤或子宫脱垂在番禺区中心医院住院并切除子宫,妇科检查及病理检查等排除宫颈疾病,术后获得正常宫颈组织标本22例。标本采集后迅速放至液氮中冷冻,-80 ℃低温保存。
1.1.2细胞及主要试剂 人宫颈鳞癌Siha细胞购自南京科佰生物科技有限公司,DMEM 培养基购自美国Hyclone公司,LipofectamineTM2000购自美国Invitrogen公司,RNA提取试剂盒购自广州易锦生物科技有限公司,Trizol 试剂购自日本宝生生物工程有限公司(大连),PCR所需引物购自上海吉玛制药技术有限公司,四甲基偶氮唑蓝(MTT)试剂盒购自武汉盖云天生物科技有限公司,AnnexinⅤ-FITC /PI 检测试剂盒购自美国BD公司,SPRY2蛋白购自英国Abcam公司,BCA 蛋白定量试剂盒和HRP-羊抗兔IgG购自碧云天生物科技有限责任公司。
1.2方法
1.2.1细胞培养、分组及转染 将宫颈鳞癌Siha细胞接种于含10%胎牛血清的DMEM 培养液中,37 ℃、5% CO2的恒温培养箱中培养,当细胞密度达80%~90%进行转染,细胞在转染前一天按2.0×105接种于6孔板中。采用LipofectamineTM2000脂质体法将miR-21模拟物(minic-21组)、模拟物对照寡核苷酸(minic-nc组)、抑制剂(inhibitor-21组)和抑制剂对照寡核苷酸(inhibitor-nc组)转染至人宫颈癌Siha细胞。转染后将细胞置于恒温培养箱中继续培养48 h进行后续实验。
1.2.2实时荧光定量PCR(quantitative real-time reverse transcription PCR,QPCR)检测miR-21及SPRY2 mRNA水平 按照Trizol试剂使用说明书提取细胞总RNA,用超微量分光光度计对RNA浓度和纯度进行检测。按反转录试剂盒说明书采用特异性反转录引物反转录为cDNA,以cDNA为模板,miR-21表达以U6为内参,SPRY2表达以GAPDH为内参进行QPCR检测。miR-21引物货号:上游HmiRQP0316,下游QP010-03。SPRY2上游引物:5′-GGACTGTGGCAAGTGCAAATGTA-3′;下游引物:5′-AAGGCACTGCTTGTCGCAGA-3′。GAPDH引物序列上游引物,5′-GCACCGTCAAGGCTGAGAAC-3′;下游引物:5′-TGGTGAAGACGCCAGTGGA-3′。扩增条件:95 ℃预变性10 min,95 ℃变性10 s,60 ℃退火20 s,72 ℃延伸10 s扩增40个循环。反应结束后采用2-△△Ct法计算miR-21和SPRY2的相对表达。
1.2.3MMT法检测细胞增殖 转染48 h后,消化离心收集细胞,调整细胞密度为1×104/每孔接种于96孔板,每组设5个复孔。37 ℃培养1~4 h,用酶标仪于波长490 nm处检测吸光度值,计算细胞增殖指数。
1.2.4流式细胞术检测细胞凋亡 采用流式细胞术联合Annexin Ⅴ-FITC /PI双染法检测凋亡率。细胞分组同上,用不含乙二胺四乙酸(EDTA)的胰蛋白酶消化各组细胞并得到单细胞悬液,PBS洗涤2次后,收集(1~5)×105个细胞,加入500 μL Binding buffer重悬细胞,之后分别加入5 μL AnnexinⅤ-FITC及5 μL PI 混匀,室温避光反应15 min,流式细胞术检测细胞凋亡,具体操作步骤按说明书进行。
1.2.5Transwell分析细胞侵袭 细胞转染48 h,将细胞饥饿12 h后制备细胞混悬液,并在无血清培养基中调整细胞密度为1×105/mL,然后将细胞悬液加入包被Matrigel胶的Transwell上室中,下室中加入含10%胎牛血清的培养基。37 ℃培养,细胞侵袭24 h,取出小室,将Trans well小室基底膜完整切除,用无菌棉拭子擦去上室内细胞,多聚甲醛固定15 min,苏木精染色10 min,显微镜下随机取6个视野计数细胞侵袭数目,取平均值。
1.2.6Western blot检测SPRY2蛋白的表达 转染48 h后,收集待测细胞,用PBS洗3次,然后加入已添加蛋白酶抑制剂的细胞裂解液进行裂解后提取总蛋白。等量的蛋白进行SDS-PAGE凝胶电泳分离,然后转至PVDF膜。用5%的BSA进行封闭后,依次孵育一抗和二抗,最后进行显影拍照。

2 结 果
2.1miR-21和SPRY2 mRNA在宫颈癌组织中的表达情况 QPCR检测结果显示,miR-21在宫颈癌组织中的表达(2.543±0.474)明显高于正常宫颈组织(0.766± 0.182),SPRY2 mRNA在宫颈癌组织中的表达(0.076±0.012)明显低于正常宫颈组织(0.988±0.383),二者比较差异均有统计学意义(P<0.05)。进一步分析发现miR-21和SPRY2 mRNA在宫颈癌组织中表达呈负相关(r=-0.646 3,P=0.001 2),见图1。

1:正常宫颈组织;2:宫颈癌组织
图1 miR-21和SPRY2在宫颈癌及正常宫颈组织中的表达
2.2改变miR-21表达对宫颈癌Siha细胞增殖的影响 转染miR-21mimic后,宫颈癌Siha细胞OD值(1.006±0.061)较minic-nc组(0.472±0.035)明显升高;转染miR-21 inhibitor后,宫颈癌Siha细胞OD值(0.338±0.023)较inhibitor-nc组(0.516±0.031)明显降低,二者比较差异均具有统计学意义(P<0.01),见图2。

***:P<0.05
图2改变miR-21表达对宫颈癌Siha细胞增殖的影响
2.3改变miR-21表达对宫颈癌Siha细胞凋亡的影响 采用Annexin-FITC/PI双染法检测Siha细胞的凋亡率。转染48 h后,minic-21组细胞凋亡率为(16.55±0.05)%,低于minic-nc组的(31.00±1.80)%,差异有统计学意义(P<0.05)。inhibitor-21组转细胞凋亡率为(68.60±1.90)%,高于inhibito-nc组的(47.10±2.60)%,差异有统计学意义(P<0.05),见图3。
2.4改变miR-21表达对宫颈癌Siha细胞侵袭能力的影响 Transwell法检测结果显示,minic-nc组、minic-21组、inhibitor-nc组、inhibitor-21组的侵袭数目分别是101.500±8.872、194.000±6.885、101.000±7.389、41.830±5.029。与minic-nc组相比,minic-21组Siha细胞体外侵袭能力明显提高(P<0.01)。与inhibitor-nc组相比,inhibitor-21组Siha细胞侵袭能力明显下降(P<0.01),见图4。

A:柱状图;B:流式细胞仪记录图;*:P<0.05
图3改变miR-21表达对Siha细胞凋亡率的影响

图4 转染miR-21后各组Siha细胞的侵袭情况(×100)
2.5改变miR-21表达对宫颈癌Siha细胞SPRY2 mRNA和蛋白表达的影响 分别采用QPCR和Western blot检测各组细胞中SPRY2 mRNA和SPRY2蛋白的表达情况,实验结果见表1,图5。与minic-nc组相比,minic-21组SPRY2蛋白水平明显降低(P<0.05),SPRY2 mRNA水平无明显差异(P>0.05);inhibitor-21组SPRY2 mRNA和蛋白水平均明显高于inhibitor-nc组(P<0.01)。

表1 各组细胞SPRY2mRNA和蛋白的表达
*:P<0.05,与inhibitor-nc组比较;△:P<0.05,与minic-nc组比较
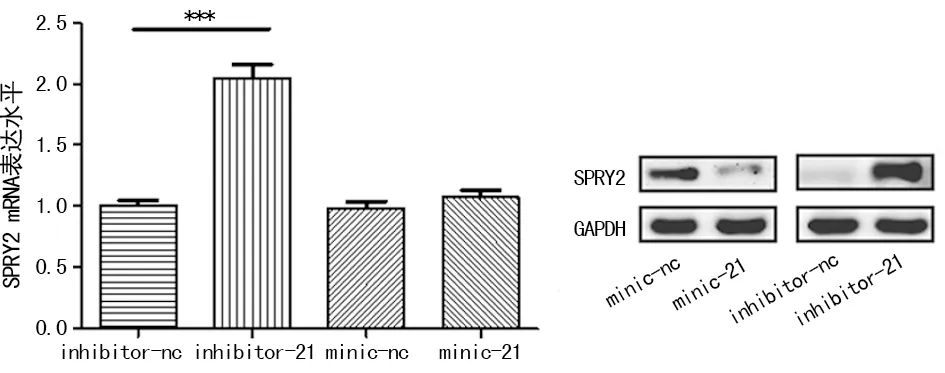
***:P<0.05
图5改变miR-21表达对Siha细胞SPRY2mRNA和蛋白表达的影响
3 讨 论
宫颈癌是最常见的妇科恶性肿瘤,我国是宫颈癌的高发区,每年新增10余万例,近年来发病率有逐渐上升的趋势。近期调查结果显示,宫颈癌平均发病年龄为42岁,具有年轻化趋势[5]。miRNA是一种由大约20个核苷酸构成的小型非编码RNA。新近研究显示,miRNA分子不仅可作为临床肿瘤的诊断标记分子,也可作为临床肿瘤基因治疗的潜在新靶标[6]。miR-21是miRNA家族著名的癌基因明星,在多种肿瘤中高表达,如肺癌、乳腺癌、前列腺癌、食管癌、恶性胶质瘤、膀胱癌及头颈部实体肿瘤等[7-8],被开发为恶性肿瘤治疗的潜在靶点[9]。文献[10]报道,miR-21和miR-214在宫颈癌网络中是核心生物学因素。miR-21在宫颈癌组织及相应细胞系中均为高表达[11]。在宫颈癌Hela细胞系中,下调miR-21表达,体外细胞的增殖能力受到显著抑制[12]。在体外培养宫颈鳞癌细胞系中还发现miR-21可以通过调节其靶基因CCL20的表达,来调节癌细胞的增殖、凋亡、侵袭、转移等生物学过程[13]。因此,miR-21在宫颈癌发生发展中扮演着重要的角色。
本研究采用QPCR检测宫颈癌组织中miR-21的表达。结果表明,miR-21在宫颈癌组织中的表达显著高于正常宫颈组织(P<0.05),推测miR-21与宫颈癌的发生有关。但其作用机制尚未完全清楚。体外生长的Siha细胞是研究宫颈癌发病机制及评价治疗策略的经典细胞株。为此,本研究以人宫颈癌Siha细胞为研究对象,合成特异性miR-21 mimics和miR-21 inhibitor,然后转染至Siha细胞中,通过调节miR-21的表达水平来观察其对Siha细胞增殖、凋亡、侵袭以及对SPRY2表达的影响。本研究用MTT法观察细胞增殖,流式细胞仪检测细胞凋亡,Transwell检测细胞侵袭能力,结果显示Siha细胞转染miR-21mimics后,细胞的增殖能力明显提高,凋亡能力明显下降,侵袭能力明显增强(P<0.05);转染miR-21 inhibitor后细胞的增殖、凋亡与侵袭能力变化相反(P<0.05)。说明miR-21可能通过促进细胞增殖、抑制凋亡及促进细胞侵袭能力,在宫颈癌发生发展中发挥癌基因的作用,miR-21分子可能成为宫颈癌基因治疗的一个全新的靶点。
研究证实miR-21作为致癌基因,可通过下调抑制多种靶基因的表达,从而改变肿瘤细胞的生物学特性,参与肿瘤的发生发展及转归等过程[14]。miR-21通过抑制PDCD4、PTEN、p53、Sox2、bcl2及PIK3R1等基因的表达,促进细胞的增殖和抑制其凋亡[15-16]。通过搜索Target Scan、Pictar及Microcosm数据库,本研究发现SPRY2是miR-21的调控靶点之一。SPRY2是sprouty家族4个成员(SPRY1~4)之一,在机体各器官广泛表达[17]。有研究表明,SPRY2 蛋白表达与乳腺癌、前列腺癌、肺癌、肝癌、卵巢癌、结直肠癌以及多发性骨髓瘤有关[4,18-19]。但是SPRY2在宫颈癌中的研究罕见报道,宫颈癌中miR-21是否通过调控 SPRY2 的表达进而影响宫颈癌的增殖和凋亡尚未有报道。
本研究采用QPCR检测宫颈癌组织中SPRY2的表达,结果显示SPRY2在宫颈癌中低表达(P<0.05)。进一步通过相关分析发现,miR-21和SPRY2的表达呈负相关(P<0.05)。接着本研究用QPCR和Western blot检测了转染miR-21后各组细胞中SPRY2 mRNA和蛋白表达情况。结果发现inhibitor-21组SPRY2 mRNA和蛋白水平均显著高于inhibitor-nc组(P<0.05),而minic-21组SPRY2蛋白水平明显低于minic-nc组(P<0.05),SPRY2 mRNA水平和minic-nc组比较差异无统计学意义(P>0.05);提示miR-21与SPRY2蛋白质的水平存在显著的负相关关系,而与SPRY2 mRNA的水平则无显著相关,证实miR-21在蛋白层面对SPRY2发挥调控作用。miR-21可能是通过调控肿瘤抑制基因SPRY2的表达而发挥癌基因的作用。
本研究不足之处是未进行双荧光素酶报告基因实验,不能进一步证实SPRY2是miR-21的靶基因,需要通过相关实验验证并进一步阐明miR-21作用的分子机制。
综上所述,miR-21在宫颈癌的发病中发挥了原癌基因的作用,且miR-21可能是通过调控肿瘤抑制基因SPRY2的表达而发挥作用的,提示miR-21分子可能成为宫颈癌基因治疗的一个全新的靶点。

