X线全身照射对2型糖尿病KKAy小鼠造血免疫系统功能的影响
党女,卢延华,管博文,苏路路,李程程,荣利,王小春, 孟爱民*
(1. 中国医学科学院医学实验动物研究所,北京协和医学院比较医学中心,国家卫生和计划生育委员会人类疾病比较医学重点实验室,北京市人类重大疾病实验动物模型工程技术研究中心, 北京 100021;2. 北京市化工职业病防治院, 北京 100176)
目前,全球范围内糖尿病和恶性肿瘤的发病率正逐年增加。2013年的调查研究显示,中国罹患糖尿病的成年人预计达11.6%,有50.1%的人处于糖尿病前期[1]。流行病学显示,糖尿病与肿瘤的发生密切相关[2-3],糖尿病患者的恶性肿瘤发生率明显高于非糖尿病患者。随着老龄化的到来,恶性肿瘤患者合并糖尿病者增多,其治疗问题不容忽视。
现代医学对肿瘤的治疗,主要是手术、放疗、化疗以及分子靶向治疗等手段。放化疗是恶性肿瘤的常规治疗,其杀灭癌细胞的同时会损害正常组织细胞的功能,诱发胃肠道反应,骨髓抑制和造血系统损伤等毒副反应,导致患者难以接受进一步的治疗[4]。近年来,在小鼠,大鼠和人类中的研究表明,糖尿病可导致骨髓微环境受损,如微血管病变、神经末梢病变和干细胞动员受损等[5-6]。糖尿病可能破坏骨髓的结构与功能,使未成熟的细胞进入血液,可能损害造血干细胞的潜能。糖尿病患者本身处于“慢性低水平炎症”的状态[7],骨髓微环境受损,对放化疗的敏感性和耐受性可能会发生变化。
KKAy小鼠是自发性2型糖尿病动物模型,具有高血糖、糖耐量受损、高胰岛素血症、肥胖和高脂血症等临床表现。8周龄时血糖水平显著升高[8],且KKAy小鼠的实验多采用C57小鼠作为对照[9]。本研究拟建立KKAy小鼠的辐射损伤模型,与健康对照C57小鼠比较,观察骨髓、胸腺和脾等组织功能细胞比例的变化,比较造血免疫系统损伤的差异,为临床相应情况安全用药提供资料。
1 材料与方法
1.1 材料
1.1.1 实验动物
SPF级雄性C57BL/6J小鼠20只,体重25~30 g,10~12周龄;SPF级雄性KK/upj-Ay/J小鼠20只,体重28~35 g,10~12周龄,由北京华阜康生物科技股份有限公司提供【SCXK(京)2014-0004】。小鼠饲养于中国医学科学院医学实验动物研究所屏障环境动物房【SYXK(京)2015-0035】。饲养环境:昼夜各半交替,湿度恒定,温度20~25℃。实验方案通过医学实验动物研究所实验动物管理和使用委员会批准(IACUC号:MAM18002)。
1.1.2 主要试剂及仪器
流式细胞术所需抗体Biotin-CD45R(B220)、Biotin-Ly-6G/Ly-6C、Biotin-TER-119、Biotin-CD4、Biotin-CD8a、Biotin-CD11b、PE-Sca-1、APC-c-Kit(CD117)、FITC-CD34、APC-CD3、PE-CD8a、PE-Ter119、FITC-Gr-1、APC-CD11b抗体购于eBioscience公司;PerCP-Cy5.5-Streptavidin、PE-B220、PerCP-CD4抗体购于BD Biosciences公司。甲基纤维素半固体培养基MethoCult GF(M3534)购自STEMCELL公司。
X线辐照仪(Precision X-ray,X-RAD 225,美国),流式细胞仪(BD Biosciences,BD FACS Aria TM II,美国),全自动血细胞计数仪(Horiba,ABX Pentra DX 120,法国)。
1.2 方法
1.2.1 实验动物分组
为检测电离辐射对健康小鼠和2型糖尿病小鼠的造血免疫系统的损伤作用,将C57BL/6J小鼠分为对照组(C57组)和照射组(C57 TBI组),KK/upj-Ay/J小鼠分为对照组(KKAy组)和照射组(KKAy TBI组)。照射组小鼠用X线全身照射(total body irradiation,TBI),剂量4 Gy,剂量率:0.95 Gy/ min。照射15 d后取材,检测相应指标。
1.2.2 外周血血常规检测
照射15 d后,小鼠眶静脉丛取外周血(大于0.5 mL),加入使用EDTAK3抗凝的EP管里,用全自动血细胞计数仪测定白细胞计数(WBC)、红细胞计数(RBC)、血小板(PLT)、血红蛋白(HGB)和淋巴细胞比率(LYM%)等指标。
1.2.3 造血干细胞和造血祖细胞比例测定
分离的骨髓细胞,调整细胞浓度到5×107/mL,每只小鼠取100 μL用于后续染色。按体积比1∶50加入biotin标记的CD45R(B220)、Ly-6G/Ly-6C、TER-119、CD4、CD8a、CD11b抗体,4℃避光孵育30 min,PBS洗涤一次(1500 r/ min离心5 min)。离心后弃去上清,加入100 μL PBS重悬,加入混合二抗:PerCP-cy5.5标记的streptavidin、PE标记的Sca-1、APC标记的c-Kit(CD117)、FITC标记的CD34。4℃避光孵育1 h,PBS洗涤一次。离心后弃上清,加入300 μL PBS重悬,流式细胞仪检测造血祖细胞(HPC, Lin-Sca-1+c-Kit-)、造血干细胞(HSC, Lin-Sca-1+c-Kit+)、长期造血干细胞(LT-HSC, CD34-Lin-Sca-1+c-Kit-)在骨髓有核细胞(bone marrow mononuclear cells,BMNCs)中所占的比例。
1.2.4 粒细胞-巨噬细胞集落形成单位测定(colony forming unit-granulocyte and macrophage assay, CFU-GM)
参考本实验室前期发表文献[10],无菌取小鼠骨髓细胞,用PBS调整细胞浓度到4×105/mL,每组小鼠取0.2 mL 细胞加入到2 mL M3534培养基中,混合均匀后,加入到24孔板,每孔0.5 mL。将培养板置于37℃,5% CO2恒温培养箱中。培养7 d后用显微镜观察,计数粒细胞巨噬细胞集落,以检测小鼠造血祖细胞分化为粒细胞和巨噬细胞的能力。
1.2.5 脾淋巴细胞分型测定
分离的脾细胞,加入裂红液裂解红细胞后得到细胞悬液,调整细胞浓度到1×107/mL,每只小鼠取100 μL用于后续染色。加入PE标记的B220、APC标记的CD3、PerCP标记的CD4混合抗体,4℃避光孵育30 min,PBS洗涤一次(1500 r/min离心5 min)。离心后弃上清,加入300 μL PBS重悬,流式细胞仪检测B细胞(B220+)、T细胞(CD3+)、CD4+T 细胞(CD4+CD3+)的比例。
1.2.6 胸腺淋巴细胞分型测定
分离的胸腺细胞,调整细胞浓度到1×107/mL,每只小鼠取100 μL用于后续染色。加入PerCP标记的CD4、PE标记的CD8混合抗体,4℃避光孵育30 min,PBS洗涤一次。离心后弃上清,加入300 μL PBS重悬,流式细胞仪检测CD4CD8双阳性T细胞(CD4+CD8+)、CD4单阳性T细胞(CD4+CD8-)、CD8单阳性T细胞(CD4-CD8+)的比例。
1.3 统计学方法
2 结果
2.1 全身照射对小鼠外周血常规的影响
为检测辐射对C57和KKAy小鼠造血系统的影响,4 Gy照射15 d后,检测小鼠的外周血计数,结果见图1。照射前,KKAy小鼠的LYM%显著低于C57小鼠,(84.80±3.55)% vs (92.18±1.18)%,P< 0.01(图1E),其余指标无统计学差异。与对照组小鼠相比,4 Gy全身照射后,C57小鼠的WBC、RBC、HGB、PLT及LYM%均显著降低。同时,与对照组小鼠相比,照射后KKAy小鼠的WBC、RBC及PLT均显著降低,而HGB和LYM%有下降趋势,但无统计学差异。其中,照射后KKAy小鼠的RBC和HGB的下降幅度明显低于C57小鼠,分别为(12.17±6.18)% vs (30.63±5.21)%、(8.78±5.76)% vs (29.66±4.78)%。以上结果表明:C57小鼠和KKAy的LYM%可能存在差异,4 Gy全身照射可降低C57和KKAy小鼠的WBC、RBC、HGB、PLT和LYM%,而KKAy小鼠在RBC和HGB这两项指标上表现出对电离辐射较强的耐受性。
2.2 全身照射对小鼠造血干细胞和造血祖细胞比例的影响
为探究辐射对小鼠造血干细胞和造血祖细胞比例的影响,小鼠照射后15 d后,用流式细胞仪检测小鼠的骨髓细胞。参考已发表文献[11],流式细胞仪分析时门的设置如图2所示。
实验结果如图3所示,照射前,KKAy小鼠的HSC和LT-HSC的比例显著低于C57小鼠(图3B,3C)。4 Gy全身照射后C57小鼠的HPC、HSC、LT-HSC的比例显著下降;KKAy小鼠的HPC的比例明显下降,但HSC和LT-HSC有下降趋势,无统计学差异。KKAy小鼠,照射后HSC和LT-HSC的下降幅度则显著低于C57小鼠,分别为(29.49±13.86)% vs (62.48±5.77)%、(35.74±3.60)% vs (79.82±4.21)%。以上结果表明,C57小鼠和KKAy小鼠的HSC和LT-HSC比例可能存在差异,4 Gy辐射暴露降低C57和KKAy小鼠的HPC、HSC和LT-HSC的比例,而KKAy小鼠反而表现出较强的耐受性。
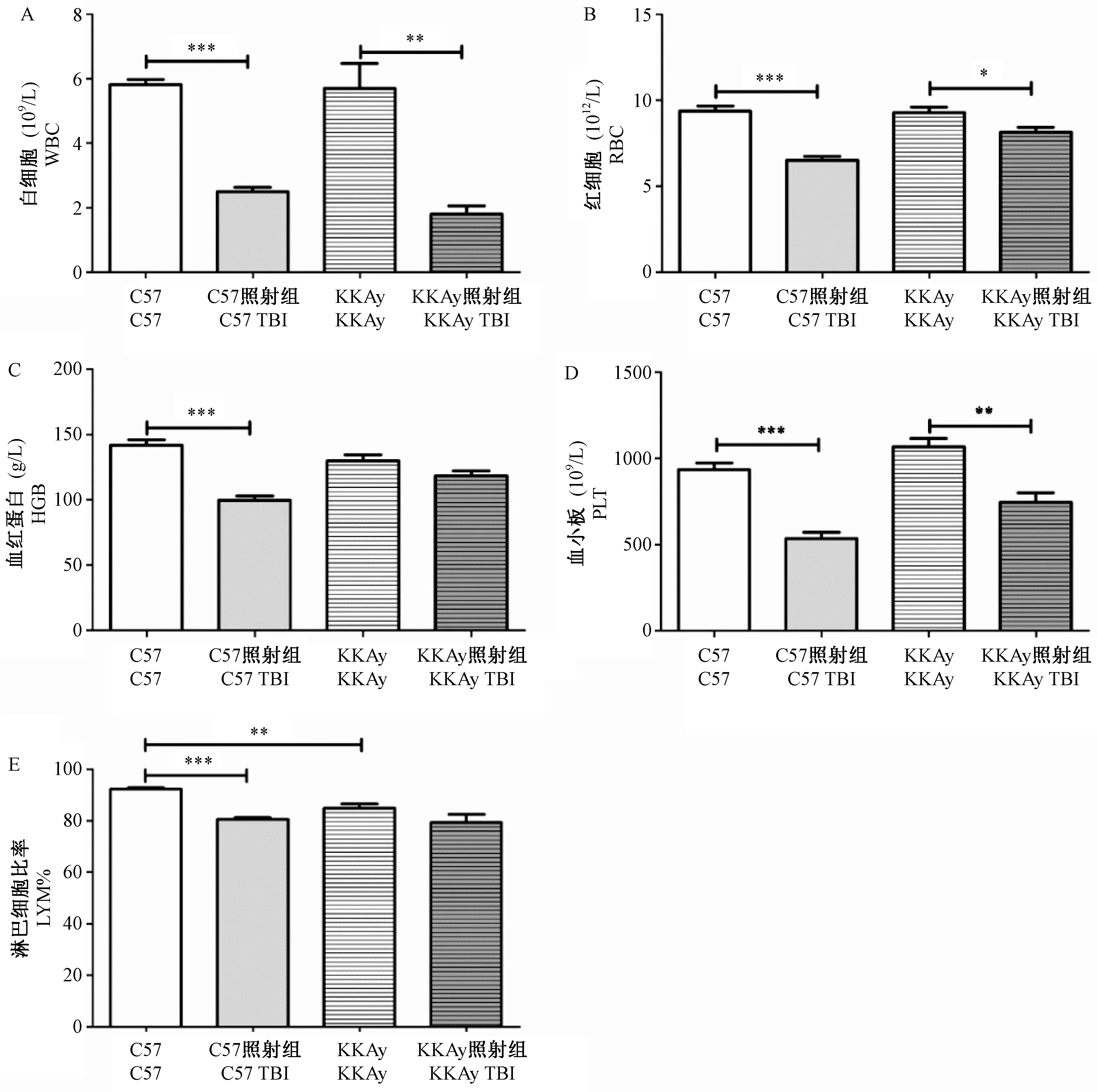
注:与对照组相比,*P< 0.05,**P< 0.01,***P< 0.001。(下图同)图1 全身照射对C57和KKAy小鼠外周血常规的影响Note.Compared with the control group, *P< 0.05, **P< 0.01,***P< 0.001.(The same in the following figures)Figure 1 Effect of X-ray whole-body irradiation on the peripheral blood routine test of C57 and KKAy mice
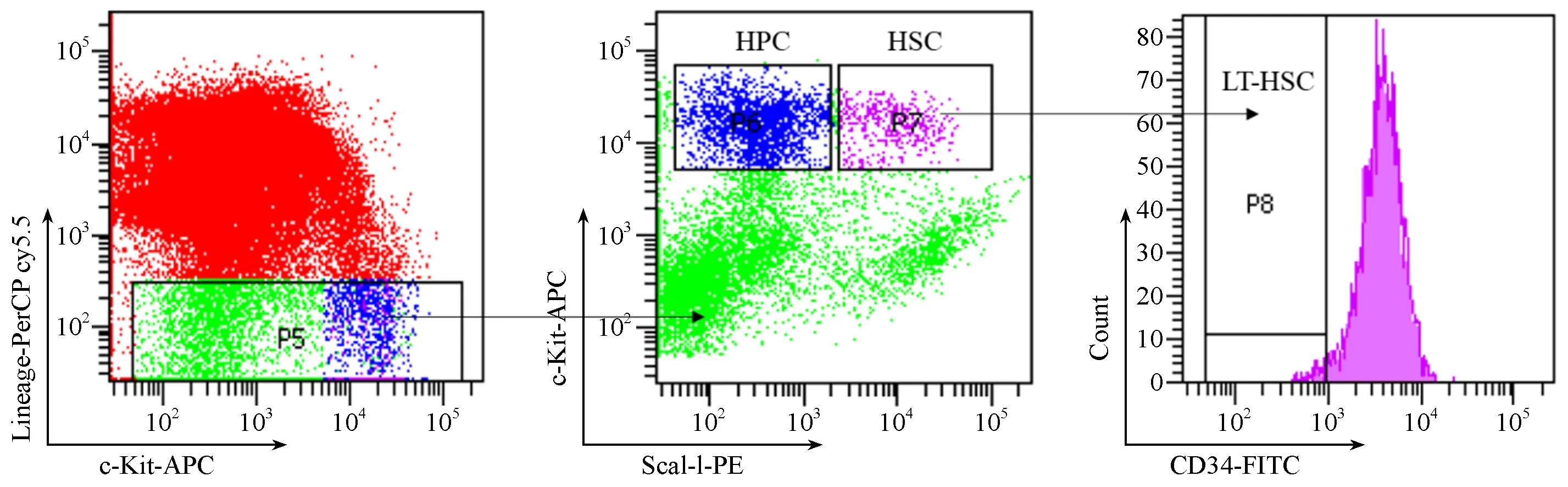
图2 流式细胞仪分析时门的设置Figure 2 Gate setting of the flow cytometry analysis
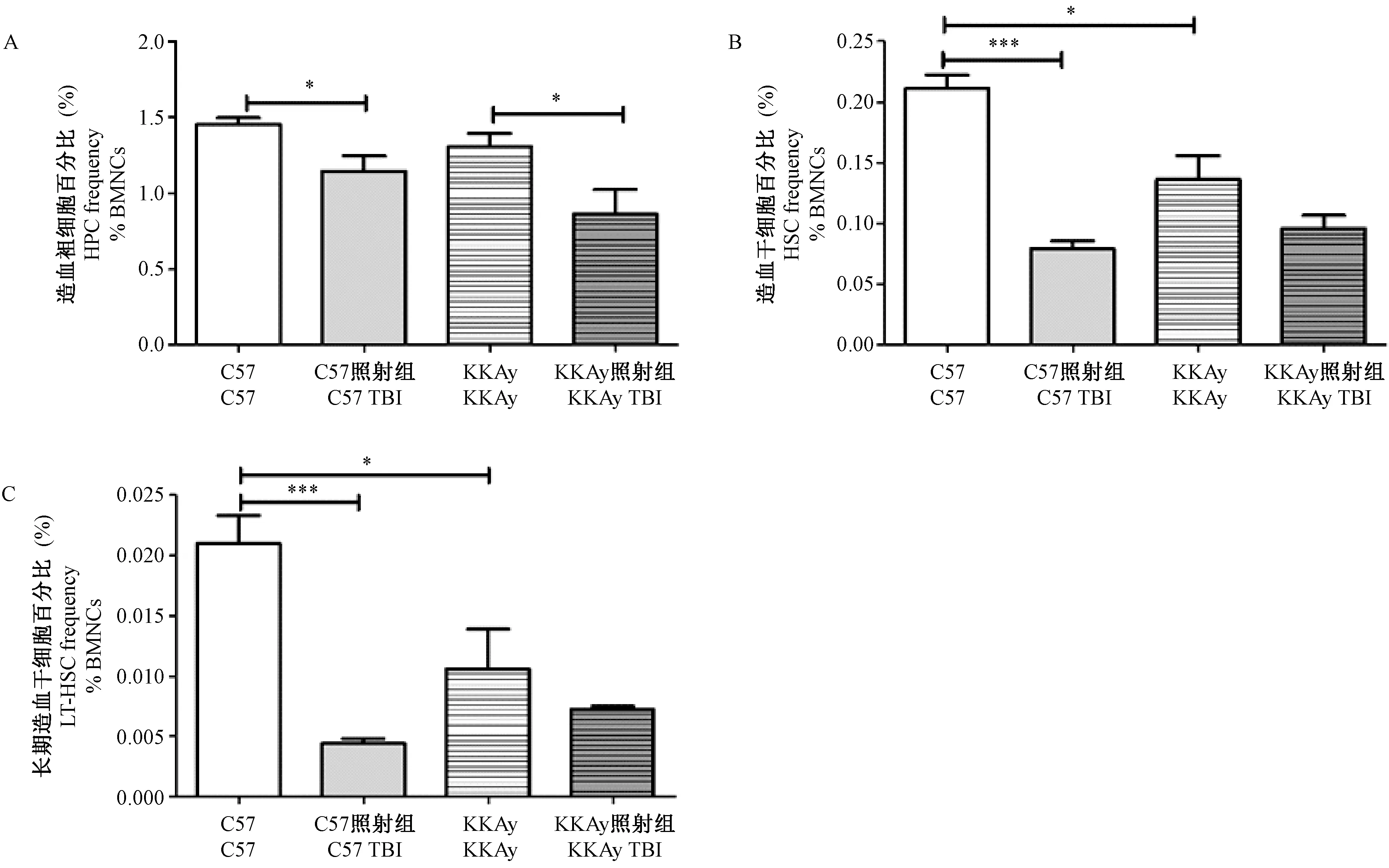
图3 全身照射对C57和KKAy小鼠HPC、HSC和LT-HSC比例的影响Figure 3 Effect of whole-body irradiation on the percentages of mouse HPC, HSC and LT-HSC
2.3 全身照射对小鼠CFU-GM的影响
检测粒细胞巨噬细胞集落形成能力(CFU-GM),以评价小鼠造血祖细胞的增殖能力。实验结果如图4所示,照射前,C57和KKAy的CFU-GM数目没有统计学差异;4 Gy全身照射后,与对照组相比,C57小鼠和KKAy小鼠的CFU-GM数目明显降低。KKAy小鼠与C57小鼠的降低幅度无统计学差异,(64.71±11.15)% vs (62.93±7.00)%,P> 0.05。以上结果表明:4 Gy辐射暴露可显著降低C57和KKAy小鼠的CFU-GM数目,但照射前后,两者的造血祖细胞功能均没有表现出差异。
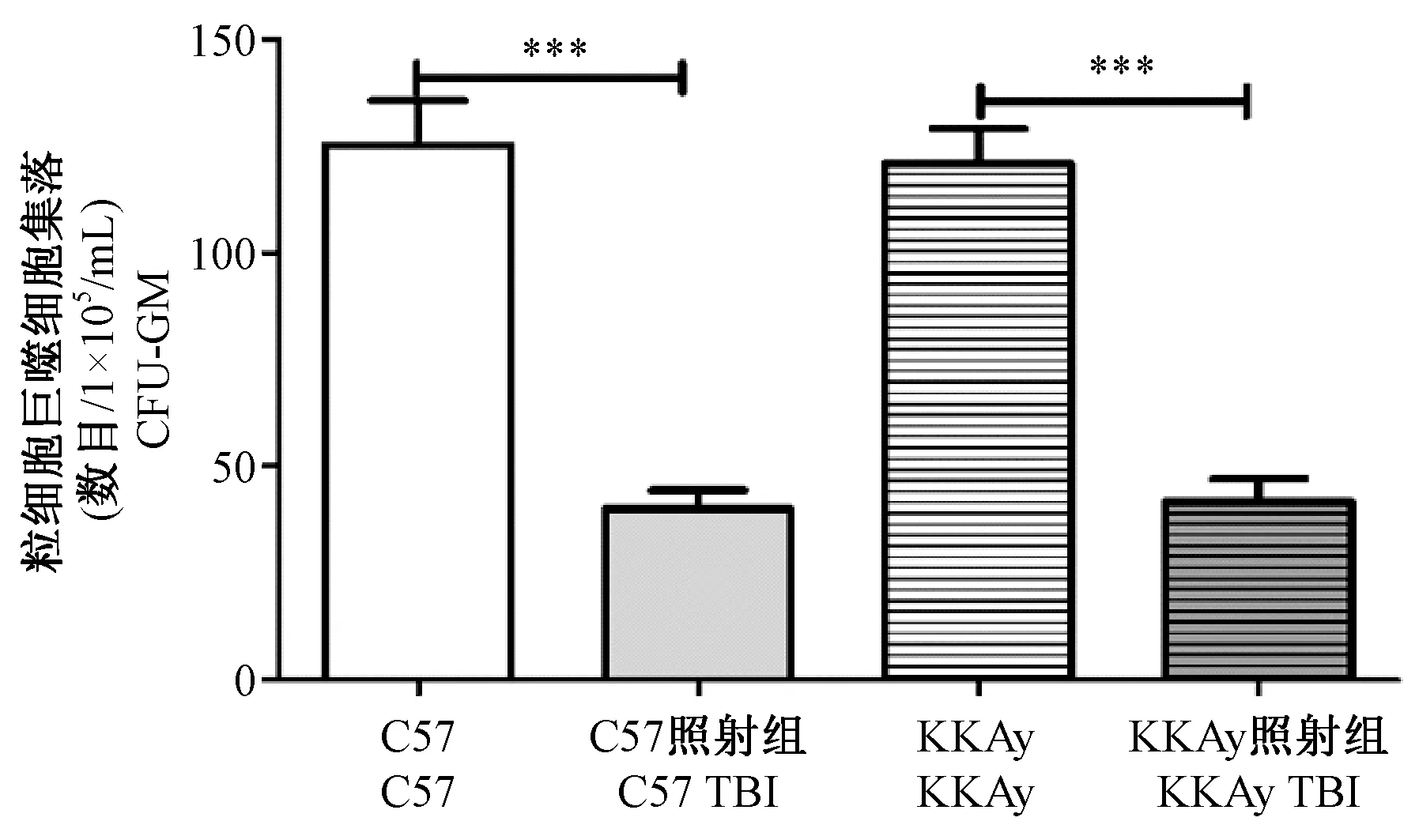
图4 全身照射对C57和KKAy小鼠CFU-GM的影响Figure 4 Effect of whole-body irradiation on CFU-GM of the C57 and KKAy mice
2.4 全身照射对小鼠脾淋巴细胞比例的影响
为了检测辐射对小鼠脾免疫细胞的影响,我们检测了脾中B细胞、T细胞以及CD4+T细胞的比例。结果如图5所示。照射前,KKAy小鼠与C57小鼠相比,B细胞、T细胞以及CD4+T细胞的比例均无统计学差异。4 Gy照射后,与对照组相比,C57小鼠和KKAy小鼠的B细胞、T细胞以及CD4+T细胞的比例均显著降低。KKAy小鼠与C57小鼠相比,B细胞、T细胞以及CD4+T细胞的下降幅度的比例均无统计学差异。以上结果表明:4 Gy辐射暴露可显著降低C57和KKAy小鼠脾中B细胞、T细胞以及CD4+T细胞的比例,但照射前后,两者的脾免疫细胞比例没有表现出差异。
2.5 全身照射对小鼠胸腺免疫细胞比例的影响
为了检测辐射对小鼠胸腺免疫细胞的影响,我们检测了胸腺中CD4CD8双阳性T细胞、CD4单阳性T细胞及CD8单阳性T细胞的比例。结果如图6所示。照射前,KKAy小鼠的CD8单阳性T细胞的比例显著低于C57小鼠,(2.92 ± 0.51)% vs (4.34 ± 1.10)%,P< 0.05,如图6C所示)。4 Gy照射后,与对照组相比,C57小鼠的CD4CD8双阳性T细胞的比例显著降低,CD4单阳性T细胞的比例显著增加,CD8单阳性T细胞的比例略有增加,但无显著性差异;KKAy小鼠的CD4CD8双阳性T细胞的比例显著降低,CD4单阳性T细胞和CD8单阳性T细胞的比例略有增加,但无显著性差异。其中,照射后KKAy小鼠的CD4单阳性T细胞比例升高幅度显著低于C57小鼠,(15.30 ± 17.00)% vs (115.90 ± 33.85)%,P< 0.001。以上结果表明:4 Gy辐射暴露可显著降低C57和KKAy小鼠脾中CD4CD8双阳性T细胞的比例。
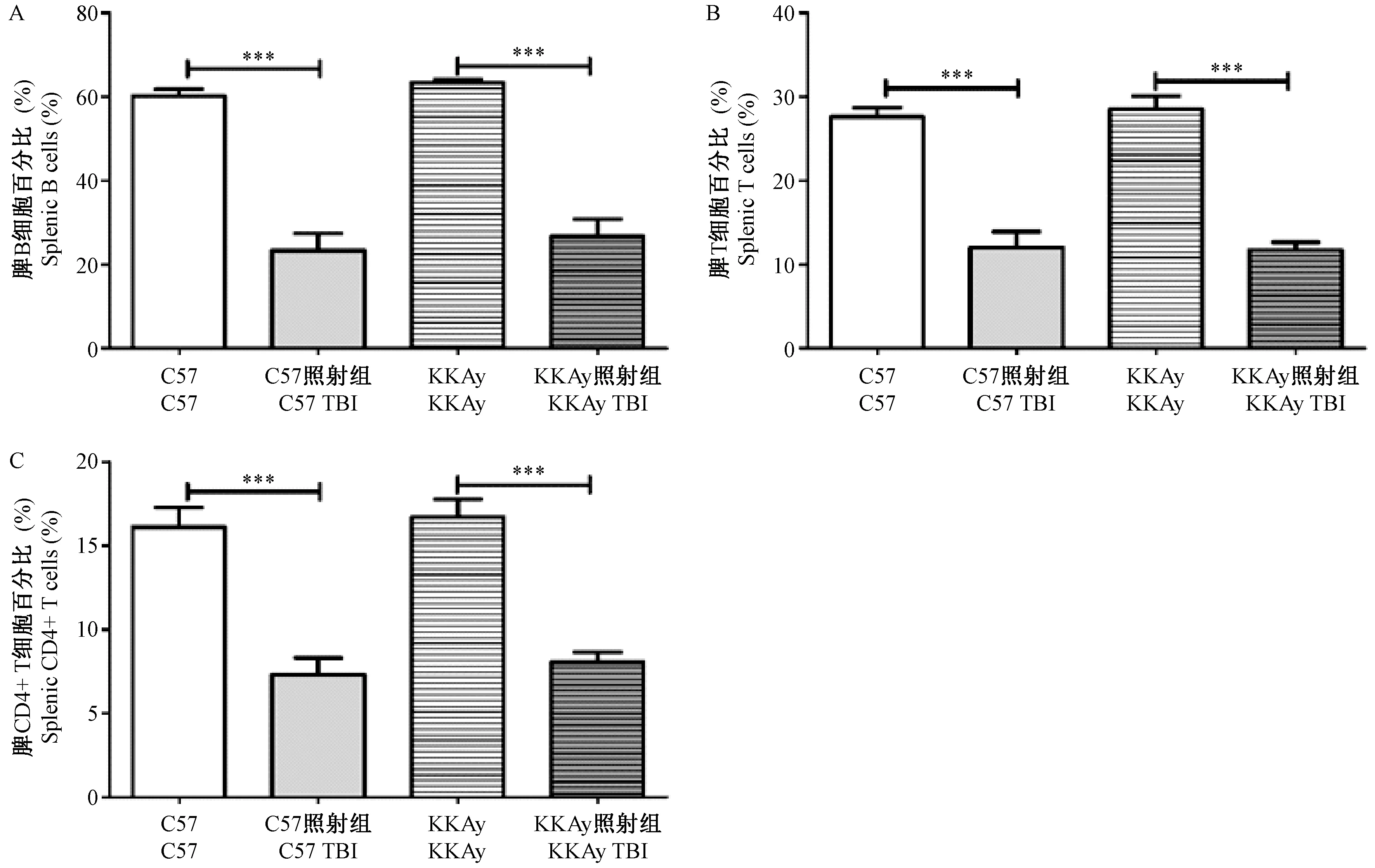
图5 全身照射对C57和KKAy小鼠脾淋巴细胞的影响Figure 5 Effect of whole-body irradiation on the percentages of splenic lymphocytes in the C57 and KKAy mice
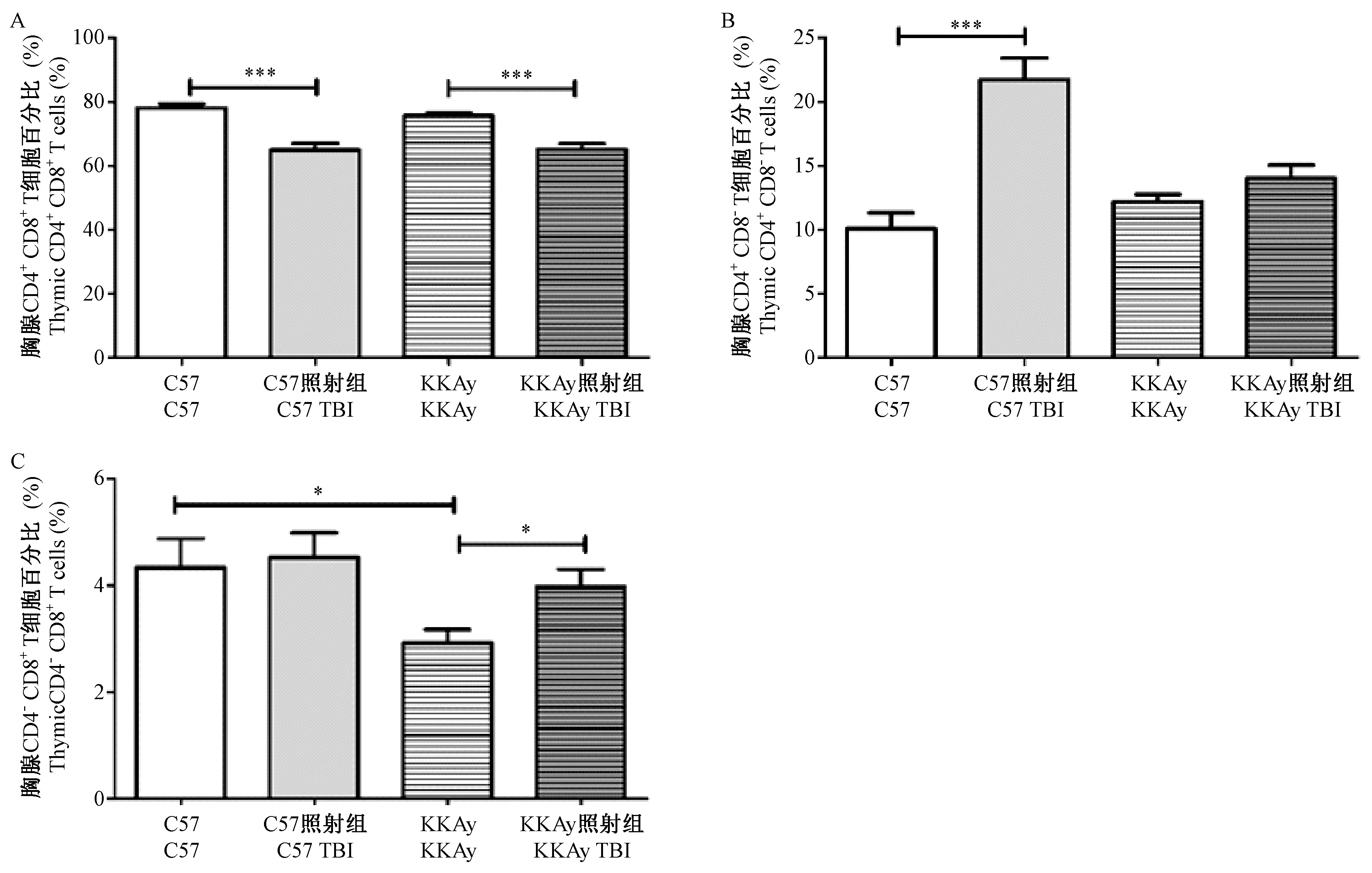
图6 全身照射对C57和KKAy小鼠胸腺淋巴细胞的影响Figure 6 Effect of whole-body irradiation on the percentages of thymic lymphocytes in the C57 and KKAy mice
3 讨论
本次实验采用X线亚致死剂量(4 Gy)全身照射小鼠,实验结果可见电离辐射对小鼠明显的骨髓抑制和免疫功能损伤作用,4 Gy全身照射小鼠可以损伤造血免疫系统功能,降低外周血WBC、RBC、PLT的数目,降低HGB含量和LYM%,降低HPC、HSC和LT-HSC的比例,降低脾B细胞和T细胞的比例,降低胸腺CD4CD8双阳性细胞的比例。
比较发现,2型糖尿病KKAy小鼠的HSC和LT-HSC的比例以及外周血LYM%低于C57小鼠,提示糖尿病与健康小鼠在造血免疫功能上存在差异。这与之前发表的糖尿病中HSC功能受损的研究结果一致[12-13]。4 Gy全身照射15 d后,KKAy小鼠与C57小鼠某些指标降低的幅度也存在显著性差异,KKAy小鼠的骨髓HSC和LT-HSC的降低幅度明显低于C57小鼠,外周血RBC和HGB也发生了同样的变化,提示我们KKAy小鼠可能比C57小鼠表现出对电离辐射更强的耐受性。但由于糖尿病本身造血免疫系统受损,KKAy小鼠未必表现出对长期的电离辐射更强的耐受性,需要进一步的研究。
Bannon等[14]研究发现,2型糖尿病中造血干细胞的谱系分化改变,在向淋巴细胞分化过程中,糖尿病小鼠与健康小鼠的HSC分化偏移不同,糖尿病小鼠更易M1型巨噬细胞分化,导致长期的炎症状态,引起糖尿病创面难愈的状态。糖尿病小鼠长期处于“慢性炎症”的应激状态,可能导致其对单次全身照射的耐受更强。此外,2型糖尿病KKAy小鼠表现出对机体辐射损伤的耐受性作用类似于适应性反应。低剂量单次全身照射可诱导小鼠免疫适应性反应[15],低剂量辐射可激活细胞中的信号传递系统,使损伤后DNA修复,通过凋亡等机制清除损伤细胞进而对相继高剂量辐射产生耐受性。糖尿病小鼠中是否存在类似的机制导致其对高剂量辐射产生耐受性也是一个值得研究的内容。
电离辐射可通过引起小鼠造血祖细胞凋亡,造成急性骨髓抑制;通过引起造血干细胞衰老,导致长期的骨髓抑制[16-17]。细胞衰老与2型糖尿病的发生发展密切相关[18],因此细胞衰老可能与糖尿病小鼠在电离辐射的耐受性有关。
本项研究分析比较了糖尿病小鼠与对照小鼠造血免疫细胞辐射损伤,为糖尿病小鼠辐射敏感性深入研究提供了基础资料。糖尿病与恶性肿瘤的放疗损伤敏感性的相关性有待进一步观察和探讨。

