骨形态发生蛋白9基因敲除小鼠的构建
周珂,辛智倩,刘佩娟,马翠,师长宏,王华,张海*
(1. 空军军医大学实验动物中心,西安 710032; 2. 安徽医科大学药学院,合肥 230032)
骨形态发生蛋白(bone morphogenetic proteins, BMPs)属于转化生长因子(transforming growth factor-β, TGF-β)超家族,是一类多功能生长因子。到目前为止,已发现超过20种BMP相关蛋白,并根据其氨基酸序列及功能将其分为四种亚家族。其中,BMP9和BMP10组成一种亚家族,在胚胎干细胞分化、成骨形成、血管生成、糖脂代谢等方面中起到重要作用[1]。BMP9作为成骨作用最强的BMPs家族成员也受到越来越多的关注。
BMP9又称为生长分化因子2(growth and differentiation factor 2, GDF2),主要由肝细胞产生,且有研究发现其mRNA在中枢神经系统和骨骼肌中也有少量表达[2]。BMP9不同于其他BMPs家族成员的是其对受体的选择性以及对信号调节的敏感性,它与激活素受体样激酶1(activin receptor-like kinase 1, ALK1)有高度亲和力[3],结合后能够激活Smad依赖性BMP信号通路,从而影响细胞生长发育等生理过程[4]。近年来,大量文献报道BMP9参与多种生物学进程,当BMP9信号失调时,能够诱发多种疾病,如肺动脉高压、遗传性出血性毛细血管扩张症,肝疾病等[5-7]。研究发现,在肝纤维化疾病进程中,肌成纤维细胞的细胞外基质(extracellular matrix, ECM)蛋白合成增多是纤维化形成的一个重要机制,BMP9能够通过与ALK1或ALK1与ALK5复合体结合,使Smad1/5/8磷酸化,同时激活其他肝纤维化相关受体,上调ECM蛋白的表达,因此其具有促纤维化的功能[8]。但其具体发病机制尚不明确,针对这些疾病的相应治疗也不完善。
随着CRISPR/Cas9技术的日益成熟,用于各种疾病研究的动物模型也逐渐增多。通过构建基因敲除动物模型,能够快速了解目的基因对疾病进程的作用,帮助研究者明确其作用机制,以此找到有效方法来预防和治疗疾病。为进一步研究BMP9对肝纤维化的影响,本研究以CRISPR/Cas9技术为基础,构建BMP9基因敲除小鼠。
1 材料与方法
1.1 材料
1.1.1 实验动物
6周龄SPF级C57BL/6小鼠,体重20~22 g,由空军军医大学实验动物中心提供【SCXK(陕)2014-002】,6~8周龄ICR母鼠购于北京维通利华公司【SCXK(京)2012-0001】,均饲养于屏障设施【SYXK(陕)2014-001】中。
1.1.2 试剂与仪器
sgRNA体外转录试剂盒及纯化试剂盒购自Ambion公司。Cas9 mRNA购自南通百奥迈科公司。DNTPs和Taq酶购自Takara公司。BMP9抗体购自Proteintech公司。pX330质粒由北京艾德摩公司提供。PCR产物纯化试剂盒购自天根生物公司。小鼠基因组DNA提取试剂盒由福际生物公司提供。
1.2 方法
1.2.1 sgRNA重组质粒的构建
根据Genbank报道的Bmp9基因序列,确定Bmp9基因敲除的靶位点。应用http://crispr.mit.edu 网站分析并设计20 bp的sgRNA序列,再根据选择的sgRNA序列,合成一对序列互补的DNA Oligos。将Oligos退火后以T4连接酶连接到带有T7启动子的pX330质粒载体上,构建含有sgRNA的重组质粒。
1.2.2 体外转录
上述质粒和pX330为模板,通过PCR反应扩增sgRNA序列,PCR产物纯化后进行体外转录。转录按文献报道进行[9],转录产物纯化后于-80℃保存备用。
1.2.3 显微注射及胚胎移植
6周龄C57BL/6雌性小鼠超数排卵后与雄鼠合笼,挑选见栓雌鼠,剖开腹腔,在输卵管壶腹部收集受精卵细胞。将转录好sgRNA和Cas9以2∶1混合,运用Eppendorf NK2 显微注射仪将混合物直接注射入受精卵细胞中,于5% CO2、37℃培养箱中培养24 h,挑选成活受精卵细胞移植入假孕ICR母鼠输卵管中。
1.2.4 基因型鉴定和纯合子的筛选
待首建鼠发育至1周时,剪取鼠尾,加入裂解液后,通过试剂盒提取基因组DNA,以此作为PCR模板,进行基因突变鉴定。将突变的首建鼠与野生型C57BL/6交配,得F1代杂合子,F1代互交即可筛选出F2代纯合子。
1.2.5 BMP9在肝组织中的表达
(1)Western Blot
处死小鼠后取肝组织,加入RIPA裂解液后匀浆,提取总蛋白。蛋白定量后,加入RIPA裂解液和5×上样缓冲液配成样品,90℃水浴10 min使蛋白变性,通过聚丙烯酰胺凝胶电泳后,转膜至PVDF膜上,封闭2 h,一抗为BMP9抗体,稀释比例为1∶500,4℃过夜孵育,二抗为山羊抗兔工作液,稀释比例1∶4000,室温孵育2 h,ECL发光,成像分析。
(2)qPCR
处死小鼠后取肝组织,加入TRIzol匀浆裂解,提取组织RNA,反转录为cDNA后,通过BMP9特异性引物进行qPCR检测。扩增反应条件:95℃ 10 min,95℃ 15 s,60℃ 30 s,40 个循环。数据分析采用 2-△△CT值计算目的基因相对表达量,其中各组织中Bmp9表达量以心脏为对照,敲除小鼠体内Bmp9表达量以野生型小鼠为对照。
(3)免疫组化
处死小鼠后取肝组织,使用4%多聚甲醛固定,24 h后石蜡包埋,切片。通过免疫组化检测BMP9表达。一抗为BMP9抗体,1∶200的比例稀释;二抗为山羊抗兔工作液。
2 结果
2.1 构建质粒及体外转录
参照Genbank报道的Bmp9序列,利用http://crispr.mit.edu网站设计针对Bmp9基因第1外显子的一段sgRNA序列,Bmp9-上游引物:5’-CACCgtgtacaagtcgatcatgtac-3’;Bmp9-下游引物:5’-AAACgtacatgatcgacttgtacac-3’。sgRNA序列两端引入Bbs I酶切位点后交由公司合成两端互补序列。合成的sgRNA退火后克隆入pX330质粒。以此为模板,通过PCR大量扩增sgRNA,纯化后的sgRNA,在T7启动子的介导下进行体外转录,转录产物经过琼脂糖凝胶电泳检测为单一条带,得到大小约为112 bp的PCR产物(见图1)。通过紫外分光光度计检测,得出OD260/230=2.3,OD260/280=1.9。
2.2 基因型鉴定
Cas9和sgRNA转录产物显微注射入供体受精卵细胞后,将其移植到假孕受体母鼠体内,分娩得到F0代小鼠。F0代动物经过提取鼠尾DNA测序后,结果显示存在两种基因型的突变小鼠,一种为13 bp缺失并伴有1 bp插入突变(见图2A),另一种为5 bp缺失突变(见图2B)。F0代小鼠与野生型小鼠交配获得F1代杂合子,杂合子再经过互交筛选得到F2代纯合子。
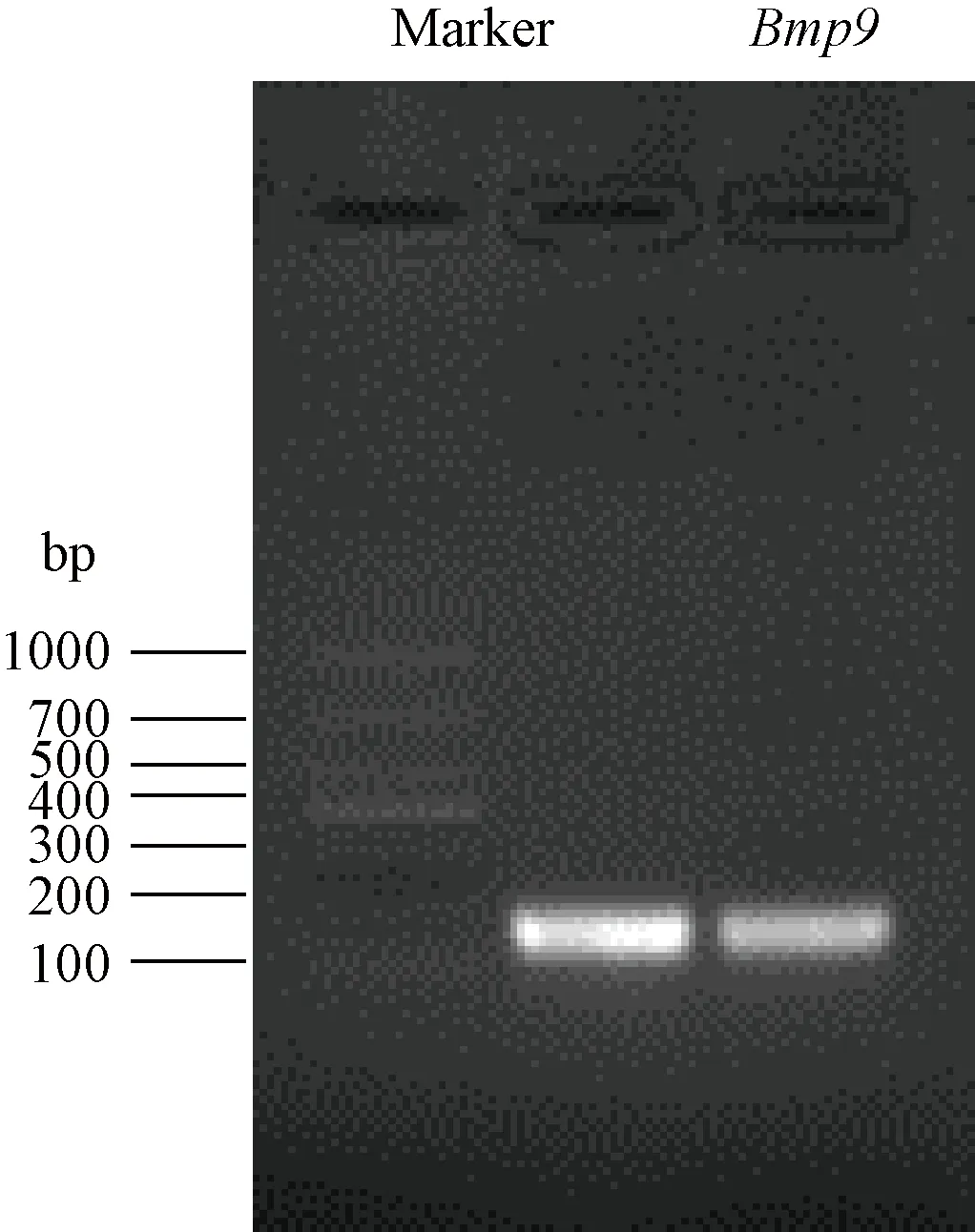
图1 sgRNA转录产物Figure 1 Transcription products of sgRNA
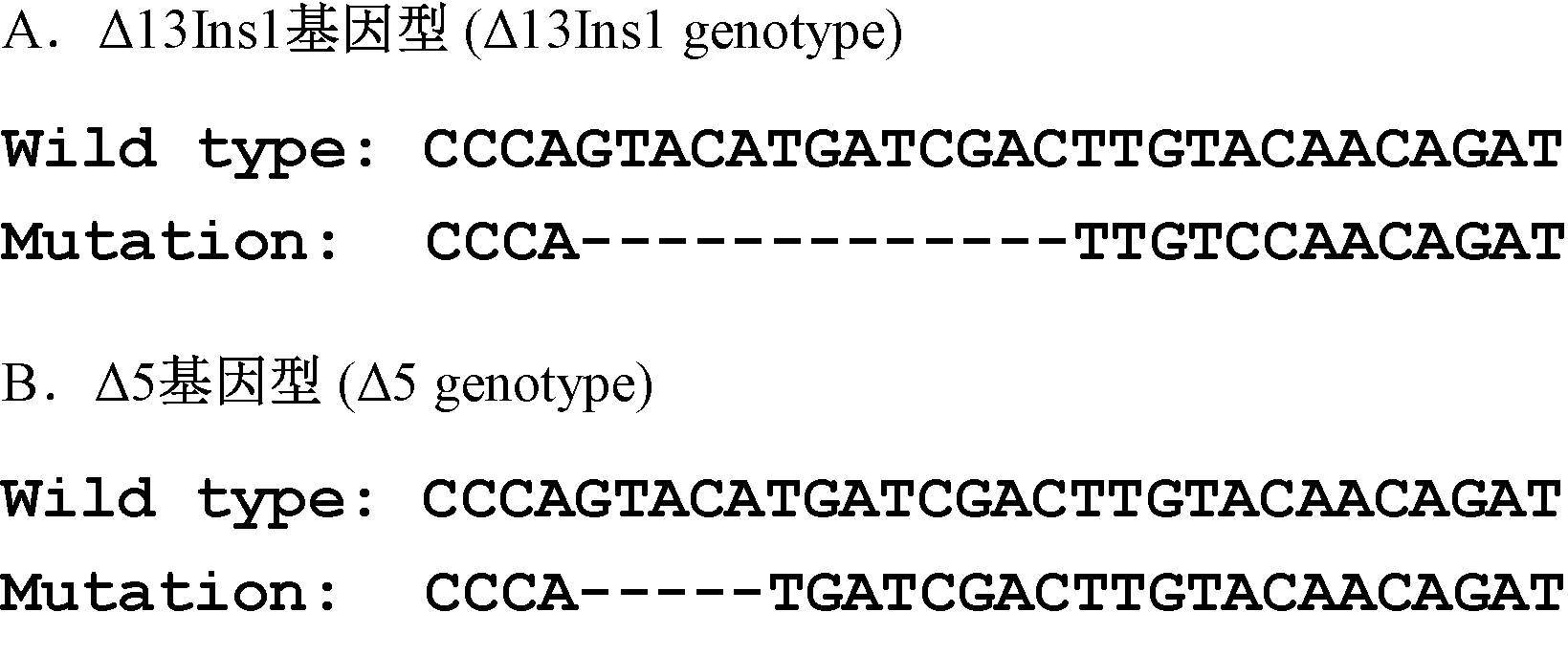
图2 Bmp9基因敲除小鼠的基因型Figure 2 Genotype of the Bmp9 knockout mice
2.3 BMP9在敲除小鼠肝组织中的表达
2.3.1 BMP9 mRNA和蛋白在敲除小鼠中的表达
为了准确研究BMP9功能,我们首先检测野生型小鼠心脏、肝、脾、肺、肾等主要脏器中BMP9 mRNA的表达水平。结果发现BMP9主要在小鼠肝脏表达,其他脏器表达很低或不表达(图3),这与文献报道一致[2]。因此在敲除小鼠表型鉴定中,我们只提取敲除小鼠肝脏的mRNA和蛋白进行分析,以BMP9特异性引物(上游引物序列为5’-CCACCCCAGTACATGATCGAC-3’;下游引物序列为5’-GGATGTGCTTCTGAAAGGGGA-3’。)通过qPCR检测后发现小鼠肝脏中mRNA几乎不表达,Western blot也证明BMP9蛋白表达水平很低(图4、5)。这些结果表明BMP9已成功敲除。
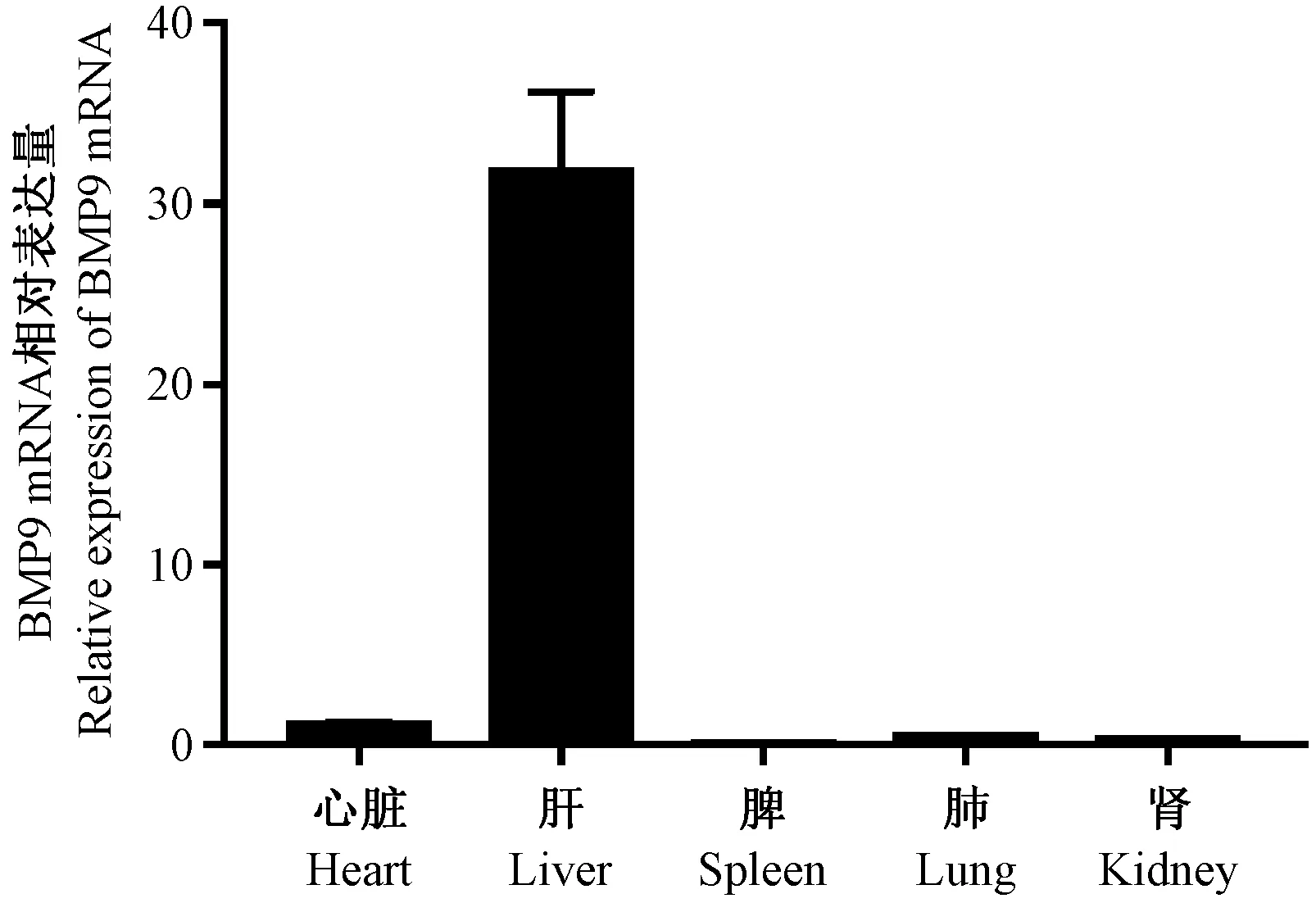
图3 qPCR检测BMP9在野生型小鼠各脏器中的表达Figure 3 Expression of BMP9 in different organs of wide-type mice detected by qPCR
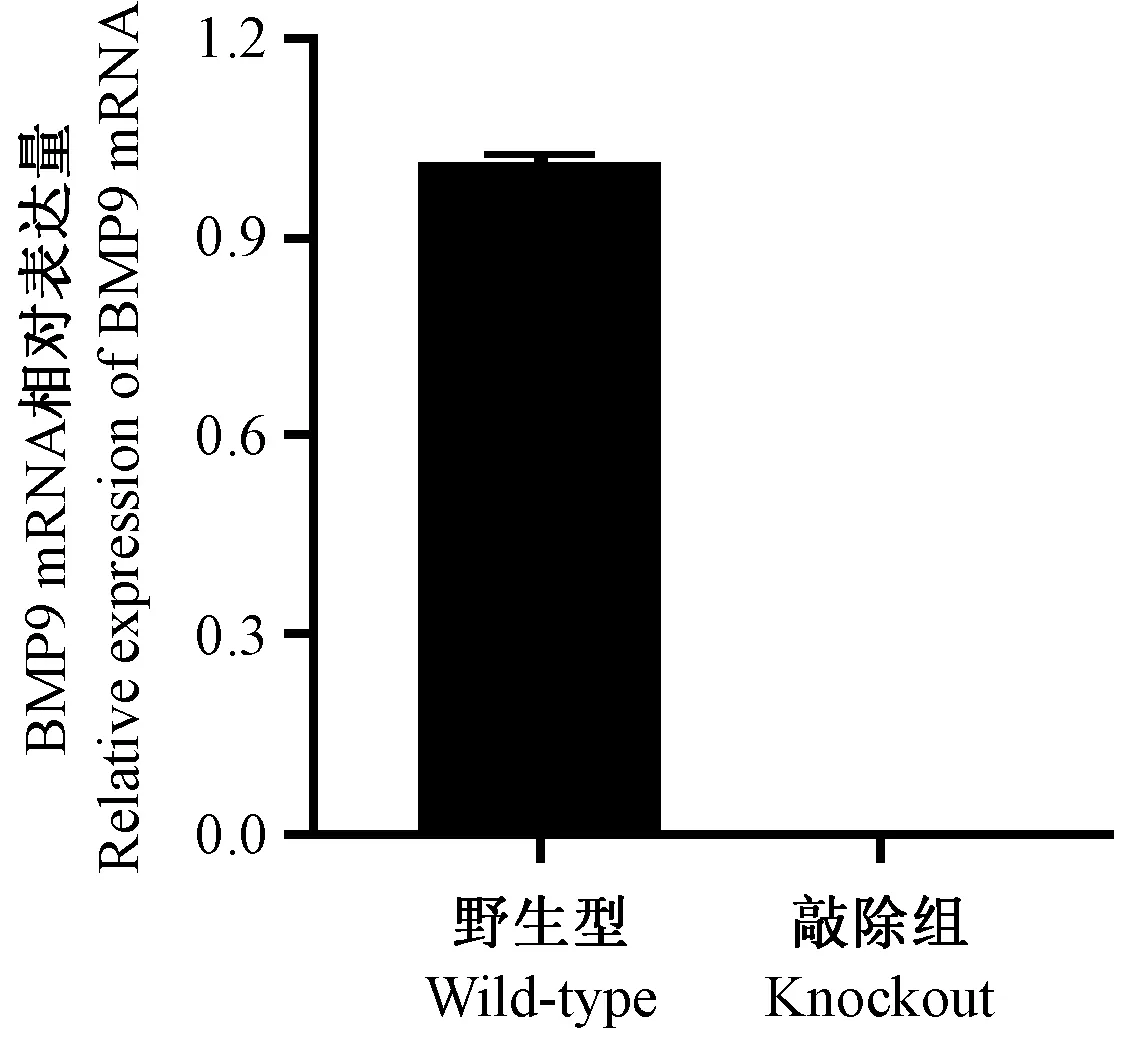
图4 qPCR检测BMP9在肝组织中的表达Figure 4 Expression of BMP9 in the liver detected by qPCR
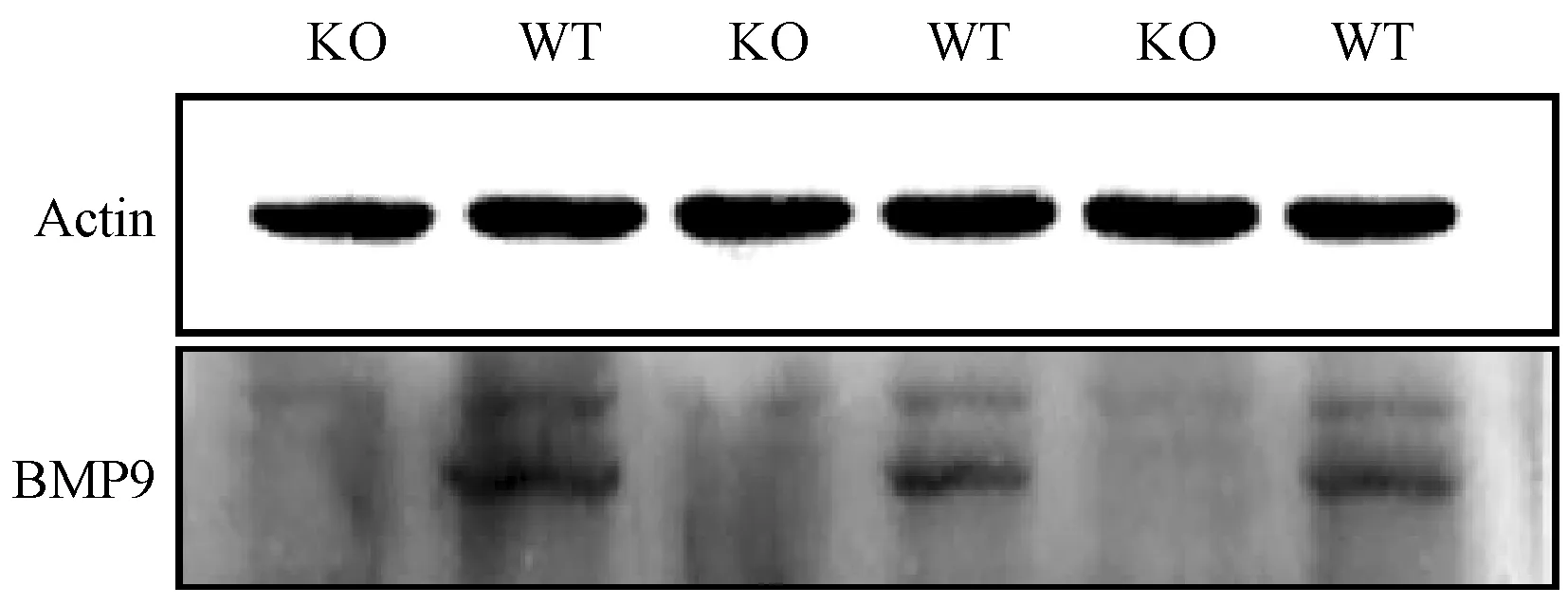
图5 Western blot检测BMP9在肝中的表达Figure 5 Expression of BMP9 in the liver detected by Western blot
2.3.2 免疫组化
取F2代小鼠肝组织,在 4%多聚甲醛中固定,24 h后石蜡包埋,切片,进行免疫组化。结果显示(见图6)与野生型C57BL/6相比,BMP9在基因敲除小鼠肝组织中的表达量显著下降。
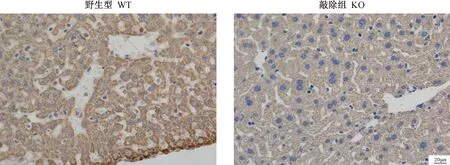
图6 免疫组化检测BMP9在肝中的表达(×40)Figure 6 Expression of BMP9 in the liver detected by immunohistochemistry(×40)
3 讨论
CRISPR/Cas(Clustered regularly interspaced short palindromic repeats/CRISPR-associated proteins)系统是一种原核生物的免疫系统,CRISPR被称为“规律间隔成簇短回文重复序列”,是在一些细菌基因组内存在的一系列成簇排列的DNA序列,这些重复序列和很多能够侵入细菌的噬菌体的DNA序列相同。研究者发现,噬菌体病毒或外源质粒入侵细菌时,CRISPR/Cas系统能够识别这些外源DNA,这些序列在被转录成为RNA后,能够和细菌产生的CRISPR关联蛋白形成复合体,对Cas9蛋白起到导向作用,因此这段RNA也被称为导向RNA(gRNA)。当复合体检测到入侵的DNA和gRNA序列一致时,Cas9蛋白就能够切割入侵的DNA,达到防御的目的。以此为基础衍生的CRISPR/Cas9基因编辑系统在基因治疗、动物模型等领域显现出良好的应用前景,与传统基因打靶技术相比,CRISPR/Cas9系统具有操作简单、效率高等优点,目前应用CRISPR/Cas9技术可实现基因敲除、基因敲入等,是构建基因修饰动物的重要工具。本研究我们针对Bmp9外显子设计20 bp的sgRNA序列,体外转录后可介导Cas9在靶向区域定向切割,引起Bmp9基因读码框位移,从而导致BMP9蛋白表达水平改变,证明CRISPR/Cas9基因编辑是构建基因敲除动物良好工具。
根据文献报道,BMP9可以与ALK1、BMPRⅡ、内皮素等结合,抑制内皮细胞,激活BMP相关信号通路,从而参与多种生理活动[10]。BMP9早期的研究主要集中在血管生成领域,如肺动脉高压、遗传性出血性毛细血管扩张症。随着对BMP9了解的深入,研究者发现其在肿瘤、肝、神经系统等方面都有着一定的影响,Maegdefrau等[11]通过RT-PCR 检测发现BMP9在肝细胞性肝癌Hep3B和PLC/PRF/5细胞中高表达,Herrera 等[12]发现BMP9可以促进肝癌细胞增殖,激活Smad1/5/8磷酸化。这提示我们Bmp9基因敲除后,可能会改善肝疾病进程,因此通过敲除Bmp9基因构建肝疾病模型,能够为后续研究提供良好的研究条件。
——一道江苏高考题的奥秘解读和拓展

