心肌组织特异性Isca1敲除造成新生大鼠心脏结构异常
杨辛兰,吕丹,张旭,董伟,陈炜,高珊,高凯,史旭东,马元武,3,张连峰,3*
(1. 中国医学科学院医学实验动物研究所,北京协和医学院比较医学中心,国家卫生健康委员会人类疾病比较医学重点实验室,北京 100021; 2. 中国医学科学院医学实验动物研究所,北京协和医学院比较医学中心,北京市人类重大疾病实验动物模型工程技术研究中心,北京 100021;3. 中国医学科学院神经科学中心, 北京 100730)
铁硫簇(iron-sulfur cluster,ISC)基本结构单元有[2Fe-2S]、[3Fe-4S]、[4Fe-4S]及[8Fe-7S]等几种形式,是存在于TCA循环中的顺乌头酸酶和延胡索酸酶及线粒体呼吸链复合物等部位的生物体内最古老的物质之一[1]。铁硫簇最重要的生物学功能是作为电子传递蛋白的辅助基团参与能量转移。铁硫簇生物合成过程需要IBA57(iron-sulfur cluster assembly)、NFU1(iron-sulfur cluster scaffold)、ISCA1(iron-sulfur cluster assembly 1)等蛋白共同参与完成[2-3]。研究表明,IBA57基因缺陷的纯合子在婴儿出生之前出现明显的代谢综合征,出生早期致命,表现为肌张力减退、呼吸功能不全、高血糖、先天性头小畸形和脑畸形等症状[4-5];NFU1基因缺陷的婴儿从出生第一天起就出现进食困难、肌肉无力、呼吸功能不全、嗜睡和缺乏反应能力,并在出生第1个月内死亡[6-7]。ISCA1是[Fe/S]的转运蛋白,在支架蛋白的介导下,传递[Fe/S]到呼吸链蛋白,并调节呼吸链蛋白等铁硫簇[4Fe-4S]蛋白的成熟[8]。Isca1是最近几年发现的多发性线粒体功能障碍综合征(MMDS)的致病基因,目前研究发现Isca1在线粒体和胞质铁硫簇生物合成过程中起着重要作用[9],尤其与铁硫簇生物合成过程中Fe4S4的成熟密切相关[10],但是目前对Isca1体内致病机制的研究很少,尤其是该基因缺失对心脏的功能研究尚属空白。我们的前期研究已经发现Isca1基因全身敲除是致死的,并进一步建立了Isca1Flox大鼠,本研究利用心肌特异的Cre大鼠(MHC-Cre)[11]与Isca1Flox大鼠杂交,产生了心肌组织特异性Isca1敲除大鼠,分析Isca1敲除导致的心脏病的病理变化。
1 材料与方法
1.1 材料
1.1.1 实验动物
心肌组织特异性Isca1敲除大鼠由中国医学科学院医学实验动物研究所基因工程平台培育。Isca1Flox大鼠繁育过程所需的8周龄SPF级SD大鼠购自北京维通利华实验动物技术有限公司【SCXK(京)2012-001】。大鼠均饲养于中国医学科学院医学实验动物研究所屏障环境动物房【SYXK(京)2014-0029】,饲养间温度(23 ± 2)℃,12/12 h明暗交替照明,动物自由饮水及采食。动物实验中涉及动物的操作程序已经得到中国医学科学院医学实验动物研究所实验动物使用与管理委员会(IACUC)的批准,批准号为ZLF18003。
1.1.2 主要试剂和仪器
PCR引物由英潍捷基(上海)贸易有限公司合成;4%甲醛溶液购自北京益利精细化学品有限公司;电镜专用固定液由北京交通大学电镜室提供;DNA提取试剂盒(EE101-02)购自北京全式金生物技术有限公司;琼脂糖购自西班牙Biowest Agarose公司;凝胶电泳仪购自美国伯乐公司;组织脱水机、石蜡包埋机、石蜡切片机购自德国徕卡公司;PCR仪购自Eppendorf公司、55℃摇床购自日本Taitec公司;气体麻醉机购自英国斯特普科技有限公司;7.0 T/160 mm磁共振仪购自美国Varian公司;透射电镜购自日本电子(JEOL)。
1.2 方法
1.2.1 基因组DNA提取
繁育心肌组织特异性Isca1敲除大鼠,在幼崽出生后剪脚趾标记,收集幼崽脚趾至1.5 mL EP管。加入100 μL LB2和20 μL proteinase K,55℃摇床孵育至完全裂解后参照说明书进行DNA提取步骤,最后12 000 r/min 离心2 min,洗脱DNA,收集到干净离心管中,保存至4℃冰箱。
1.2.2 聚合酶链反应(polymerase chain reaction, PCR)鉴定心肌组织特异性Isca1敲除大鼠的基因型
根据样品数量配制所需的PCR反应体系,包括双蒸水、DNA聚合酶、引物、dNTP、DNA模板等,将样品加入PCR反应体系,并设置阴性对照和阳性对照,混合均匀后置于PCR仪。本实验共使用两对引物,ISCA1-LOXP上游引物序列为5’ATGGTTCCAGCACTTTGAAGG;下游引物序列为5’AAGCTAATATGACAGTGGTGAGGC。反应条件为:95℃预变性15 min,95℃变性30 s,59℃退火30 s,72℃延伸2 min,30个循环;反应体系为20 μL,片段大小为WT 1333 bp,KI1401 bp;Cre上游引物序列为:5’AACATGCTTCATCGTCGGTC;下游引物序列为5’GTGCCTTCTCTACACCTGCG。反应条件为:94℃预变性3 min;94℃变性30 s;59℃退火30 s;72℃延伸30 min,反应体系为20 μL,片段大小为352 bp。使用2%的琼脂糖凝胶进行电泳。
1.2.3 磁共振成像技术(magnetic resonance imaging,MRI)

注:A,心肌组织特异性Isca1敲除大鼠基因型鉴定。B,心肌组织特异性Isca1敲除大鼠敲除效率鉴定。图1 心肌组织特异性Isca1敲除大鼠基因型及敲除效率鉴定Note. A. Genotyping identification of Isca1 myocardial conditional knockout rats. B. Identification of knockout efficiency of Isca1 myocardial conditional knockout rats.Figure 1 Genotyping and knockout efficiency of Isca1 myocardial conditional knockout rats
扫描前采用1.5%~2%异戊烷和氧气气体对大鼠进行吸入麻醉。当大鼠完全麻醉后,将大鼠俯卧位固定于扫描床上,采用体线圈发射和采集数据,并且使大鼠胸部对准线圈中心。利用生理参数监护系统实时监控大鼠的呼吸和心电图(EGG),并且利用呼吸、EGG门控触发采集信号。同时利用热风使动物体温保持(37 ± 1)℃。利用Varian 7.0 T/160 mm磁共振仪进行心脏电影(CINE)扫描,采集MRI信号,获取大鼠四腔心图像[12]。
1.2.4 苏木精-伊红(hematoxylin-eosin staining,H&E)染色
H&E染色包括取材与固定、脱水透明、浸蜡包埋、切片与贴片、脱蜡染色、脱水透明、封固等操作。具体步骤为:2%戊巴比妥钠腹腔注射麻醉大鼠后,打开胸腔迅速取出心脏,置于在生理盐水除血后投入4%甲醛中固定48 h;脱水剂脱水后的组织经智能石蜡包埋机包埋制成蜡块,推拉式切片机常规切片(切片厚度4 μm),恒温石蜡烤箱烤干后入全自动染色机染色,全自动封片机封片。
1.2.5 透射电镜(transmission electron microscopy,TEM)观察
2%戊巴比妥钠腹腔注射麻醉大鼠后,打开胸腔取出心脏,摘取心肌组织固定于2.5%戊二醛(使用0.2 M磷酸缓冲液配制,pH=7.4)固定液中,1%锇酸后固定1 h,梯度乙醇脱水,环氧树脂Epon812包埋。乙酸双氧铀和柠檬酸铅染色后在透射电镜下观察,数码相机拍摄图片。
1.3 统计学分析
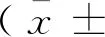
2 结果
2.1 心肌组织特异性Isca1敲除大鼠基因型及敲除效率分析
繁育实验所需心肌组织特异性Isca1敲除大鼠,剪新出生大鼠脚趾,提取鼠尾基因组和心脏组织DNA,用PCR技术进行大鼠基因型鉴定和敲除效率分析。同时具备Isca1Flox纯合与携带Cre基因的大鼠用于进一步研究(7#大鼠,简称为CKO大鼠),同窝阴性(6#,简称WT)作为对照(图1A)。
获取7.5 d CKO大鼠心脏组织,提取DNA,同日龄的WT大鼠心脏组织DNA作为对照。用PCR检测Cre的敲除效率,使用Image J灰度测量软件对残留的Isca1FloxPCR带与基因敲除带进行比较,结果显示,心脏特异敲除效率大于78%(图1B)。
2.2 0.5 d及2.5 d大鼠核磁共振分析
CKO大鼠在8~10 d全部死于心衰,为了明确心脏功能异常发生的的时间点,对0.5 d和2.5 d的CKO和WT大鼠进行了心脏结构MRI影像分析。使用异氟烷将大鼠麻醉后,将大鼠俯卧位固定于扫描床上,胸部对准线圈中心,采集MRI信号,获取大鼠四腔心图像。实验结果显示:与野生型相比,0.5 d CKO大鼠心脏未见显著异常,而2.5 d CKO大鼠已经出现心脏右室扩张趋势(图2,n=3),说明CKO心脏结构异常出现在2.5 d左右。
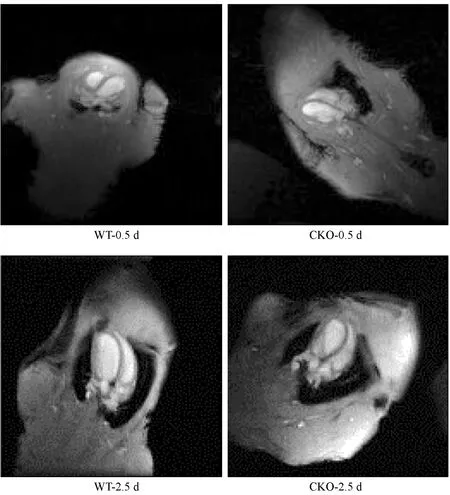
图2 2.5 d及0.5 d大鼠核磁共振分析Figure 2 MRI analysis of the 2.5 d and 0.5 d rats
2.3 2.5 d大鼠病理学分析
取2.5 d CKO和WT大鼠的心脏组织,进行常规固定和制作石蜡切片,并进行H&E染色分析。结果显示,与野生型相比,CKO大鼠心肌纤维排列不齐,出现排列紊乱,无层次或极向(图3A,n=3)。
取2.5 d CKO左心室 2 mm × 2 mm大小组织,投入电镜专用固定液,并完成后续透射电镜观察,同日龄对应部位的心脏组织作为对照。结果显示,与野生型相比,敲除大鼠心肌细胞部分心肌纤维出现溶解断裂,肌节和Z线模糊,出现肌膜损伤,线粒体嵴断裂,肿胀明显(图3B,n=3)。
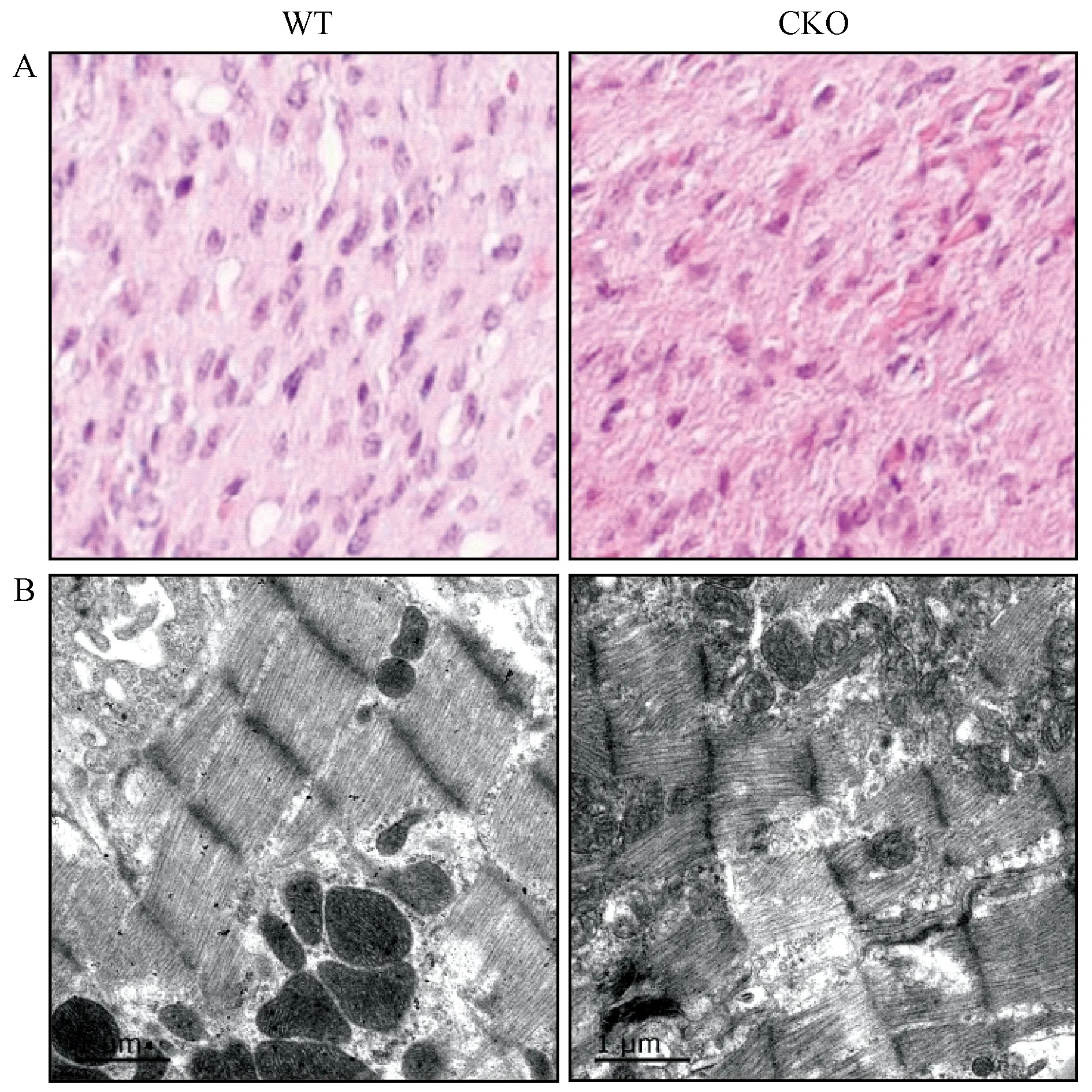
注:A. H&E染色结果(×1200); B. 透射电镜结果(×20 000)。图3 2.5 d大鼠病理学分析Note. A. Histological changes.H&E staining (×1200). B. Transmission electron microscopic results (×20 000).Figure 3 Pathological analysis of myocardial tissues of the 2.5 d rats
3 讨论
铁硫簇是线粒体呼吸链复合物Ⅰ、Ⅲ、Ⅳ等组成蛋白的重要组成部分和发挥功能的必须成分[13]。目前研究认为,铁硫簇形成过程中需要大量蛋白的共同作用,包括NFS1(nitrogen fixation 1 homolog)[14]结合主要支架蛋白ISCU及调节蛋白FXN(frataxin)、ISD11[13]并提供S、FXN控制Fe的进入,并且在ISCU(iron-sulfur cluster assembly enzyme)上形成初级铁硫簇;初级铁硫簇随后通过专有的伴侣-结合伴侣系统转移到GLRX5(glutaredoxin 5);Fe-S簇直接插入到线粒体[2Fe-2S]或通过ISCA1、ISCA2(iron-sulfur cluster assembly 2)、IBA57等特定载体系统转移到[4Fe-4S]中;NFU1、BOLA3(bolA family member 3)和NUBPL(nucleotide binding protein like)等载体蛋白将其转移至顺乌头酸酶、琥珀酸脱氢酶,继而发挥生物学功能[15]。临床发现,铁硫簇组装异常可引起多种疾病的发生发展,并且很多基因缺陷造成的疾病发病较早,如基因IBA57和NFU1的缺陷均导致婴儿早期死亡,表现为肌张力减退、呼吸功能不全、脑畸形等症状[4, 6],BOLA3基因异常造成BOLA3型多重线粒体功能障碍综合征,主要发生在中枢神经与心脏,导致胎儿于围产期死亡[16-17]。
ISCA1作为铁硫簇生物合成过程中的特定载体,已报道其在线粒体Fe4S4成熟过程中扮演着不可或缺的角色[10, 18],但是Isca1与心血管疾病关系的研究基本空白。本文利用本实验室已有的心肌组织特异性Isca1敲除大鼠模型来探究Isca1的缺失是否会导致心脏于出生后出现异常。首先进行大鼠繁育以获得一定样本量心肌组织特异性Isca1敲除大鼠,与此同时鉴定Isca1于心脏中的敲除效率,结果显示敲除效率大于78%,可用于后续实验。磁共振实验结果显示,与0.5 d WT大鼠相比,0.5 d CKO大鼠心脏暂未发现显著异常。与2.5 d WT大鼠相比,2.5 d CKO大鼠心脏右室呈扩大趋势。有报道称特发性扩张型心肌病(IDCM)以心腔扩张,心肌收缩功能降低为特征。IDCM合并右心室收缩功能显著降低,增加右心室收缩末期压力,使左、右心室压力阶差降低,导致左心室缩小,三尖瓣反流增加,形成恶性循环,最终引发心力衰竭[19-20],造成严重后果,我们的实验观察到,2.5 d大鼠较0.5 d大鼠右心室出现扩张,即心脏形态开始出现异常,因此Isca1缺失是否会使心脏形态与功能进一步恶化并引发严重后果仍需进一步研究。另外我们取2.5 d大鼠心脏组织进行H&E染色分析和透射电镜实验,结果显示显示肌纤维排列紊乱,并出现溶解断裂,肌节和Z线模糊,出现肌膜损伤,线粒体嵴断裂,肿胀明显,提示线粒体异常,线粒体功能可能出现紊乱,进而导致能量代谢出现障碍,影响正常生命活动,最终引发心衰。
综上所述,ISCA1作为铁硫簇生物合成过程中的特定载体,其基因的敲除造成新生大鼠心脏结构异常和功能障碍,对正常生命活动造成不良影响。本研究为心血管疾病相关基因研究工作提供了新的线索,Isca1对心脏及其他高耗能器官的影响需进一步研究。

