MicroRNA-182靶向抑制TLR4后减轻缺氧诱导的小胶质细胞炎症反应
汪继 赵浩 陈秀芬 肖宗宇 朱健伟 陈文锦 张丽 徐如祥
小胶质细胞是中枢神经系统的主要内在免疫细胞,在中枢神经系统受到损伤时发挥主要的免疫效应[1]。脑缺血后产生的炎症反应主要以小胶质细胞的激活以及炎症因子的释放为特征,而小胶质细胞过度产生炎症因子会加速神经元细胞的死亡[2,3]。近些年,microRNAs(miRNAs)在中枢神经系统疾病中的作用引起了广泛的关注,其不仅在胶质瘤中起重要作用,而且参与调控神经损伤性疾病的神经保护。miRNAs 是一类长度为19~25 个碱基的非编码RNA,主要结合mRNA 的非翻译区,下调或者抑制mRNA 的转录与翻译。近期有研究表明miRNAs 表达的改变与缺血性脑损伤有关,其中microRNA-182(miR-182)在脑缺血性损伤中发挥神经保护性作用,但具体的调节机制尚不清楚[4-6]。本文通过生物信息分析发现 (http://www.targetscan.org/),Toll样体4(toll-like receptor 4, TLR4)可能是miR-182 的一个调节靶点。TLR4 是Toll 样受体分子家族中的一种,作为一种跨膜受体,在先天性免疫反应中发挥重要的信号转导作用,在调节神经炎症方面也很重要[7]。中枢神经系统中,TLR4 主要在小胶质细胞上表达,而有研究表明小胶质细胞活性的抑制能产生神经保护效应[8]。因此miR-182 是否可以通过下调TLR4 的表达来减轻小胶质细胞激活后的炎症反应,目前尚未研究。本研究通过荧光素酶实验证实TLR4 是miR-182的直接靶点,miR-182 可通过抑制TLR4 的表达来减轻小胶质细胞的炎症反应,从而为缺血缺氧性脑损伤提供潜在的治疗靶点。
材料与方法
一、实验试剂及仪器
小胶质细胞(BV2 细胞)、HEK293 细胞(购自国家细胞资源库);miR-182 mimics 和Negative Control(NC)、小干扰TLR4 RNA(siTLR4)和siTLR4 NC(上海吉玛制药技术有限公司);TLR4(ORF)过表达和空载(vector)质粒(上海吉凯基因化学技术有限公司);Lipofectamine 2000、TRIzol (Invitrogen 公司,美国); 炎症因子 (TNF-α、IL-6、IL-1β)ELISA 试剂盒(武汉博士德生物工程有限公司);TLR4 抗体、GAPDH 抗体 (Abcam公司,美国);qPCR SYBR Green (南京诺唯赞生物科技有限公司); 引物合成(上海生工生物工程股份有限公司);DMEM 培养基、胎牛血清、Hank’s 液(Gibco 公司,美国)。
二、细胞培养与转染
BV2、HEK293细胞用含10%胎牛血清的DMEM培养于37℃、5%CO2的培养箱中,当细胞融合90%时用0.05%的胰酶消化进行1∶3 传代。
转染时,将细胞培养于六孔板中,当细胞融合达60%~70%,利用转染试剂Lipofectamine 2000 进行BV2 细胞的miR-182 mimics 和miR-182 mimics NC(即miR-182组和miR-182 NC 组)、siTLR4 和siTLR4 NC(即siTLR4 组和siTLR4 NC 组)以及TLR4(ORF)过表达质粒和TLR4 vector 质粒[即TLR4(ORF)组和TLR4 vector 组]的转染,24 h 后换液,继续培养24 h 后收获细胞进行后续功能实验;Control 组未进行任何转染。
三、氧糖剥夺实验
采用氧糖剥夺实验(oxygen-glucose deprivation,OGD)模拟细胞体外缺糖缺氧的环境。将细胞培养于正常的环境中,然后去除培养基,用无菌磷酸盐缓冲液(phosphate buffered saline,PBS)洗2~3 遍,加入Hank’s液,同时将细胞转入低氧培养箱 (5%CO2,2%O2,93%N2,37℃)培养6 h,后转入普通培养箱继续培养12 h,收获细胞进行后续实验,Control 组未进行OGD 处理。
四、Western blot检测
将培养皿中的细胞刮下后用PBS 洗2 遍,然后加入适量的细胞蛋白提取液,冰上裂解约30 min后,通过BCA 蛋白定量试剂盒定量蛋白浓度后,按1∶4 加入5×loading buffer 95℃煮约5~10 min。按每孔30 mg 蛋白总量在10%凝胶中进行蛋白电泳,将凝胶中的蛋白通过恒流转到PVDF 膜上,转膜完毕后用5%的BSA 封闭约1 h,之后加入一抗4℃孵育过夜,次日取出用TBST 洗5 min,洗3 次,加入相应种属的二抗室温孵育1 h 后,继续用TBST 洗5 min,洗3 次,最后通过显影剂在曝光仪中曝光显影。
五、RNA提取及荧光RT-PCR实验
将细胞培养基洗净后加入适量TRIzol (一个六孔板约1 mL),室温裂解约10 min,然后加入200 μL氯仿后震荡30 s,室温孵育3 min,进行4℃12 000 g离心20 min,看到分成3 层,小心吸出最上水相层,加入适量异丙醇震荡室温孵育10 min,进行4℃12 000 g 离心10 min,弃上清加入1 mL 75%乙醇清洗,自然晾干后加入无RNA 水溶解RNA。将提取的RNA 先进行反转录(TAKARA 试剂盒)得到cDNA,然后加入miR-182、TLR4 以及炎症因子(TNF-α、IL-6、IL-1β) 引物及带有荧光染料的酶和原料的混合物等进行RT-PCR 反应,通过得到的循环值(cycle threshold, CT)来计算RNA 的相对量。
六、荧光素酶基因测定
合成一段带有荧光素酶的TLR4 野生型(wild type,WT)及突变型(mutant,MUT)的质粒,分别与miR-182 mimics 一起进行BV2 细胞以及HEK293细胞转染,然后加入荧光素酶钾盐,通过酶标仪检测荧光强度,代表miR-182 与其碱基匹配程度。
七、酶联免疫吸附实验
将细胞培养上清取出后离心去除细胞碎片后加入预包被抗体的孔中,按照说明书进行操作,最后通过酶标仪读出OD 值,与标准曲线进行比对后计算出相对蛋白浓度。
八、统计学分析
采用SPSS22.0 软件进行统计学分析,miR-182、TLR4 mRNA 相对表达量、TLR4 蛋白灰度数值以及TNF-α、IL-1β、IL-6 蛋白浓度数值以均数±标准差(±s)表示,组间样本的比较采用两样本的t 检验。P<0.05为差异具有统计学意义。
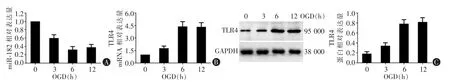
图1 OGD 处理不同时间后小胶质细胞miR-182、TLR4 mRNA 和蛋白相对表达量
结果
一、小胶质细胞在OGD诱导下miR-182和TLR4的表达
通过测定OGD 诱导后小胶质细胞TLR4 及miR-182 的表达量,结果显示:与0 h(未经OGD 处理)比较,处理3、6、12 h 后TLR4 的蛋白及mRNA表达量明显增加,而6 h 与12 h 时的TLR4 表达量比较无明显差异; 另外与0 h 比较,BV2 细胞中miR-182 相对表达量明显下降(图1)。
二、荧光素酶基因报告结果
在HEK293 和BV2 细胞中,TLR4 野生型(WT)与miR-182 mimics 共转染后较与miR-182 NC 共转染,荧光素表达强度明显降低,差异具有统计学意义(P<0.05),而TLR4 突变型(MUT)与miR-182 mimics共转染后较与miR-182 NC 共转染,荧光素表达强度无明显差异(图2)。
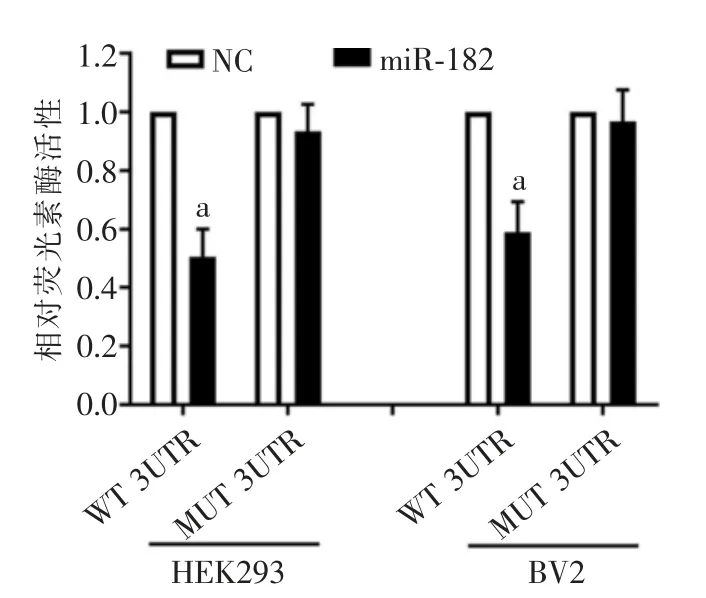
图2 荧光素酶基因测定报告结果
三、小胶质细胞中过表达miR-182 后检测TLR4的表达
通过检测显示转染miR-182 mimics 组BV2 细胞中的miR-182 明显高于NC 组,差异具有统计学意义(P<0.05)。转染后24 h,经OGD 处理6 h,通过RT-PCR 及Western blot 检测转染后TLR4 水平,发现较NC 组,miR-182 mimics 组的TLR4 mRNA 及蛋白水平明显降低,差异具有统计学意义(P<0.05)(图3)。
Western blot 检测结果发现同时转染miR-182和TLR4 (ORF) 质粒,TLR4 的表达量较转染miR-182 和TLR4 vector 组明显升高,差异具有统计学意义(P<0.05),而较转染miR-182 NC 和TLR4 vector组无明显差异(图4)。
四、小胶质细胞中同时过表达miR-182 和TLR4(ORF)后检测炎症因子的表达
通过检测炎症因子(TNF-α、IL-6、IL-1β)的表达发现,与Control 比较,miR-182组显著降低炎症因子的释放,差异具有统计学意义(P<0.05)。同时,通过RT-PCR 检测发现,与Control 比较,在同时转入miR-182 及TLR4 时,炎症因子水平无明显改变,而转入siTLR4 时,炎症因子水平显著下降且差异具有统计学意义(P<0.05)(图5)。
讨论
缺血缺氧性脑损伤是导致高死亡率及高致残率的疾病之一,至今仍无有效且安全的治疗方法,所以亟需探索新的安全高效的治疗手段。神经元细胞的死亡是各种中枢神经系统疾病发生的基础,而导致神经元细胞死亡的机制有很多,如能量代谢的不足、细胞内Ca+超载、线粒体损伤以及炎症反应等等,其中炎症反应是最突出的[9]。中枢神经系统中主要的免疫细胞是小胶质细胞,其过度激活释放炎症介质会加速神经元的死亡,所以控制过激的炎症反应是保护神经元细胞的有效策略[3]。TLRs 在先天免疫应答中起重要作用[10]。TLR4 主要在中枢神经系统的小胶质细胞和全身的免疫细胞上表达,而且很多的研究已经证实TLR4 在炎症反应中起重要作用[11]。在缺氧激活的小胶质细胞中,TLR4 介导神经炎症过程[12]。因此,缺氧性脑损伤激活的小胶质细胞中的TLR4 是一个潜在的治疗靶点。作为特异性脑miRNA,miR-182 在无脊椎动物和脊椎动物之间是保守的,并且是成人和胚胎脑中最丰富的miRNA 之一[13]。有研究报道,miR-182 在肝脏以及心脏缺血再灌注方面有重要作用,而且最近发现miR-182 在脑缺血再灌注方面同样发挥着积极的作用,但具体的分子机制尚不清楚[14-16]。

图3 小胶质细胞转染miR-182 后TLR4 的表达情况

图4 小胶质细胞转染siTLR4、TLR4 过表达质粒后TLR4 表达情况

图5 小胶质细胞的炎症因子表达水平
在本研究中,笔者首先证实在缺氧的情况下,miR-182 可以激活小胶质细胞,随着OGD 的诱导,miR-182 的表达呈下降趋势而TLR4 的表达呈上升趋势,表明miR-182 与TLR4 可能有相互关系,而随后的荧光素酶基因测定实验证实TLR4 是miR-182的直接靶点。而后笔者通过过表达miR-182 发现TLR4 的表达下降,过表达TLR4 的开放阅读框及miR-182 发现TLR4 的表达增强,说明miR-182 与TLR4 是一种负向的调节关系,miR-182 结合到TLR4 mRNA 上的3’UTR 来调节TLR4 的转录与翻译过程。最后笔者通过过表达miR-182 后检测促炎因子的表达,发现表达降低,同时过表达TLR4 的开放阅读框及miR-182 时促炎因子水平并不降低,所以结果表明miR-182 下调TLR4 的转录与翻译,从而减轻下游炎症因子的表达。通过本研究结果可以发现,miR-182 可以调节TLR4 介导的炎症反应,而作为脑组织特异表达的miRNAs 之一,其在脑疾病的炎症反应中可以发挥重要作用。miRNAs 作为小分子物质可以更容易输送到受损伤的脑组织中去,更加直接地结合到所需要的靶点上发挥作用。通过miRNAs 来降低特定疾病相关靶基因的蛋白水平是一种新的治疗策略。
综上所述,本研究确定了miR-182-TLR4 途径的相互作用,其部分地解释了小胶质细胞介导的神经炎症的机制。研究结果暗示,miR-182 对脑缺血-再灌注损伤可能具有保护作用,这可能归因于miR-182-TLR4 途径的抑制和随后的炎症反应的减弱。此外,本研究数据表明miR-182 可能是治疗脑缺血再灌注损伤的潜在候选分子,同时可能包括其他的缺血再灌注疾病治疗。然而,miR-182 能否有效改善患者的临床结果还需要进一步研究。

