基于蛋白组学探讨石斛合剂对糖尿病大鼠的作用机制
林心君,秦崇涛,陈 勇,施 红
(福建中医药大学中西医结合学院,福建 福州 350122)
糖尿病是以慢性高血糖为其主要特征的代谢性疾病,随着其发病率的不断增加,现已成为全球广泛关注的公共健康问题。我国糖尿病患者人数全球第二,仅次于印度,其中90%以上为2型糖尿病(type 2 diabetes,T2DM)[1]。 临床上治疗 T2DM 的药物虽各具特点和优势,但仍不能满足临床治疗的需求[2-3]。中医药治疗糖尿病在我国已有数千年的历史,大量研究表明中药能多组分、多靶点地发挥治疗作用,纠正糖尿病患者机体稳态失衡,有着标本兼顾的优势[4-6]。本课题组多年来通过对T2DM的临床-基础的反复实践与修正,形成了具有滋阴益气活血功效的中药复方石斛合剂(专利申请号:201110408411.0)。该方不仅使患者烦渴、燥热、乏力等症状明显改善,甚至消失,具有稳定的降糖、调脂功效,还能改善糖尿病模型鼠的糖脂代谢,促进胰岛细胞增殖和胰岛素受体表达,促进HepG2细胞糖代谢[7-10]。糖尿病大鼠肝组织基因表达谱芯片研究发现:糖尿病大鼠与正常大鼠存在的差异基因有1 300多个,经石斛合剂治疗后近千个基因表达量恢复正常[11]。而蛋白质组学的研究是对基因组信息的进一步解读[12],相对和绝对定量同位素标记(isobarictags for relative and absolute quantitation,iTRAQ)技术能高通量筛选蛋白质,使寻找新的糖尿病药物治疗靶点逐步成为可能,在糖尿病领域具有广阔的应用前景[13-14]。我们在建立糖尿病大鼠模型的基础上利用该技术对大鼠肝脏进行蛋白组学检测和数据信息学分析,寻找糖尿病大鼠和正常大鼠间的差异蛋白,为后续研究打下基础。
1 实验材料
1.1 实验动物 40只SPF级雌性Wistar大鼠,购自上海斯莱克实验动物有限责任公司,体质量180~220 g,生产许可证号:SCXK(沪)2012-0002。饲养于福建中医药大学实验动物中心,许可证号:SYXK(闽)2009-0001,单笼 5只饲养,自由取食和饮水,12 h光照/12 h黑暗,室温25℃,相对湿度80%。基础饲料配方由动物实验中心提供,高脂饲料配方参照本课题组前期实验的高脂饲料配方[7]。
1.2 实验药物 石斛合剂1号方(石斛15 g,黄芪20 g,五味子 8 g,葛根 15 g,生地黄 15 g,丹参 15 g,知母 12 g等)、石斛合剂 2号方(茵陈 18 g,滑石15 g,扁蓄 15 g,栀子 10 g,大黄 6 g等)购自福建中医药大学国医堂。上述2方分别经浸泡、水煎、水浴锅蒸发浓缩至流浸膏,用乙醇提取,滤过,回收乙醇,加水制备成含生药量2 g/mL的滤液,每瓶100 mL分装灭菌。二甲双胍(中美上海施贵宝制药有限公司)用蒸馏水稀释至含药量5 g/L,每瓶100 mL分装。
1.3 实验试剂与仪器 链脲佐菌素(STZ,美国Sigma公司);iTRAQ试剂(美国SCIEX公司);质谱级胰蛋白酶(美国 Promega公司);Multifuge X1R型低温高速离心机(美国Thermo公司),Triple TOF 5600 质谱仪器(AB SCIEX,Concord,ON 美国SCIEX公司);LC-20AD纳升液相色谱仪(日本岛津公司)。
2 实验方法
2.1 动物模型制备 以随机数表法分为正常组10只和造模组30只。正常组给予基础饲料喂养,造模组给予高脂高糖饲料,均喂养6周。对造模组大鼠2次腹腔注射STZ(体质量<200 g的大鼠按25 mg/kg注射,体质量>200 g的大鼠联合体表面积注射,间隔3 d)。5 d后,尾静脉取血测血糖,选取连续2天FBG>7.0 mmol/L或 PBG>16.7 mmol/L者为糖尿病模型大鼠,本次造模大鼠全部成模。
2.2 分组和干预 取成模大鼠30只,采用随机数表法分为模型组、石斛合剂组、二甲双胍组各10只。石斛合剂组先以石斛合剂1号方按17.2 g/(kg·d)灌胃 7 d,继以石斛合剂 2 号方按 12.4 g/(kg·d)灌胃3 d,如此循环灌胃;二甲双胍组以二甲双胍按100 mg/(kg·d) 灌胃;模型组、正常组用等量生理盐水灌胃,每日上午9时灌胃,持续60 d。
2.3 动物取材 于末次用药24 h后进行动物取材,称量大鼠体质量后以10%乌拉坦麻醉,迅速开腹,取肝组织置于液氮中储存以行蛋白组学检测。每组取3只大鼠,剩余大鼠用于课题组其他实验。
2.4 iTRAQ检测肝组织蛋白质组学
2.4.1 蛋白质提取和浓度定量 用蛋白裂解液溶解肝脏蛋白质样品,继而还原打开二硫键,以便充分酶解蛋白。采用Bradford法对蛋白进行浓度定量,并依据标准曲线计算出样品浓度。
2.4.2 蛋白质酶解和iTRAQ标记 每个样品取100 μg蛋白置于离心管中酶解,并按照iTRAQ试剂盒说明书进行标记;等量、充分混匀标记后的样品,离心后备用。
2.4.3 强阳离子交换色谱(SCX)预分离 将标记好的混合肽段复溶后进行梯度洗脱;并根据峰型和时间收取梯度组分,除盐后冻干。继而行蛋白质液相色谱-电喷雾电离串联质谱法(LC-ESI-MS/MS)分析。最后进行纳升液相色谱仪分离(每个组分上样 5 μL)后采集数据。
2.5 生物信息分析 本次使用数据库为IPI(International Protein Index)Rat(39925 sequences), 并 使用蛋白质鉴定软件Mascot 2.3.02软件进行分析。通过生物信息学分析工具DAVID在线分析对鉴定的蛋白进行GO(Gene Ontology)功能注释、定位分析及功能富集分析。当蛋白丰度比的差异倍数达到1.2倍以上,且经统计检验P<0.05时,视为差异蛋白。检索参数设置见表1。
3 结 果
3.1 质谱基本鉴定信息和质量评估 通过Mascot软件进行分析,得到总的二级谱图数:347 098张,匹配到的谱图数量60 622张,共鉴定出iTRAQ标记定量信息的肽段15 272个,特有肽段14 342个,蛋白3 631个。我们从图1中看到,在全扫描范围内绝大部分的离子delta值(即偏差)显示以0为中心的正态分布,都集中于±10 ppm之间。


图1 肽段的质量准确度分布图
3.2 GO注释 GO功能注释具有三级结构的标准定义,包括生物过程(biological process,BP)、分子功能(molecular function,MF)和蛋白质所属的细胞组分(cellular component,CC)三个层次,蛋白质所属的细胞组分,即亚细胞定位。见图2。
3.3 肝脏组织差异蛋白质的筛选 本研究利用iTRAQ技术对各组大鼠肝脏进行蛋白组学分析,各组大鼠差异蛋白统计数量见表2,与糖尿病相关的差异蛋白见表3。
4 讨 论
4.1 iTRAQ蛋白质组学 蛋白质组学的概念由澳大利亚科学家最先提出[15],研究技术从双向凝胶电泳技术逐渐发展至基于质谱鉴定的多维液相色谱分离技术[16]。其中被广泛应用的 iTRAQ技术是2004年美国应用生物系统公司推出的一种全新的蛋白质组分析技术[17]。该技术对低丰度蛋白检测的灵敏度高,蛋白覆盖率高,在iTRAQ标记过程中仍能保留常见的翻译后修饰位点[18]。以iTRAQ为标记的液相色谱质谱联用,是寻找差异表达蛋白和筛选与疾病相关的蛋白分子标志物的理想工具[19]。本研究共鉴定出iTRAQ标记定量信息的肽段15272个,蛋白3 631个。我们从离子的质量偏差分布图看出,所测得的肽段质量数稳定,偏差小,表明了仪器的准确度高,稳定性好,对后续研究提供质量保证。

图2 GO功能注释图
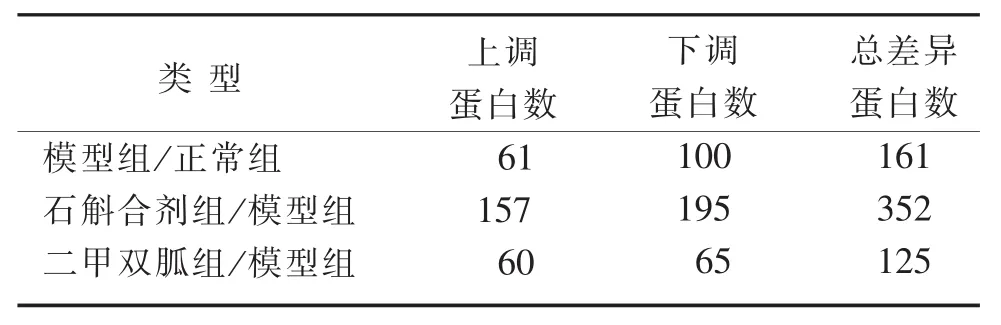
表2 各组大鼠差异蛋白统计数量
4.2 GO注释 针对鉴定出的差异蛋白进行GO功能注释,包括蛋白质所属的细胞组分(CC)、生物过程(BP)和分子功能(MF)三个层次,从而确认蛋白质在哪些分子功能或生物学过程显著富集。结果显示,在CC层次(图2A),细胞(cell)所占百分比最高为19.17%,接着依次是细胞部分(cell part)、细胞器(organelle)、细胞膜(membrane)、大分子复合物(macromolecular complex)等,GO功能分析显示,在细胞核、胞浆中表达的差异蛋白质所占比重较突出。在BP 层次(图 2B),细胞过程(cellular process)所占百分比最高为12.79%,接着依次是代谢过程(metabol-ic process)、单组织过程(single-organism process)、生物调节(biological regulation)等,揭示差异表达蛋白大多参与了细胞代谢过程、初级代谢过程、代谢合成、信号传导等。在MF层次(图2C),参与绑定(binding)功能的差异蛋白所占百分比最高为50.75%,接着依次是催化活性(catalytic activity)、酶调节活动(enzyme regulator activity)、结构分子活动(structural molecule activity)、蛋白结合转录因子活动(protein binding transcription factor activity)等,揭示这些蛋白参与酶的调节、转录活性、水解代谢反应等功能。

表3 与糖尿病相关的差异蛋白
4.3 肝脏组织差异蛋白质 本研究采用iTRAQ为标记的液相色谱质谱联用的新技术对各组大鼠肝脏进行检测,结果显示与正常组相比,模型组差异蛋白161种;与模型组相比,石斛合剂组总差异性蛋白数量为352种;二甲双胍组总差异性蛋白数量为125种。虽然鉴定出的差异蛋白数量较多,但亦有部分未知功能的蛋白,这里仅讨论与糖尿病及其并发症相关的蛋白。
高血糖是导致铁蛋白增高的主要因素[20],流行病学研究提示高铁蛋白水平和糖尿病的发生呈正相关[21],是糖尿病的危险因素[22]。 本研究结果显示模型组铁蛋白轻链1较正常组升高,这与课题组前期糖尿病大鼠肝脏蛋白芯片的结果一致[23],说明糖尿病大鼠铁代谢异常。而模型组下调的ApoE是一种主要由肝脏产生的糖基化分泌蛋白,参与脂质的运输、储存及排泄过程,抑制血小板积聚[24],一旦其构象或浓度发生了变化,将导致血脂代谢异常,进而引发糖尿病,因此 ApoE基因成为糖尿病的常见候选基因之一[25]。金属硫蛋白(metallothionein,MT)所含的半胱氨酸能与金属相结合,具有强大的自由基清除能力,其亚型MT-Ⅰ/Ⅱ主要分布在肝和肾。MT通过增加葡萄糖利用及能量供应,抗氧化应激,抑制细胞凋亡来减少糖尿病导致的心脏损伤和肾损伤[26]。本研究中结果显示模型组中MT-Ⅰ/Ⅱ明显下调,可能与糖尿病及其心、肾并发症相关。
甲羟戊酸激酶(mevalonate kinase,MVK)是体内胆固醇代谢途径的重要限速酶[27],该途径先以乙酰辅酶A为原料并在MVK的催化作用下最终生成胆固醇、法呢基焦磷酸等。本研究结果显示乙酰辅酶A乙酰转移酶、MVK、法呢基焦磷酸合酶在模型组中均出现了上调,提示甲羟戊酸途径被激活,说明糖尿病大鼠肝脏的脂代谢活跃。
脂肪酸结合蛋白广泛存在于机体多种组织内,包括脂肪细胞型、表皮型、心肌型、肝脏型等,具有介导脂肪酸转运、调节胆固醇代谢的功能,与炎症反应密切相关[28],并参与胰岛素信号转导过程,其表达水平影响多种肝脏病变,被认为可成为肝损伤的监测指标[29]。 Yeung 等[30]研究发现表皮型脂肪酸结合蛋白与血肌酐、肾小球滤过率呈显著相关,并有可能是预测糖尿病肾病发生发展的独立危险因素。本研究中模型组上调的表皮型和心肌型脂肪酸结合蛋白除了影响糖尿病大鼠糖脂代谢以外,可能与糖尿病肝肾并发症相关。
蛋白的泛素化修饰过程失调在癌症、代谢综合征等疾病中发挥重要作用。泛素化因子E4B能将泛素链信号由非降解型转换为可降解型,以促进修饰底物的降解[31]。本研究结果显示模型组E4B下调,推测糖尿病模型大鼠出现泛素化修饰过程异常。组蛋白H2A的泛素化修饰参与了DNA损伤修复[32],对维持基因组的稳定性有重要意义,本研究结果中模型组的组蛋白H2A相关基因(histone H2A.Z)表达降低,使其不能及时参与DNA损伤修复过程,可能与大鼠糖尿病及其并发症的发生有关。
原肌球蛋白是一种细肌丝相关蛋白,其表达量下降可以使细胞骨架重组,形态发生变化,参与纤维化和癌症等疾病进程中的上皮-间质转化[33]。本研究结果显示,糖尿病模型大鼠原肌球蛋白α-1链异构体H、原肌球蛋白α-4链在模型组均出现下调,推测可能与糖尿病肝纤维化进程中的上皮-间质转化有关。这些肝细胞骨架蛋白或结构蛋白的改变可导致肝脏细胞形态学的改变,继而引起肝损伤甚至肿瘤。
这些模型组较正常组上调或下调的蛋白涉及细胞结构、能量代谢-电子传递、翻译的调控及翻译后修饰、物质转运、氨基酸代谢、脂肪酸氧化等方面,说明糖尿病模型大鼠存在着诸多代谢紊乱,这些差异蛋白直接或间接地影响糖尿病的发生和发展。经石斛合剂和二甲双胍治疗后,模型组上调和下调的部分蛋白出现一定程度的恢复,如石斛合剂治疗后,乙酰辅酶A乙酰转移酶、脂肪酸结合蛋白、等下调,而ApoE、原肌球蛋白 α-1链异构体H等上调;二甲双胍治疗后乙酰辅酶A乙酰转移酶、脂肪酸结合蛋白等下调,而金属硫蛋白1、组蛋白、泛素化因子E4B等上调。由此可见经石斛合剂组和二甲双胍组治疗后趋向恢复的蛋白种类存在不同,这表明中药复方石斛合剂与西药二甲双胍对糖尿病大鼠的靶蛋白的影响不一样。由于糖尿病发病机制复杂,病变累及全身多系统多器官,质谱分析的数据复杂度高,后续研究将进一步结合信号通路进一步探讨糖尿病的分子机制,为石斛合剂的临床应用提供理论基础。

